喉鳞状细胞癌相关microRNA的筛选及功能鉴定
刘浩,穆兰,黄志伟,杨瑞明,宫亮
(锦州医科大学附属第一医院,辽宁 锦州 121000)
喉鳞状细胞癌(laryngal squamous cell carcinoma,LSCC)是头颈部第二大常见的恶性肿瘤,仅次于鼻咽癌,病因至今仍不十分明了,其发生可能与吸烟、饮酒、病毒感染、放射线、性激素等因素有关。目前LSCC的治疗方式主要是手术切除肿瘤结合放疗和化疗[1]。尽管治疗技术有所提高,但LSCC的生存率并没有显著提高[2]。因此迫切需要寻找新的喉癌靶向治疗,以延长患者的生命并提高患者的生存质量。
第二代测序技术又称下一代测序技术(next generation sequencing,NGS),是近年来新兴的一项比较成熟的转录组学测序技术,可同时对数以百万的基因进行序列测序并筛选差异表达的基因。miRNA是一类大小为19~25个核苷酸组成的非编码小RNA分子,通过结合mRNA的3'端,导致mRNA沉默或降解影响其表达水平。研究表明miRNA的异常表达与肿瘤的发生发展密切相关。大量研究表明[3-4],miRNA在喉癌的发生发展中起着重要的调控作用。本研究通过第二代测序技术与生物信息学方法的结合,并通过qRT-PCR在临床样本上去验证去筛选差异表达的miRNA,并期望对喉癌的临床诊断、治疗及预后提供重要信息。
1 材料与方法
1.1 材料
研究样本:临床收集2019年1月至2020年10月就诊于锦州医科大学并接受手术治疗的33例患者的喉癌组织及癌旁组织(>0.5 cm),所有患者在行手术前均未接受过放疗和化疗等治疗方式。所有标本切除后取部分喉癌及癌旁组织(与肿瘤安全界>0.5 cm),迅速放入液氮中并转-80 ℃冰箱保存。病理采集过程及后续实验均得到知情者同意以及医学伦理委员会批准,且为患者签署保密协议。
主要试剂:TRIzol试剂、反转录试剂盒(Invitrogen,美国);miRNeasy Mini Kit(总RNA抽提试剂盒,Qiagen,德国);RNA Nano 6000检测试剂盒、SYBRGreenPCR试剂盒(罗氏公司);文库制备试剂盒(Illumin,美国) ;miR-106a-5p引物购自北京擎科生物科技有限公司。仪器:分光光度仪(NanoPhotometer,美国);核酸样品分析仪(Agilent Bioanalyzer2100,美国);第二代DNA测序系统(Illumina Hiseq4000,美国);实时定量PCR检测仪(Roche Light CyclerTM480,瑞士)。
1.2 方法
1.2.1 RNA提取及质量鉴定
取喉癌及癌旁组织样本各20 mg,按照TRIzol和miRNeasy Mini Kit试剂盒提供的说明书要求提取总RNA,应用NanoPhotometer分光光度仪对提取的总RNA进行纯度及浓度检测,使用Agilent Bioanalyzer 2100系统的RNA Nano 6000检测试剂盒评估RNA完整性、质量及分布。
1.2.2 miRNA测序文库的制备与测序
随机抽取3例患者的喉癌组织及癌旁组织的总RNA进行cDNA文库的建立和测序。每个样本总RNA量为3 μg用于下一代测序实验,采用Illumina的NEBNext Multiplex Small RNA Library Prep Set制备cDNA文库。将获得的小RNA文库在生物分析仪(Agilent,High Sensitivity DNA Kit)上进行定量,合并,并使用3%凝胶BluePippin HT (Sage Science)提取适当范围的cDNA片段(140~160 bp)。文库最终长度范围在安捷伦Bioanalyzer 2100 (Agilent)上用高灵敏度DNA试剂盒进行验证,仅包含部分微小RNA。最后用第二代DNA测序系统(Illumina Hiseq4000)对构建获得的cDNA文库进行测序,获取的信息通过计算机进行分析,并对微小RNA序列进行解码和注释[5]。
1.2.3 差异miRNA的生物信息学分析
首先使用Cutadapt软件修剪并去除质量评分较低的碱基序列和测序得到的序列3′和5′接头,并去除短17 bp的修剪序列。然后对剩余序列质量进行验证(FastQC软件),进而初步完成对数据的筛选。 然后用miRDeep2 v2.0.0.7软件的quantifier.pl模块[6]和SeqBuster软件的miraligner[7]使用默认参数,以前体和成熟miRNA序列作为参考,对过滤后的reads进行miRNA和isomiRNA定量 (miRBase v21)。利用“DESeq2”R中实现的负二项广义线性模型,对3组喉癌和癌旁样本中的miRNA进行差异表达的分析,以P<0.05且log2(fold change,FC)>1判定为表达具有显著差异性。通过绘制火山图展现喉癌组织中有显著性差异表达的miRNA,以红点表示喉癌组织中表达显著上调,绿点表示表达显著下降;取差异表达明显的miRNA,通过绘制聚类分析热图,展现miRNA在不同组织样本中的表达情况,红色代表高表达,蓝色代表低表达。通过绘制维恩图,展现筛选出的miRNA在喉癌与癌旁组织的分布情况。
1.2.4 qRT-PCR
随机挑取1种差异表达明显的miRNA(miR-106a-5p),采用qRT-PCR检测miR-106a-5p在30例喉癌及癌旁组织中的表达水平,并对比二代测序结果。 将30组提取好的总RNA,按逆转录试剂盒合成cDNA,然后进行qRT-PCR,反应条件为:95 ℃ 60 s、95 ℃ 10 s、60 ℃ 15 s(40个循环)。本反应以U6 snRNA为内参基因,应用7500 System SDSSoftware软件,统计ΔΔCt值,并以2-ΔΔCt值代表miR-106a-5p的表达水平。引物序列见表1。

表1 引物序列
1.3 统计学方法

2 结 果
2.1 RNA抽提结果
经NanoPhotometer分光光度仪检测结果显示,喉癌及癌旁组织中抽提获得的RNA的D260 nm/D280 nm值均为1.8~2.1,说明提取的总RNA有较好的纯度。经过Agilent Bioanalyzer 2100检测结果显示,RNA的RIN值≥6,数据表明提取的总RNA具有较好的完整性。样本提取的RNA总量≥3 μg,具备二代测序的要求。
2.2 差异表达miRNA的可视化分析
本次测序共检测到1624种miRNA,其中差异表达明显miRNA的共44种,其中23种在喉癌组织中显著下调,21种在喉癌组织中显著上调。miRNA的差异表达见火山图1,聚类分析热图见图2,miRNA在喉癌及癌旁的分布情况见维恩图3。
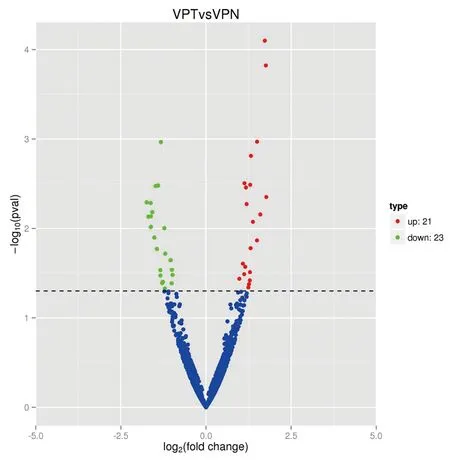
绿点表示显著下调,红点表示显著上调,蓝点表示无明显差异
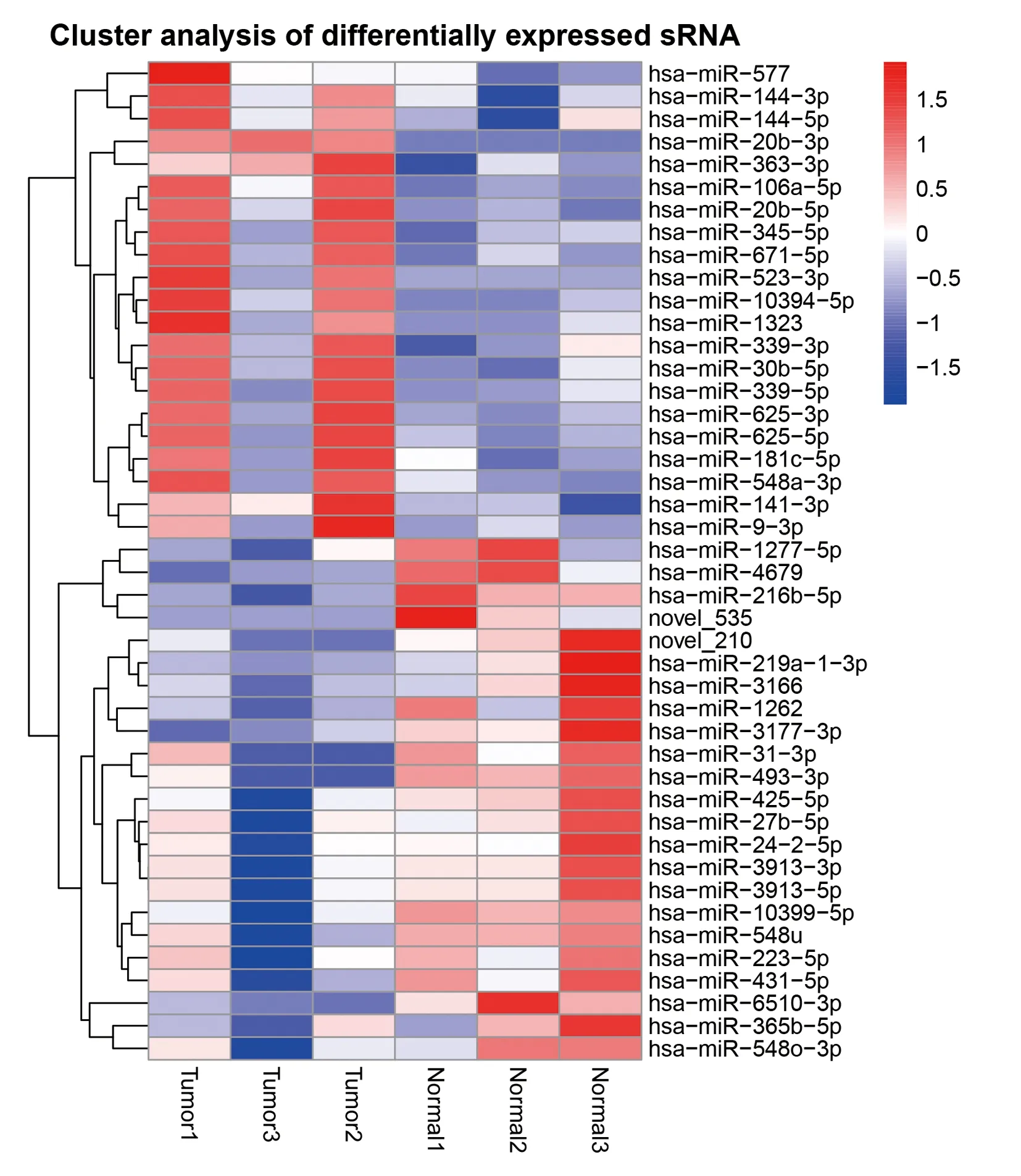
红框代表高表达,蓝框代表低表达,Tumor代表喉癌组,Normol代表癌旁组
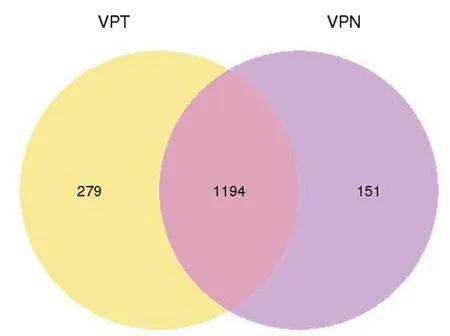
差异miRNA分布情况,VPT代表喉癌组,VPN代表癌旁组
2.3 qRT-PCR结果及验证
在46种差异表达明显的miRNA中随机抽取1种(miR-106a-5p),其二代测序结果显示在喉癌组织中表达上调,见表2。qRT-PCR检测结果,miR-106a-5p在30例喉癌组织中的表达水平为(5.71±1.65),癌旁组织中的表达水平为(2.66±0.87),差异具有统计学意义(P<0.05),与二代测序结果一致,见图4。
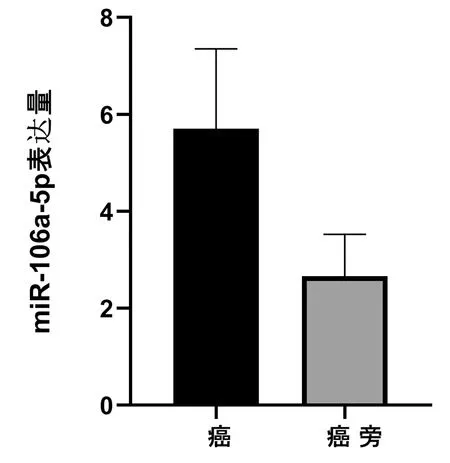
图4 miR-106a-5p在30组喉癌及癌旁组织的表达水平

表2 癌组织及癌旁组织中miR-106a-5p表达水平
3 讨 论
第二代测序技术为分析miRNA的生物学信息研究提供了新的思路,它可同时分析miRNA的表达水平和序列变化[8]。与其他需要使用预先设计的探针的微阵列或qRT-PCR方法不同,第二代测序技术可以识别分析样本中存在的所有miRNA分子,而不受新的miRNA和新序列亚型[9]的影响。miRNA是一种短链非编码小RNA,通过与转录本[10]中的互补序列结合抑制蛋白编码基因的表达。虽然关于miRNA的所有生物学功能尚未明确,但已有研究表明,miRNA可以调控至少一半的人类蛋白编码基因的表达,包括致癌基因和抑癌基因[11-12]。因此,应用第二代测序技术去研究发掘差异性表达的miRNA,并为临床治疗提供有价值的生物靶点具有重要的临床意义。
本研究通过第二代测序技术与生物信息学方法的结合方法,从3组喉癌及癌旁组织中共筛选出1624种miRNA,其中差异表达明显的miRNA共有44种,23种在喉癌组织中表达显著下调,21种在喉癌组织中表达显著上调。经过qRT-PCR验证表明,miR-106a-5p在30组喉癌组织的表达水平明显高于癌旁组织,与二代测序结果一致。虽然此次测序成功筛选的miRNA并不多,而且显著差异性表达的miRNA占比比较少,但是它们潜在的临床价值是非常巨大的。譬如我们经过qRT-PCR验证并筛选的miR-106a-5p已经在相关肿瘤性疾病中进行了大量的研究。研究表明,miR-106a-5p在肺癌[13]、卵巢癌[14]中高度表达,并促进癌症细胞的增殖及迁移,然而在肾癌[15]中表达下调,并通过调控VEGFA抑制癌症细胞的增殖及迁移。然而关于miR-106a-5p与喉癌的相关性分析尚不明确,有待于进一步实验去研究。
喉鳞状细胞癌的发生与发展是复杂而多变的病理过程。而miRNA在机体的生长、细胞凋亡、分化、代谢和肿瘤性疾病的发生发展中均展现了强大的调控能力。因此提高miRNA与喉癌之间的发病机制的认知尤为重要。本次实验二代测序及qRT-PCR验证的样本相对较少,且筛选出差异性表达明显的miRNA并不多,将来可以投入更大量的样本中去筛选、验证有价值的miRNA。
综上所述,应用二代测序技术去筛选疾病相关miRNA是一条高效率且快捷的途径,为探索喉癌的分子机制提供了重要思路,也为临床寻找新的生物靶点奠定了基础。

