骨密度测定在糖尿病骨质疏松症影响因素中的应用①
丁度宇,林木贵,吴君宇
(南海经济开发区人民医院内科, 广东 佛山 528000)
糖尿病患者出现骨质疏松及骨折的风险相对于非糖尿病患者均明显升高。数据显示,2型糖尿病患者髋骨骨折的发生风险较非糖尿病患者增加1.7倍[1]。骨折疏松性骨折对于中老年人危害巨大,尤其是老年人致死致残的主要原因之一[2]。因此,对于糖尿病合并骨质疏松的患者,早期的筛查,明确其影响因素并进行干预,对于降低患者死亡率、减轻社会负担,具有重要意义。本文以2型糖尿病合并骨质疏松为结局指标,运用多因素分析探讨2型糖尿病合并骨质疏松症的影响因素,为其干预提供指导意义,现报道如下。
1 资料与方法
1.1 一般资料
1.1.1 研究对象与分组:选取于2020-01~2020-12于南海经济开发区人民医院内分泌科就诊的患者,对患者进行血糖水平及骨密度检测,根据病史、血糖水平、骨密度测定结果将患者分为2型糖尿病伴骨质疏松组(观察组)、2型糖尿病非骨质疏松组(对照组)及非糖尿病组(正常组)。本研究经本院伦理委员会批准,且所有患者均详细了解研究内容,签订知情同意书。
1.1.2 纳入标准:① 年龄18~60岁;② 知情同意且配合资料的采集;③ 患者近6个月内未接受骨质疏松的药物干预。
1.1.3 排除标准:① 1型糖尿病患者;② 因合并其它疾病引起的继发性骨质疏松(如甲状旁腺功能亢进、风湿性疾病、肾脏疾病等); ③ 长期服用糖皮质激素患者。④ 因疾病需长期卧床者;⑤ 合并糖尿病肾病,肾功能不全患者。
1.2 方法
1.2.1 资料收集: 收集患者的各项临床资料,包括性别、年龄、病程、身高、体重、腰围、臀围、吸烟史、饮酒史、女性月经史等。
1.2.2 血清糖代谢指标检测: 清晨空腹采集患者静脉血5mL,测定其空腹血糖(FBG)、糖化血红蛋白(HbA1C)、空腹C肽(CP)水平。以上指标通过生化检测仪(罗氏 Cobas 8000 e602、伯乐BIO-Rad D-10等)测定,其中空腹血糖通过葡萄糖氧化酶法测定,糖化血红蛋白通过高效液相色谱法测定,空腹C肽通过电化学法测定。2型糖尿病诊断标准参照《中国2型糖尿病防治指南(2017年版)》[3]。
1.2.3 骨密度检测: 使用双能X线骨密度仪(美国GE,Lunar-Prodigy)对患者进行骨密度检测,检测位置为患者的正位腰椎(L1-4)与左股骨近端。骨质疏松症的诊断标准参照WHO制定的标准[2]:以同性别同部位峰值BMD为基准,正常值为骨峰值的±1 个标准差,骨量减少为低于骨峰值的1~2.5个标准差,骨质疏松为低于骨峰值的2.5个标准差。
1.3 统计学方法
采用SPSS 26.0软件进行统计学分析。计量资料采用配对t检验,组间比较采用方差分析。计数资料以n(%)表示,进行χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
研究共纳入180例患者,观察组60例,对照组60例,正常组60例。其中男92例,女88例,年龄32~60岁(52.38±7.46)岁,病程3(1~14)年,BMI18.40~32.53(23.55 ±2.89)kg/m2。3组间一般临床资料比较见表1。
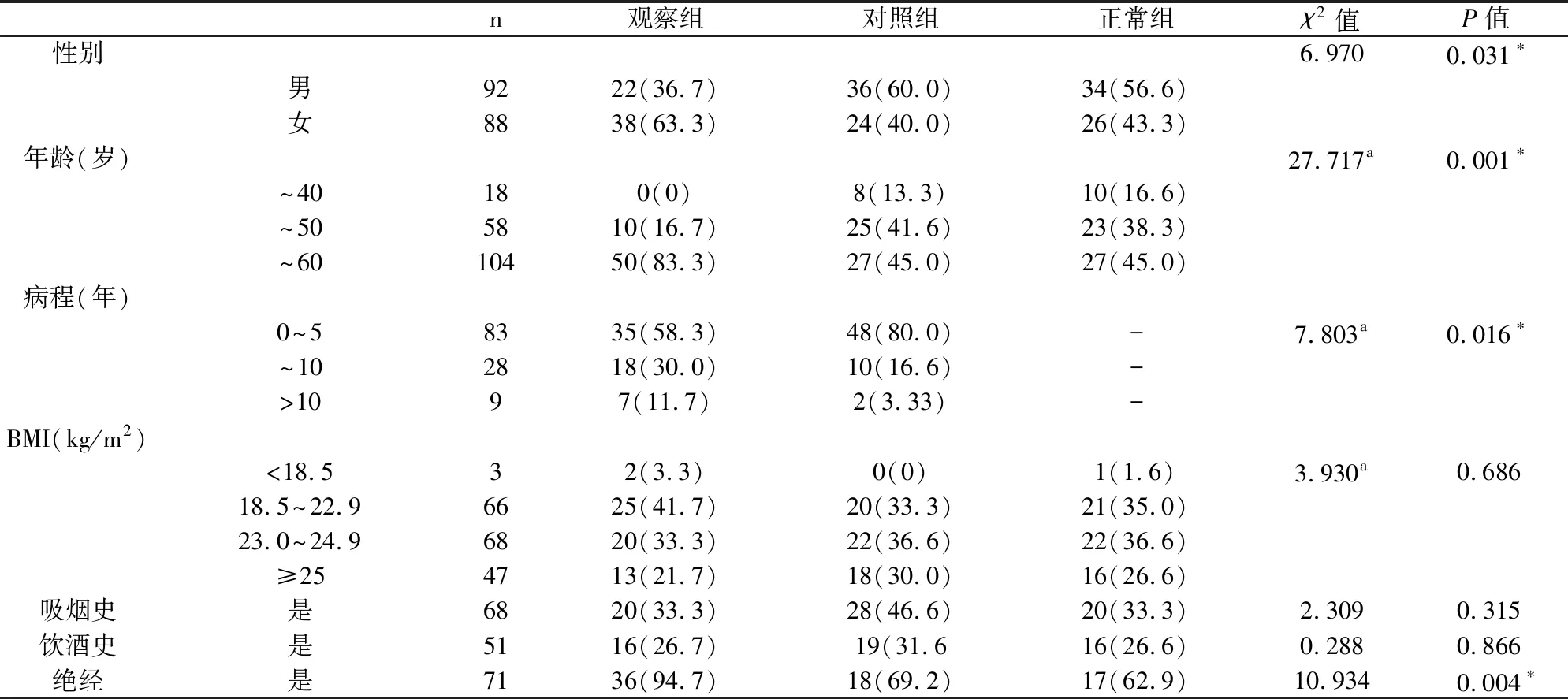
表1 3组患者一般临床资料比较[n(%),n=60]
2.2 3组患者左股骨近端、腰部骨矿含量比较
2型糖尿病患者无论是否合并骨质疏松,其左股骨近端骨质密度均较腰部降低,差异均具有统计学意义(P<0.05);而于正常组未观察到此种现象(P>0.05)。观察组的骨质密度均较正常组及对照组下降,差异具有统计学意义(P<0.05)。
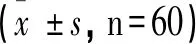
表2 3组患者左股骨近端、腰部骨矿含量比较
2.3 3组患者的FBG、HbA1C、CP对比
3组患者的FBG、HbA1C、CP均存在显著差异,差异均具有统计学意义(P<0.05),见表3。
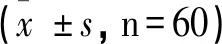
表3 3组患者的FBG、HbA1C、CP对比
2.4 糖尿病型骨质疏松症各影响因素的多因素Logistic回归分析
多因素回归分析显示,年龄、FBG、HbA1C、CP、均为糖尿病合并骨质疏松的独立危险因素(P<0.05),见表4。
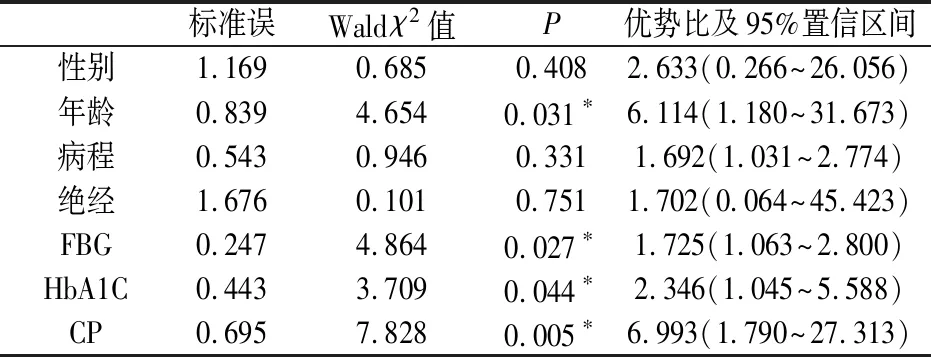
表4 糖尿病患者骨密度影响因素多因素Logistic回归分析
3 讨论
2型糖尿病相关的大血管损伤及微血管病变常被临床医师所重视,然而,对于2型糖尿病合并骨质疏松的关注较少。流行病学显示,糖尿病患者中, 约1/2~2/3会伴有骨密度降低,其中有近1/3的患者出现骨质疏松[4]。如何进行早期筛查,并针对其相关的影响因素进行干预,对于2型糖尿病合并骨质疏松的防控具有重大的意义。本研究发现,无论是观察组还是对照组,在2型糖尿病患者中,左股骨近端的骨质密度较腰椎下降得更为明显。双能X线骨密度目前仍是糖尿病合并骨质疏松诊断、疗效评估的最常见手段[5]。然而既往研究显示,在一定的年龄段,股骨近端及腰椎的T值存在差异[6]。以股骨近端作为骨密度检测的主要部位,可更为敏感筛查2型糖尿病患者是否出现骨质下降。
另外,本研究发现年龄、空腹血糖、C肽、HbA1C等指标均为糖尿病出现骨质疏松的独立危险因素。这表明控制糖代谢指标可以预防患者骨质疏松的发生。其它相关研究亦支持这一观点[7,8]。一项对于2型糖尿病患者的调查显示[9], 2型糖尿病患者中骨量减少和骨质疏松的患病率分别为41.3%、9.2%,其中血糖控制好者与血糖控制差(HbA1c>7.5%)相比,骨质疏松和骨量减少风险降低63%。
2型糖尿病引起的骨代谢变化机制较为复杂,现认为2型糖尿病对骨质代谢的影响主要有以下三点:① 血糖升高引起渗透性利尿,肾脏对于钙、磷的重吸收减少,血钙水平降低促进甲状旁腺激素代偿性上升,进一步激活破骨细胞功能,增加钙磷动员,诱发骨质疏松[10];② 2型糖尿病患者糖基化终末产物(AGEs) 的异常蓄积,一方面刺激活性氧(reactive oxygen species,ROS)分泌增加,从而抑制成骨细胞的增殖、分化及功能[11]。同时,AGEs 引发氧化应激诱导成骨细胞和破骨细胞的炎症反应,从而参与到糖尿病骨质疏松的病变过程[12]。③ 高血糖可抑制胰岛素样生长因子(IGF-1)的表达。IGF-1 对于成骨细胞的增殖、分化,提高成骨细胞的功能,刺激成骨细胞合成大量的骨胶原。是评价骨量状态重要标志物。已有证据表明,2型糖尿病中骨质疏松风险更高的患者,血清 IGF-1 水平明显下降[13],对于血糖水平进行合理控制后,血清 IGF-1 水平上升同时伴随着骨量的上升,两者呈现正相关关系。
本研究没有考虑不同降糖药物对于骨质疏松的影响,这是本研究的不足之处。而在治疗中,中老年人常多种慢病共存,多种药物合用现象突出。在不同状态下、多种药物合用均会导致药动学的改变,影响疗效,需要引起临床医师、药师的重视,最大限度减少多药联合治疗的药源性损害[14]。另一方面,临床医师在降糖方案时,需充分考虑糖尿病合并骨质疏松患者的特殊性,降糖治疗时要尽量减少低血糖风险,从而降低跌倒风险[15]。对中老年糖尿病合并骨质疏松症患者个体化综合评估基础上的合理干预治疗可能会增加治疗的针对性和依从性,降低药物不良反应,提高生活质量。

