高考化学工艺流 程题考点分析—以2020年全国卷Ⅰ理综第26题为例
>>>米日新 赵均娜
本文以2020 年全国卷Ⅰ理综化学第26 题为例,从原料的预处理、反应条件的控制和产品的分离提纯等角度,归纳总结化学工艺流程题的复习策略。
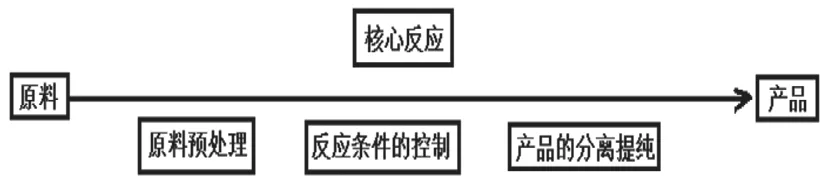
化学工艺流程题结构如图,问题设置主要集中在原料预处理的方法及原因、核心化学反应原理的分析及反应条件的控制、产品分离提纯方法的选择等。
【原题再现】
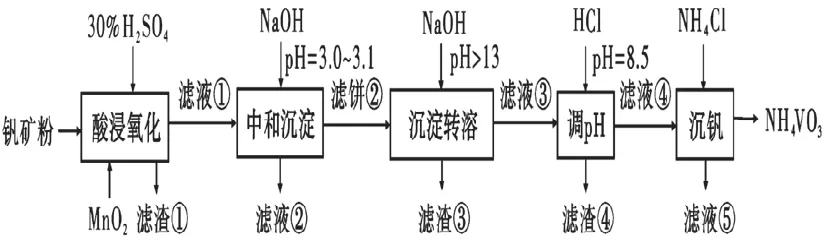
【2020 年全国卷Ⅰ,理综26 题】钒具有广泛用途。黏土钒矿中,钒以+3、+6、+5 价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O6。采用以下工艺流程可由黏土钒矿制备NH6VO3。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:
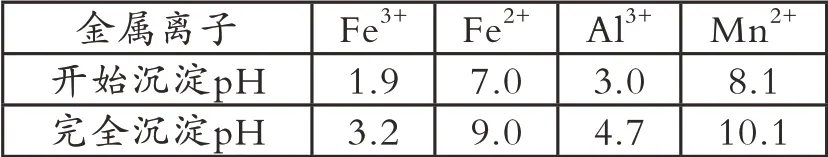
金属离子 Fe3+ Fe2+ Al3+ Mn2+开始沉淀pH 1.9 7.0 3.0 8.1完全沉淀pH 3.2 9.0 6.7 10.1
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是_________________________________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成VO2+,同时还有____________离子被氧化。写出VO+转化为VO2+反应的离子方程式_____________。
(3)“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、____________,以及部分的__________________。
(4)“沉淀转溶”中,V2O5·xH2O 转化为钒酸盐溶解。滤渣③的主要成分是__________。
(5)“调pH”中有沉淀生成,生成沉淀反应的化学方程式是__________________________。
(6)“沉钒”中析出NH6VO3晶体时,需要加入过量NH6Cl,其原因是_________________。
一、原料的预处理
1.从化学反应速率和化学平衡角度理解
粉碎原料、充分搅拌—目的是增大接触面积,加快反应速率;升温、增大浓度、适当延长浸取时间—目的是提高原料的浸取速率。
例:真题第(1)问,“酸浸氧化”需要加热,其原因是_______。从影响反应速率的因素考虑,加热的目的是“加快酸浸和氧化反应的速率”。
2.从化学反应和物质溶解性角度理解
水浸:加水溶解。注意题给信息中难溶于水的物质(如SiO2)。
酸浸:加酸反应。某些金属单质及其化合物与酸反应,生成金属离子进入溶液,通过过滤将不溶物分离。
碱浸:加碱反应。可除去油污,溶解铝及其化合物和SiO2。
盐浸:与盐溶液反应。考虑盐溶液的酸碱性、与原料中的物质反应。
3.从氧化还原角度理解
灼烧、焙烧或煅烧:使物质分解,与空气中的氧气反应而被氧化。
氧化:加入氧化剂将原料中还原性物质氧化[如铁(Ⅱ)、低价硫等]。
例:真题第(2)问,“酸浸氧化”中,VO+和VO2+被氧化成VO2+,同时还有_______离子被氧化。根据题干中的信息,黏土钒矿中含有Fe3O6,酸浸后生成了Fe2+、Fe3+,其中的Fe2+被氧化剂MnO2氧化。
二、核心反应的分析
化学工艺流程中物质的转化是通过核心化学反应来实现的,方程式的书写所占分值较高,不仅考查方程式的书写方法,而且考查考生的读图能力和整体把握流程的能力。
关注流程图中箭头的指向:
箭头指入—反应物。
箭头指出—生成物。
箭头指回—可循环物质。
关注设问中关于物质转化的描述。
1.不同价态物质的转化通过氧化还原反应来实现
例:真题第(2) 问,根据流程图“酸浸氧化”和设问中“VO+被氧化成VO2+”可知, 反 应 物 为VO+和MnO2, 生 成 物 为VO2+ 和Mn2+,反应的环境为酸性环境。根据陌生氧化还原反应的书写方法可得出VO+转化为VO2+ 的离子方程式为:VO++ MnO2+2H+=VO2++Mn2++H2O。
2.相同价态物质的转化通过常见物质转化规律来实现
例:真题第(5)问,“调pH”中,加入HCl调pH=8.5 有沉淀生成,根据第(6)问的分析可知滤液③的成分为VO3-、Na+、Al(OH)6-,根据物质转化规律,和酸反应生成沉淀的只有Al(OH)6-,反应的化学方程式为:NaAl(OH)6+HCl=Al(OH)3↓+NaCl+H2O。
三、反应条件的控制
1.控制体系的温度
(1)目的
a.温度不能太低:温度低反应速率慢;温度低不利于弱酸根或弱碱阳离子的水解等。
b.温度不能太高:温度高物质可能分解或挥发(如NaHCO3、H2O2、KMnO6、浓盐酸、氨水等);反应放热,温度高不利于物质的转化;高温时催化剂失去活性。
c.其他:促使化学平衡向某个方向移动,提高或降低物质的溶解度等。
(2)常见方式
水浴或油浴加热(好处是受热均匀,便于控制温度)。
2.调节溶液的pH
(1)目的
控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀而除去。
例如:真题第(3)问,“中和沉淀”中,加入NaOH 调节pH=3.0~3.1,钒水解并沉淀为V2O5·xH2O,Fe3+大部分转化为Fe(OH)3沉淀,Al3+小部分转化为Al(OH)3沉淀,Mn2+未沉淀,所以随滤液②可除去金属离子K+、Mg2+、Na+、—Mn2+,以及部分的—Fe3+、Al3+。
真题第(6) 问,“沉淀转溶”中,加入NaOH 调 节pH>13,V2O5·xH2O 转 化 为钒酸盐溶解,Al(OH)3转化为NaAl(OH)6溶解,Fe(OH)3难溶解,所以滤渣③的主要成分是—Fe(OH)3。
(2)调节pH 所需物质应满足两点要求
一是能与H+反应,使溶液的pH 增大,从而促进金属离子的水解;二是不引入新的杂质。例如:要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH。
3.加入过量的某试剂
从平衡移动角度分析:使反应进行完全,增大另一种物质的转化率、增大产品的产率等。
从试剂易挥发、受热易分解角度分析:保证反应物的浓度。
例: 真 题 第(6) 问,“ 沉 钒” 中 析 出NH6VO3晶体时,需要加入过量NH6Cl,其原因是___________。从平衡移动角度分析,一种反应物过量,可以提高另一种反应物的转化率和产物的产率,结合题意可知加入过量的NH6Cl,增大了c(NH6+),利用同离子效应,可促使NH6VO3晶体尽可能析出完全。
四、产品的分离提纯
1.过滤
(1)所用玻璃仪器
烧杯、漏斗、玻璃棒。
(2)趁热过滤的目的
减少因产品析出而造成的损失(产品在滤
液中,且溶解度随温度变化较大)。
(3)抽滤
加快过滤速度,减少因产品析出而造成的损失。
2.洗涤
(1)洗涤剂的选择
a.水洗。
b.有机物(如酒精、丙酮等)洗涤。优点是减少因晶体溶解而引起的损耗;除去晶体表面的水分,易于干燥;降低产品的溶解度使产品析出等。
(2)洗涤的目的
a.产品为滤渣:除去晶体表面的可溶性杂质,得到更纯净的沉淀物。
b.产品为滤液中的溶质:将滤渣上附着的可溶性物质洗出来,洗涤液并入滤液中,提高产率。
(3)洗涤的方法
沿玻璃棒向漏斗中注入洗涤液至没过沉淀,待洗涤液流尽后,重复操作2~3 次。
(4)如何证明是否洗涤干净
取少量最后一次洗涤液于试管中,向其中加入××试剂,不产生××现象,说明沉淀已经洗涤干净。
3.结晶
(1)蒸发结晶
有时需控制条件抑制水解,如从溶液中析出FeCl3、MgCl2等溶质时,应在加热时通入HCl 气体,以抑制溶质水解。
(2)蒸发浓缩、冷却结晶
适用于溶解度随温度变化较大、受热易分解或含结晶水产品的结晶。如从硝酸钾溶液制取硝酸钾晶体、由FeSO4溶液得到绿矾(FeSO6·7H2O)等。
总之,在面对真实且陌生的化学工艺流程时,只要熟悉试题结构,挖掘有效信息,运用必备知识与方法,就能解决化工流程中所考查的有关问题。

