不同糖种类及浓度对百子莲‘Big Blue’体胚发生的影响
岳建华,史亚冰,李文星,董 艳,张 燕,李文杨*
(1.信阳农林学院园艺学院,河南 信阳 464100;2.信阳农林学院林学院,河南 信阳 464100;3.信阳市大别山区园艺植物遗传改良重点实验室,河南 信阳 464100)
【研究意义】碳源可为植物离体培养提供能量,合成细胞碳骨架,参与渗透压、氧化胁迫平衡的调节[1]。不同种类及浓度碳源可显著调节植物离体培养过程中的形态建成,影响植物器官发生途径(Organogenesis)或体细胞胚胎发生(Somatic embryogenesis,SE)效果[2]。不同植物、同种植物在离体培养不同阶段所需要的碳源种类及浓度不同[2]。蔗糖为最普遍应用的碳源,牡丹(Paeoniasuffruticosa)组织培养时,蔗糖效果优于可溶性淀粉、无水葡萄糖[3];麦芽糖利于棉花(Gossypiumhirsutum)胚性愈伤组织诱导,葡萄糖利于其胚状体的形成和植株再生[4];3 %蔗糖利于布朗百合(Liliumbrownii)离体再生[5];2 %葡萄糖利于山核桃(Caryacathayensis)胚性愈伤组织的诱导,而5 %的蔗糖利于其体胚萌发[6]。综上,碳源种类及浓度可显著影响离体培养的效果[2,7],对特定物种特定发育阶段进行精细的碳源调控可显著提升离体培养的效果。【前人研究进展】百子莲‘Big Blue’(Agapanthuspraecoxssp.orientalis‘Big Blue’)又称蓝百合,为蓝色大花品种,花姿优雅,具有极高的观赏价值,且抗逆性极强,在国内已逐步推广,市场前景广阔[8]。植物组织培养,尤其是SE技术成为百子莲快繁的重要途径[9]。虽然百子莲的SE体系已经建立[9-10],但植物体胚发生的机制仍是未解之谜[11],导致体胚发生效率较低。离体条件下,植物SE过程是一个受激素[12]、碳源[2,13]、活性氧(Reactive oxygen species,ROS)及培养环境[14]共同调控的复杂发育过程[15],目前百子莲SE体系的研究仅以PIC为激素、蔗糖作为碳源[9-10]。【本研究切入点】碳源对植物离体培养具有重要影响,但对百子莲SE的调节效果未见系统研究,尤其是在成熟胚发育阶段的调节效果及机理鲜有报道。【拟解决的关键问题】本研究拟利用胚性愈伤(Embryogenic callus,EC)为试材,通过蔗糖、葡萄糖、麦芽糖及浓度(2 %~4 %)[13]的比较,优化百子莲‘Big Blue’体胚发生体系,为百子莲SE快繁提供技术参考。同时,通过测定糖代谢、激素代谢、氧化胁迫等生理指标,初步揭示碳源种类及浓度对成熟胚发育的生理调节机制,丰富植物体胚发生理论。
1 材料与方法
1.1 试验材料
百子莲‘Big Blue’购自南京市彩虹花卉公司,2018年5月,选取5年生植株未开裂的小花苞,切取小花梗作为外植体进行愈伤组织的诱导,参照何叶[16]的方法。愈伤组织每月继代1次,7~9个月后,得到单细胞起源的EC,继代6个月后用于试验研究。选取状态一致、颜色鲜黄、结构疏松的EC。
1.2 试验设计
按照表1糖种类及浓度进行培养基配制。
1.3 培养基配制
称取MS干粉(Phytotech Lab M519)4.43 g·L-1、
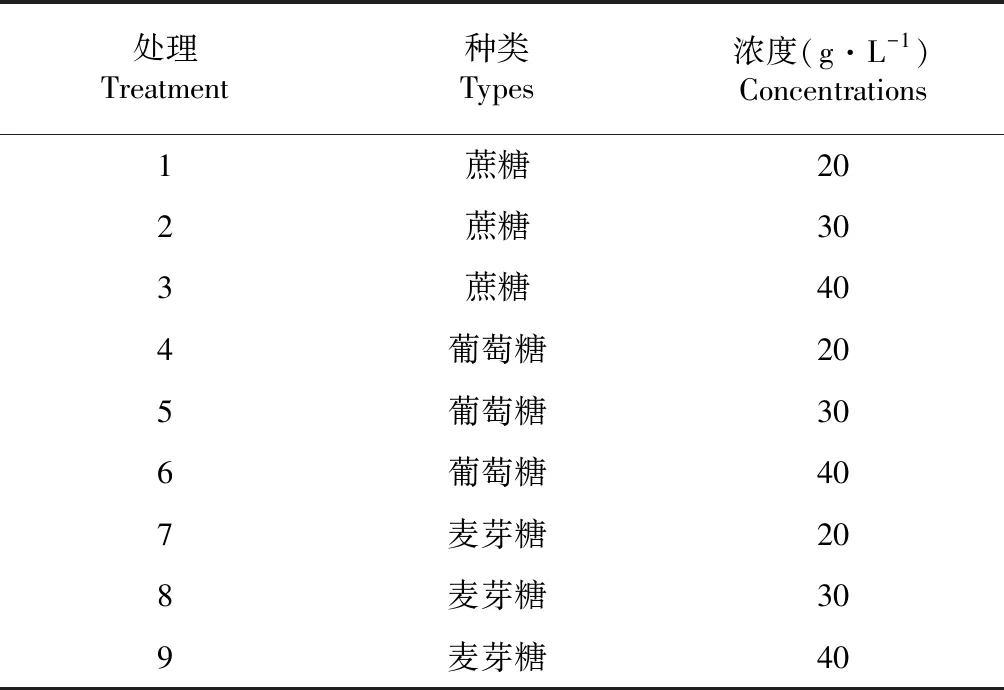
表1 培养基中糖种类及浓度
按2 %、3 %、4 %(w/v)浓度分别加入3种糖,用磁力搅拌器溶解混匀,1 mol/L NaOH溶液调pH至6.0,加琼脂粉7.0 g·L-1,121 ℃高压灭菌25 min,降温至60 ℃置于超净工作台内,分装至90 mm× 16 mm玻璃培养皿,每培养皿分装25 mL培养基,冷却至室温后接种。
1.4 材料接种
体胚诱导阶段,每个培养皿平板接种1.0 gEC,平分为大小基本相同的7个细胞团,每处理接种5个培养皿,重复3次。获得均匀一致的幼胚用于成熟胚发育阶段实验,接种方法同体胚诱导。
1.5 培养条件
幼胚诱导、成熟胚发育过程设温度(25±2) ℃,相对湿度65 %,暗培养1周后,转至光下培养(14 h/10 h,光/暗),光照强度为50 μmol·m-2·s-1。光下继续培养3周后统计数据。
1.6 数据记录
以诱导获得的幼胚及成熟胚数量作为数据统计指标,分别统计幼胚(≥1 mm,乳白色)和成熟胚(≥5 mm,具有完整植株结构,形态学上端转为绿色)数量。
1.7 生理测定
采用酶联免疫吸附法(ELISA)测定糖类、激素、活性氧与保护酶等生理指标,参照Pradko(2015)的方法[17],委托上海酶联生物科技有限公司测定。
1.8 数据分析
用Excel 2016、GraphPad Prism 5、Adobe Acrobat DC、Adobe Photoshop软件进行数据整理和制图,用IBM SPSS Statistics 20数据分析软件进行显著性检验(Duncan法,P< 0.05)。
2 结果与分析
2.1 不同糖种类及浓度对百子莲幼胚诱导的影响
由图1可知,3种糖及其浓度对体胚诱导效果具有显著影响,蔗糖的诱导效果相对较好,其次为葡萄糖、麦芽糖。其中3 %蔗糖处理成胚数量最多,平均为117.33个,显著高于其他各处理(P< 0.05),幼胚呈现松散的颗粒状,乳白色。3种浓度葡萄糖处理,对成胚数量影响不显著,其中3 %葡萄糖处理成胚数量较多,其次为2 %和4 %葡萄糖处理;葡萄糖处理幼胚的一致性较好,尺寸略小于蔗糖处理。以麦芽糖作为碳源的成胚数量较少,同步化效果较差。
2.2 不同糖种类及浓度对百子莲成熟胚发育的影响
不同种类和浓度糖对百子莲成熟胚发育存在显著影响,蔗糖相对较好,其次为葡萄糖、麦芽糖(图2)。其中2 %蔗糖处理成熟胚数量最多,为51.75个,显著高于其他各处理(P<0.05,图2-B),多为鲜绿色(图2-A),而4 %麦芽糖处理效果最差,平均为4.00个。随蔗糖浓度的提高,成熟胚数量逐渐减少。3种葡萄糖浓度处理对百子莲成熟胚数量影响不显著,其中2 %葡萄糖处理成熟胚数量相对较多。麦芽糖作为碳源的成熟胚数量最少,处理间差异不显著,3 %效果相对较好,多为黄绿色(图2-A)。
2.3 不同糖浓度对百子莲成熟胚发育糖代谢的影响
碳源对百子莲成熟胚发育期糖代谢具有显著影响(图3)。总糖含量测定结果显示,葡萄糖和麦芽糖处理整体上高于蔗糖处理,随着蔗糖浓度的升高总糖含量逐渐降低,与成熟胚数量的变化规律基本一致。而葡萄糖处理下,百子莲总糖含量差异不显著。麦芽糖处理下百子莲总糖含量最高(图3-A);百子莲淀粉含量的变化规律与总糖差异较大,蔗糖处理下淀粉含量相对较高,其中3 %蔗糖处理百子莲淀粉含量最高(图3-B);百子莲体胚组织内蔗糖含量在3种糖类浓度处理下呈现相似的变化规律,3 %浓度处理下百子莲内源蔗糖含量较低(图3-C);葡萄糖处理百子莲内源葡萄糖含量相对高,其中3 %葡萄糖处理显著高于其他处理(图3-D);百子莲麦芽糖的变化规律和总糖呈现出相似的规律,蔗糖处理下呈现梯度变化规律(图3-E);不同碳源处理下,百子莲果糖含量的差异相对较小(图3-F)。成熟胚发育阶段糖代谢分析结果表明,总糖、淀粉、蔗糖与麦芽糖含量与成熟胚发育相关性较强。
2.4 不同糖浓度对百子莲成熟胚发育内源激素含量的影响
碳源对成熟胚激素代谢存在显著影响(图4)。蔗糖处理下,IAA含量与成熟胚数量变化趋势相反,葡萄糖和麦芽糖处理下,IAA含量与成熟胚数量变化趋势相同,而IAA-氧化酶活性和IAA含量的变化趋势相反(图4-A,图4-C)。随着碳源浓度的升高,GAs总量出现升高的趋势(图4-D),GAs组分中GA3和GA4含量高于GA1;蔗糖处理下,GA1和GA4含量随浓度的升高而升高,而GA3含量随浓度升高而降低;葡萄糖处理下,GA4含量与成熟胚数量呈现相反的变化规律;麦芽糖处理下,GA1和GA3含量与成熟胚数量呈现相反的变化规律(图4-E,图4-G)。CTK和BR是除了生长素和GA之外调节植物生长的重要激素,蔗糖和麦芽糖处理下,两者含量变化呈现相反的规律(图4-H,图4-I)。蔗糖处理下,ABA含量相对较低,而葡萄糖和麦芽糖处理下,ABA含量相对较高(图4-J)。乙烯、JA含量的变化幅度相对较小,且趋势相似(图4-K,图4-L)。激素定量结果表明,生长素、GA因具有梯度变化规律,在成熟胚发育过程中可能作用显著。
2.5 不同糖浓度对百子莲成熟胚发育活性氧含量及保护酶活性的影响
不同糖处理对活性氧及保护酶活性具有显著影响(图5)。ROS活性与成熟胚发育数量趋势相似,在2 %蔗糖、2 %葡萄糖、3 %麦芽糖处理下相对较高(图5-A)。蔗糖处理下,·OH含量整体上高于葡萄糖、麦芽糖,但不同浓度蔗糖处理·OH含量差异不显著(图5-B)。H2O2含量整体上随着糖浓度增加而升高,葡萄糖处理下呈现梯度变化(图5-C)。
保护酶活性变化幅度大于ROS及其组分,POD、CAT活性规律性相对较弱(图5-D,图5-E)。SOD活性随着蔗糖浓度的升高而升高,但与成熟胚发育效果趋势相反(图5-F)。
3 讨 论
除了光自养体系,碳源是植物离体培养中不可或缺的因素[15]。碳源可构成细胞碳骨架,并为细胞呼吸代谢提供底物与能量[1],植物对碳源的需求因种类、基因型、发育阶段均有差异[15]。本研究发现百子莲体胚诱导及发育成熟阶段对碳源浓度的需求分别为3 %和2 %,蔗糖可作为百子莲SE体系的优选碳源,葡萄糖利于体胚同步化,而麦芽糖效果较差,与山核桃(Caryacathayensis)基本一致[6]。蔗糖可通过改变培养基的渗透压,使细胞失水,内含物浓度升高,影响体细胞胚的数量及成熟[18],例如内源蔗糖的积累对荔枝(Litchichinensis)SE效率至关重要[19]。而在成熟胚的发育及生根过程中,低浓度的碳源可促进淀粉向蔗糖的转化,使体胚内渗透压升高,造成细胞吸水,致使代谢增强,另一方面,成熟胚发育过程中,较低的渗透压利于根系从培养基中吸收养分。
碳源在体胚发生中起着重要作用,不仅为细胞分裂、分化提供能量,参与信号转导,物质运输,还可调节细胞糖代谢,进而影响植物生长[15]。碳源种类和浓度在体胚的发生和成熟发育阶段代谢复杂[13,15]。赵舒野[20]发现蔗糖可以显著提高胡桃楸(Juglansmandshurica)体胚发生,挪威云杉(Piceaabies)体胚成熟过程中,总可溶性糖的含量降低,蔗糖相对含量升高,利于成熟胚发育[21],与本研究结果一致。也有研究表明麦芽糖由于分解较慢,可为体胚后期成熟阶段提供更稳定的能量供给,从而利于体胚发生[22]。淀粉的积累通常作为体胚发生中的重要事件,可在体胚发育过程中快速分解,为细胞旺盛分裂活动提供能量[11,22],例如荔枝(Litchichinensis)SE过程中,在淀粉酶、转化酶作用下,淀粉可转化为蔗糖,满足体胚发生物质能量需求[19]。本研究中2 %蔗糖处理的淀粉含量显著低于3 %、4 %蔗糖处理,内源蔗糖含量显著高于3 %蔗糖处理,而该处理成熟胚发育效果最佳,表明淀粉向蔗糖的转化可能为体胚发育提供了充足的能量,而内源蔗糖的积累对体胚发育更为关键[19]。
植物激素是自身合成与代谢的产物,调控细胞分化、生长方向与进程[23]。生长素、GA、CTK、ABA、乙烯等对体胚诱导具有重要作用,但因物种而异[24]。本研究中生长素、GA组分随蔗糖浓度呈梯度变化,且与成熟胚诱导效果关系密切,其作用可能相对重要。双子叶植物,例如宁夏枸杞(Lyciumbarbarum),体胚诱导时需要加入2,4-D[25],而百子莲等单子叶植物胚性诱导及维持则需加入PIC[9,16]。2,4-D和PIC均为外源激素类物质,通过调节细胞内源IAA的合成与信号调控体胚发生[23,26]。IAA可通过调节细胞极性诱导体胚形成,因此体胚诱导阶段通常需要较高浓度的IAA,内源IAA含量是调节体胚发生的主导因素[27-28]。本研究中,IAA在蔗糖处理下呈现梯度变化,浓度与成熟胚数量趋势相反,可能是因为体胚诱导阶段积累的IAA较多,而在体胚成熟发育阶段,高浓度IAA对成熟胚发育不利,因为高浓度的IAA会抑制顶端优势的形成,不利于成熟胚发育成植株。GA对体胚发生的效果因物种而异,多数研究表明高浓度GA对SE诱导不利[29-30],本研究中,具有生物活性的GA1、GA4与成熟胚数量相反,与紫花苜蓿(Medicagosativa)[31]、天竺葵(PelargoniumhortorumBailey)[29]结果一致。
离体培养产生的氧化胁迫可导致代谢紊乱,甚至细胞死亡[32]。植物通过增强抗氧化酶活性清除ROS[33]。不适的糖种类及浓度会对植物造成胁迫,而ROS和保护酶活性存在动态平衡。在ROS类别中,H2O2可影响基因表达,是非生物胁迫重要的信号分子之一[34-35]。中等强度的H2O2对棉花、牡丹(Paeoniasuffruticosa)离体培养有促进作用[24,36]。莳萝(Anethumgraveolens)在愈伤组织诱导体细胞胚阶段,H2O2含量持续上升,球形胚时期达到最高,而成熟胚时期含量下降[37]。在本研究中,H2O2含量随糖浓度的升高而增加,SOD活性加强,而最终成熟胚发育效果随糖浓度升高而降低,表明H2O2含量、SOD活性增强时胁迫相对严重,对成熟胚发育不利。
4 结 论
综上,糖种类及浓度显著影响百子莲体胚发生,蔗糖效果优于葡萄糖和麦芽糖,其中3 %蔗糖利于体胚诱导,2 %蔗糖利于成熟胚发育。培养基碳源对体胚成熟发育期糖代谢、激素代谢及氧化胁迫具有显著调节作用。淀粉与蔗糖之间的代谢平衡对百子莲成熟胚发育具有决定作用;高浓度的IAA、GAs对成熟胚发育不利;H2O2、SOD不利于成熟胚发育。

