杨梅枯萎病拮抗内生菌的分离及其抑菌机制研究
曹鹏飞,刘青娥
(1.丽水市农林科学研究院,浙江 丽水 323000; 2.丽水学院,浙江 丽水 323000)
杨梅是我国南方特色水果,种植面积和产量均占全世界的90%以上[1-2]。随着杨梅产业规模的不断扩大,杨梅病害也不断增多,其中枯萎病最为突出。杨梅枯萎病主要是由异色拟盘多毛孢菌(Pestalotiopsisversicolor)和小孢拟盘多毛孢菌(Pestalotiopsismicrospora)引起的发病率极高的毁灭性真菌病害[3],发病率为35%~100%,最高死亡率达80%[4],具有潜伏时间长、侵染范围广、死株严重、防治难度大等特点,被称为杨梅癌症[5]。目前,对枯萎病的防治以土壤清洁或喷洒化学杀菌剂为主,但效果不理想,且长期使用化学农药易引起抗药性、药物残留、环境污染等问题。因此,寻找低毒、高效的防治手段迫在眉睫。
微生物防治具有高效性、选择性强、不易产生抗药性、对人畜低毒等特点,是目前最具发展潜力的防治方法。但以往绝大多数的枯萎病拮抗菌株主要是从土壤或根际分离筛选得到,其与土传病原真菌的竞争作用易受外界环境因素影响,不易在土壤中定殖生存,很大程度降低了防病促生效果[6-7]。植物内生菌是指在植物生活史的一定阶段或全部阶段生活于健康植物各种组织和器官的细胞间隙或细胞内的微生物类群。相对其他生防菌,植物内生菌生存环境相对稳定,不易受温度、渗透压、紫外辐射等环境因素影响,能在体内长期定殖,从而有效地抑制病原菌生长,控制病害或提高植株抗病性,独特的优势使其成为一类极具开发和应用潜力的生防资源[8]。近些年来,已分离出了一些拮抗枯萎病的植物内生菌,如徐亚军等[9]从野艾蒿中分离筛选出7株对棉花枯萎病有明显抑制作用的内生菌株。易天凤等[10]从海南广藿香中分离获得了61株内生真菌,其中镰刀菌属(Fusarium)菌株 PfuJ20、PfuG16 和 PfuG5 对澳洲坚果叶枯病菌的抑制效果最好,棒孢属(Corynespora)菌株 PfuH2 对西瓜枯萎病菌抑菌效果较好。但对拮抗枯萎病病原菌的内生菌研究主要集中在分离筛选以及活性测定上,关于抑菌机制仅有零星报道。此外,现有分离的拮抗枯萎病内生菌菌株主要针对的是由尖孢镰刀菌引起的棉花[11]、香蕉[6,12]、黄瓜[13]、西瓜[7]等植物的枯萎病,而关于拮抗由拟盘多毛孢菌引起的杨梅枯萎病植物内生菌的分离报道更是罕见。鉴于此,以拟盘多毛孢菌为研究对象,从健康的杨梅植株、鱼腥草、金银花等植物中分离筛选出对杨梅枯萎病病原菌有拮抗作用的内生菌株,并对其抑菌机制进行研究,旨在为杨梅枯萎病的防治提供新的生防资源,为阐明内生菌对枯萎病拮抗机制提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 植物材料 新鲜健康的杨梅植株采自青田县;鱼腥草、凤尾草、金银花采自丽水白云山。
1.1.2 供试病原菌菌株 从发病的杨梅枯枝中分离获得拟盘多毛孢菌。
1.2 仪器及试剂
1.2.1 主要仪器 台式高速离心机(德国 SIGMA Laborzentrifugen Gmb H,3K15)、超微量紫外分光光度计(美国 Quawell 公司,Q5000)、超声波破碎仪(北京星越天成科技有限公司,Sonifier 250D/450D)等。
1.2.2 主要试剂 苹果酸脱氢酶(MDH)试剂盒、琥珀酸脱氢酶(SDH)试剂盒均购于南京建成生物工程研究所,麦角甾醇标准品购于北京世纪奥科生物科技有限公司,pBR322 DNA购于北京鼎国生物科技有限公司等。
1.2.3 培养基 牛肉膏蛋白胨、PDA、高氏一号等培养基[14],分别用于内生细菌、真菌和放线菌的分离培养。另外,PDA培养基也用于杨梅枯萎病病原真菌拟盘多毛孢菌的培养。
1.3 内生菌的分离
取健康杨梅、鱼腥草、凤尾草、金银花等植物的根茎叶,采用表面组织消毒法[15-16],将其接种于培养基上,于适宜温度培养2~7 d,观察菌落生长情况,挑取单菌落,经纯化后4 ℃保存。
1.4 杨梅枯萎病优势拮抗内生菌株的筛选
1.4.1 内生菌胞外代谢产物的制备 分离得到的内生菌株经活化后,用无菌水制成10 mL的菌悬液,接入相应的培养液,于适宜温度振荡培养2~5 d,离心取上清液浓缩至20 mL,经冷冻干燥后配成质量浓度为0.5 g/mL溶液,过滤除菌备用。
1.4.2 优势拮抗内生菌株的筛选 采用菌丝生长抑制率法[17]。将内生菌株的胞外代谢产物与冷却至50 ℃的PDA培养基混合后倒平板,使代谢产物的质量浓度为0.2 g/mL,以加无菌水的PDA培养基为空白对照。用打孔器(直径6.5 mm)打取病原菌拟盘多毛孢菌的菌丝块,菌面朝下,移至平板中央,置于28 ℃恒温培养箱中培养,观察菌落生长情况,每天用游标卡尺十字交叉法测量菌落直径,等空白对照菌落布满培养皿2/3以上时停止测量,同一处理重复3次。菌丝生长抑制率按公式计算,生长抑制率=(空白组菌落直径-处理组菌落直径)/空白组菌落直径×100%。根据菌丝生长抑制率大小筛选出杨梅枯萎病病原菌优势拮抗内生菌株。
1.4.3 优势菌株最低抑菌质量浓度(MIC)和EC50、EC90的确定 采用二倍稀释法[18]配制不同质量浓度含优势菌株胞外代谢产物的PDA培养基,以无菌水作空白对照,移植病原菌菌块于培养基,测定菌丝生长抑制率,以完全抑制病原菌生长的最低质量浓度作为MIC。采用剂量对数抑菌率-概率值法计算EC50、EC90及毒力回归方程[19]。
1.5 杨梅枯萎病优势拮抗内生菌株的鉴定
参照《真菌鉴定手册》[20],根据菌落的形态特征、菌丝及产孢结构确定其种属。
1.6 杨梅枯萎病优势拮抗内生菌株抑菌机制研究
1.6.1 优势拮抗内生菌株对病原菌菌丝形态的影响 用打孔器(直径6.5 mm)打取病原菌拟盘多毛孢菌菌丝块,接入10 mL PDA培养液,分别加入优势内生菌株的胞外代谢产物,使其质量浓度为EC50和EC90,以无菌水为对照,振荡培养48 h后,4 000 r/min 离心10 min,收集菌丝,抽干水分,采用乳酸石炭酸棉蓝染色法进行镜检,观察菌丝形态变化。
1.6.2 优势拮抗内生菌株对病原菌细胞壁的影响 按1.6.1中方法用优势拮抗内生菌株胞外代谢产物对病原菌分别处理0、12、24、36、48、60 h,取病原菌菌丝加0.05 mol/L Tris-HCl冰浴研磨,10 000 r/min、4 ℃离心,取上清液,参照刘芳等[21]的方法于波长544 nm下测定N-乙酰葡萄糖胺含量和几丁质酶活性。以每分钟产生1 μmol N-乙酰葡萄糖胺所需酶量表示几丁质酶活性。
1.6.3 优势拮抗内生菌株对病原菌细胞膜的影响 按1.6.1中方法用优势拮抗内生菌株胞外代谢产物对病原菌分别处理0、2、4、6、8、10 h,取培养液于4 000 r/min离心10 min,取上清,采用考马斯亮蓝G-250染色法[22]测定可溶性蛋白含量;根据苯酚-硫酸法[23]测定可溶性糖含量。收集处理72 h的菌丝,用石油醚提取,于282 nm波长下测吸光值,同时绘制标准曲线,根据吸光值计算麦角甾醇含量。
1.6.4 优势拮抗内生菌株对病原菌RNA含量的影响 按1.6.1中方法用优势拮抗内生菌株胞外代谢产物对病原菌分别处理12、24、36、48、60 h,取菌丝用Trizol法[24]提取RNA,用超微量紫外分光光度计测定其含量。
1.6.5 优势拮抗内生菌株对病原菌呼吸代谢的影响 按1.6.1中方法用优势拮抗内生菌株胞外代谢产物对病原菌分别处理24、48、72 h,5 000 r/min离心10 min,收集菌丝,加0.1 mol/L Tris-HCl冰浴研磨,参考徐明生等[25]的方法制备粗酶液,用试剂盒测苹果酸脱氢酶(MDH)及琥珀酸脱氢酶(SDH)的活性。
1.6.6 优势拮抗内生菌株对病原菌拓扑异构酶Ⅰ活性的影响 取培养72 h杨梅枯萎病病原菌菌丝用1×PBS磷酸缓冲液重复洗涤2次,4 000 r/min离心10 min,取菌丝,参照SULLIVAN等[26]的方法制备拓扑异构酶Ⅰ粗酶液。在2 μL稀释粗酶液中加入0.5 μg超螺旋pBR322质粒DNA、2 μL不同质量浓度的优势内生菌株胞外代谢产物,用双蒸水补至20 μL,37 ℃温浴30 min后于1%琼脂糖凝胶进行电泳。
1.7 数据分析
试验数据均采用DPS 16.05数据处理系统分析[27]。
2 结果与分析
2.1 杨梅枯萎病拮抗优势内生菌株的分离和筛选
从健康杨梅、凤尾草、鱼腥草和金银花中分离得到内生菌22株,包括内生细菌和真菌各7株,内生放线菌8株。对杨梅枯萎病病原菌有拮抗作用的共有14株,各菌株之间的生长抑制率差异极显著(F=34.918,P<0.01),结果如表1所示。其中,分别从凤尾草和健康杨梅植株分离的FWB1J、YMB1J菌株抑菌效果最好,生长抑制率分别约为83.61%、82.67%,将FWB1J和YMBIJ菌株作为杨梅枯萎病拮抗优势内生菌株。

表1 不同内生菌菌株对杨梅枯萎病病原菌的生长抑制率Tab.1 Growth inhibition rate of different endophytic strain against fusarium wilt pathogen of myrica %
2.2 FWB1J和YMBIJ菌株的鉴定
FWB1J菌落形态如图1所示,白色菌丝,致密,菌落形态为圆形,向四周扩展,产绿色孢子,中央变成绿色。分生孢子梗形态如图2所示,分生孢子梗略弯曲,尖端生分生孢子团,孢子无色,球形至卵形。YMB1J菌落形态如图3所示,菌落表面光滑、湿润、黏稠,边缘不规整、不透明,正反面和边缘的颜色均一,呈乳白色。菌体细胞形态如图4所示,子细胞不脱落分离,细胞成串排列,形成类菌丝状,无子囊孢子。根据《真菌鉴定手册》[20]初步鉴定FWB1J为木霉属(Trichoderma),YMB1J为假丝酵母属(Candida)。

图1 FWB1J菌株菌落形态Fig.1 Colony morphology of FWB1J strain
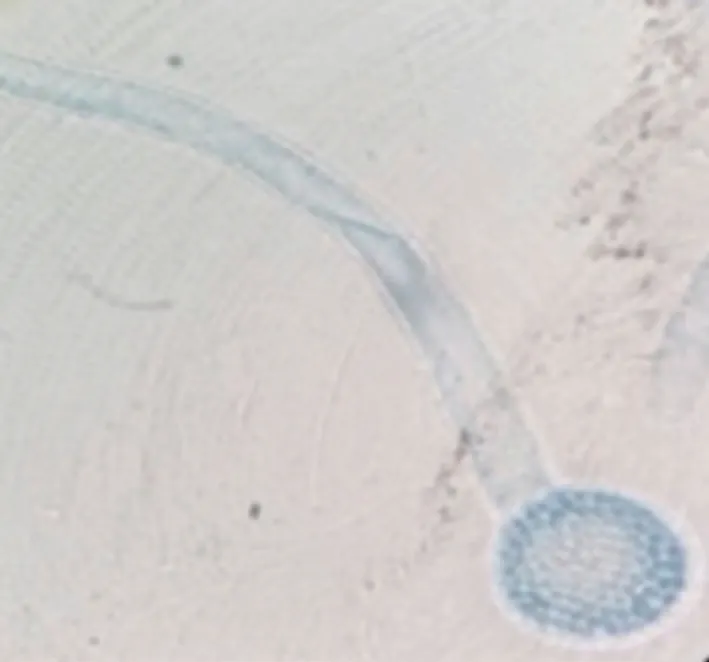
图2 FWB1J菌株菌丝形态Fig.2 Mycelial morphology of FWB1J strain

图3 YMB1J菌株菌落形态 Fig.3 Colony morphology of YMB1J strain

图4 YMB1J菌株菌体形态 Fig.4 Mycelial morphology of YMB1J strain
2.3 FWB1J和YMBIJ菌株对杨梅枯萎病病原菌MIC及EC50和EC90的确定
在0.100 0~0.400 0 g/mL质量浓度内,随着内生菌株胞外代谢产物质量浓度的增加,病原菌的生长抑制率增加。当FWB1J和YMB1J菌株胞外代谢产物质量浓度达0.400 0 g/mL时,病原菌在平板上不生长,因此确定0.400 0 g/mL为这2个菌株胞外代谢产物对杨梅枯萎病病原菌的 MIC。在0.012 5~0.200 0 g/mL质量浓度内,胞外代谢产物质量浓度越高,其对枯萎病病原菌的抑制作用越强,在质量浓度为0.200 0 g/mL时,两者的抑制率分别达89.16%、85.89%。通过剂量对数抑菌率-概率值法分析可得FWB1J和YMB1J菌株的毒力回归方程,分别为y=6.951 5+1.337 4x,R=0.986 6和y=7.088 4+1.357 9x,R=0.979 7。根据方程可知,其EC50分别为0.034 7、0.029 0 g/mL,EC90分别为0.315 5、0.254 6 g/mL。
2.4 FWB1J和YMBIJ菌株对杨梅枯萎病病原菌的抑菌机制
2.4.1 对杨梅枯萎病病原菌菌丝形态的影响 经FWB1J和YMB1J菌株胞外代谢产物处理48 h后的枯萎病病原菌菌丝形态如图5所示。对照组菌丝细长、光滑,经质量浓度为EC50的FWB1J菌株胞外代谢产物处理后的菌丝出现分支,在质量浓度为EC90时菌丝出现膨大,表面粗糙。经质量浓度为EC90的YMB1J菌株胞外代谢产物处理后,病原菌菌丝比EC50处理下膨大,且部分菌丝中出现大液泡,表面粗糙。说明2株优势拮抗菌株胞外代谢产物质量浓度越高,对枯萎病病原菌菌丝形态的影响越大。
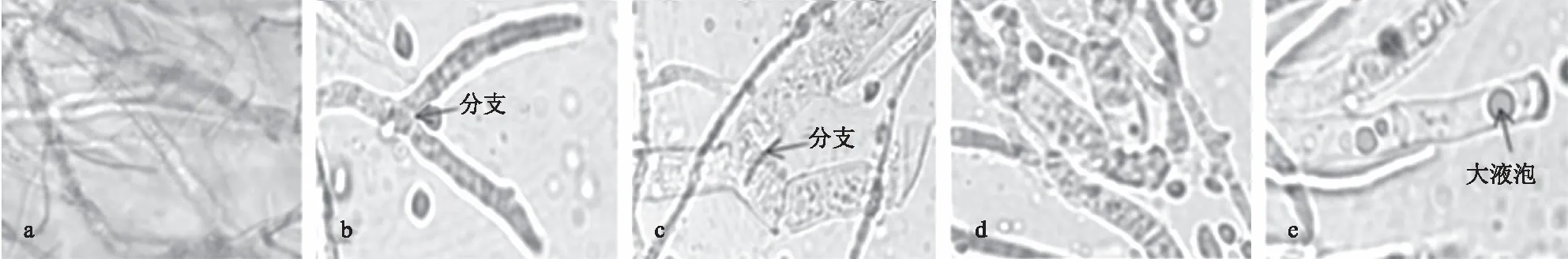
a—e:CK,FWB1J胞外代谢产物EC50、EC90,YMB1J胞外代谢产物EC50、EC90处理48 h后 a—e: CK,48 h after treated by the EC50 and EC90 of extracellular metabolites from FWB1J strain and YMB1J strain 图5 FWB1J和YMB1J菌株对杨梅枯萎病病原菌菌丝形态的影响Fig.5 Effect of FWB1J strain and YMB1J strain on the mycelium morphology of fusarium wilt pathogen of myrica
2.4.2 对杨梅枯萎病病原菌细胞壁的影响 从图6可知,整体上经FWB1J和YMB1J菌株胞外代谢产物处理后,病原菌N-乙酰葡萄糖胺含量极显著高于对照(F=3.2×105,P<0.01)。对照组在0~24 h内N-乙酰葡萄糖胺含量升高, 在24 h达到最大值,之后逐渐下降。而经FWB1J、YMB1J菌株处理后,在0~36 h内N-乙酰葡萄糖胺含量升高,在36 h时达最大值,YMB1J菌株质量浓度EC90处理组比对照组高176.700 μg/g,36 h之后含量逐渐降低。说明其胞外代谢产物质量浓度越高,病原菌的N-乙酰葡萄糖胺含量越高。如图7所示,随处理时间的延长,对照组几丁质酶活性维持在较低水平,经FWB1J和YMB1J菌株胞外代谢产物处理后,病原菌几丁质酶活性先增加后降低,并极显著高于对照(F=1.0×104,P<0.01)。在36 h时,2株优势拮抗内生菌胞外代谢产物处理组的几丁质酶活性达最大。可见,在处理36 h时,优势拮抗内生菌株处理组的N-乙酰葡萄糖胺含量和几丁质酶活性同时达到最大,表明此时几丁质酶水解几丁质并产生大量N-乙酰葡萄糖胺,使病原菌细胞壁完整性被破坏。

图中FW、YM分别代表FWB1J、YMB1J,下同FW and YM in the figure represent FWB1J and YMB1J respectively,the same below图6 FWB1J和YMB1J菌株对N-乙酰葡萄糖胺含量的影响Fig.6 Effect of FWB1J strain and YMB1J strain on N-acetylglucosamine content
2.4.3 对杨梅枯萎病病原菌细胞膜的影响 由图8可知,随处理时间延长,对照组可溶性糖渗漏量维持在较低水平,经FWB1J和YMB1J菌株胞外代谢产物处理后,病原菌可溶性糖渗漏量不断增加,并极显著高于对照(F=302 1,P<0.01)。在处理10 h时渗漏量达到最大,其中YMB1J菌株质量浓度EC90处理组的可溶性糖渗漏量高达9 300.000 μg/g。如图9所示,病原菌可溶性蛋白渗漏量趋势与可溶性糖相似,经FWB1J、YMB1J菌株胞外代谢产物处理后病原菌的可溶性蛋白渗漏量极显著高于对照(F=379.48,P<0.01)。随处理时间延长,可溶性蛋白渗漏量逐渐增加,在10 h时渗漏量达最大,其中FWB1J菌株质量浓度EC90处理组可溶性蛋白渗漏量较对照高14.350 μg/g。说明优势拮抗菌株胞外代谢产物质量浓度越高,病原菌细胞膜通透性越大,使内含物大量渗漏。
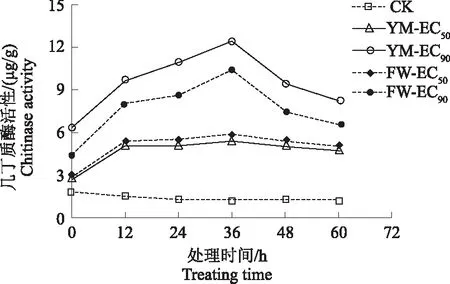
图7 FWB1J和YMB1J菌株对几丁质酶活性的影响Fig.7 Effect of FWB1J strain and YMB1J strain on chitinase activity
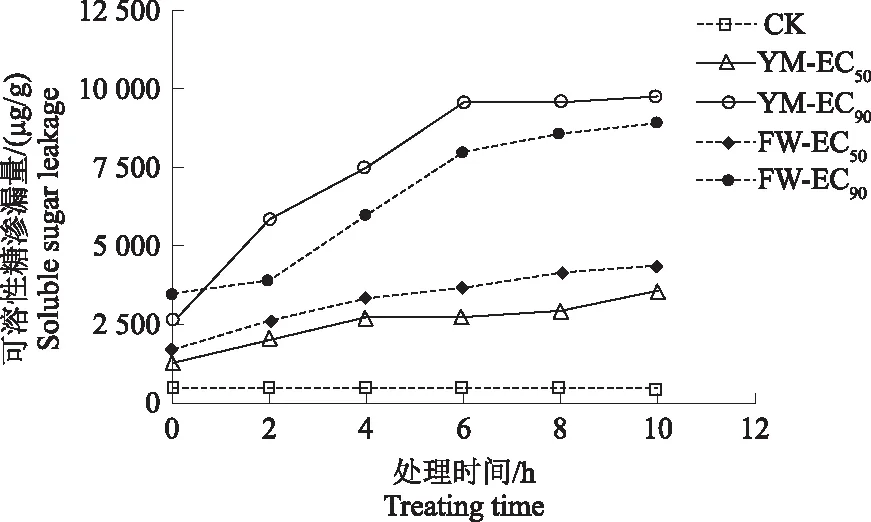
图8 FWB1J和YMB1J菌株对可溶性糖渗漏量的影响Fig.8 Effect of FWB1J strain and YMB1J strain on the soluble sugar leakage

图9 FWB1J和YMB1J菌株对可溶性蛋白渗漏量的影响Fig.9 Effect of FWB1J strain and YMB1J strain on the soluble protein leakage
如图10所示,经FWB1J和YMB1J菌株胞外代谢产物处理的病原菌麦角甾醇含量与对照组差异极显著(F=124.2,P<0.01)。对照组麦角甾醇含量最高,经2株优势菌株处理后,其含量明显降低。且随着胞外代谢产物质量浓度的升高,病原菌麦角甾醇含量逐渐降低,其中FWB1J菌株质量浓度EC90处理组含量最低,比对照组降低了82.460 μg/g。可见,优势菌株胞外代谢产物质量浓度越高,对麦角甾醇的合成抑制作用越强,细胞膜结构破坏越严重。
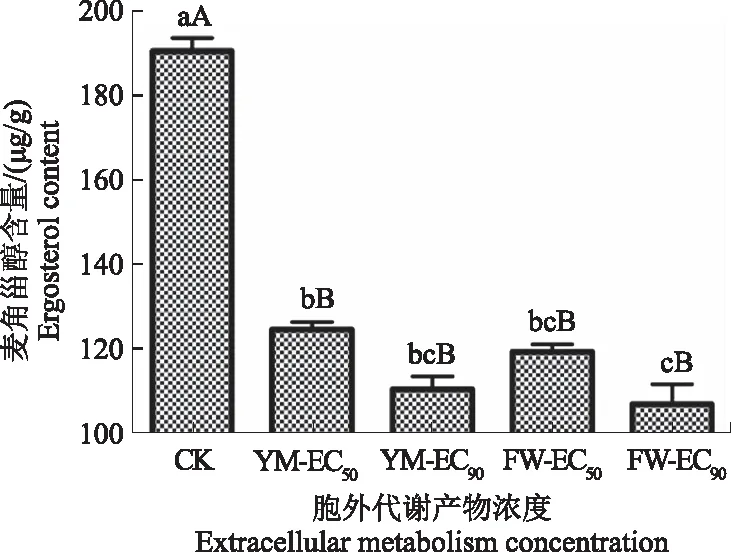
不同小写字母表示5%显著水平(P<0.05),不同大写字母表示1%极显著水平(P<0.01),下同Different lowercase letter represents 5% significant level(P<0.05), different uppercase letter represents 1% significant level(P<0.05),the same below图10 FWB1J和YMB1J菌株对麦角甾醇含量的影响Fig.10 Effect of FWB1J strain and YMB1J strain on the ergosterol content
2.4.4 对杨梅枯萎病病原菌菌体RNA含量的影响 从图11可知,当处理时间为12 h时,各处理组RNA含量差异不明显。自24 h开始,各处理组RNA含量逐渐增加,但经FWB1J、YMB1J菌株作用后,病原菌RNA含量极显著低于对照(F=1.1×105,P<0.01)。至60 h时,FWB1J菌株质量浓度EC90处理组的RNA含量较低,较对照组低16.450 μg/g。说明2株优势菌株胞外代谢产物质量浓度越高,对病原菌核酸的抑制作用越强。
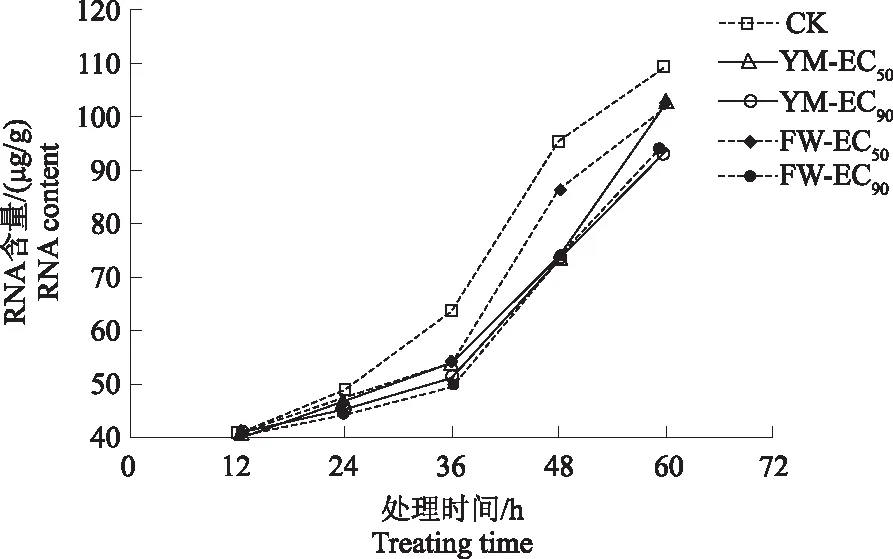
图11 FWB1J和YMB1J菌株对RNA含量的影响Fig.11 Effect of FWB1J strain and YMB1J strain on the RNA content
2.4.5 对杨梅枯萎病病原菌呼吸作用的影响 由图12、13可知,0~24 h,经FWB1J和YMB1J菌株胞外代谢产物处理后病原菌SDH活性与对照无明显差异,自48 h开始SDH活性极显著低于对照(F=46.3,P<0.01)。在0~48 h病原菌MDH活性与对照差异极显著(F=190.9,P<0.01)。至72 h时,2种酶活性下降最大,其中FWB1J菌株质量浓度EC90处理组SDH和MDH活性最低,比对照分别降低2.750、318.330 U/mg。FWB1J和YMB1J菌株质量浓度EC90处理组SDH和MDH活性均低于EC50组。这说明FWB1J和YMB1J菌株胞外代谢产物对病原菌呼吸有抑制作用,并且质量浓度越高,对呼吸酶的抑制作用越强,从而对能量代谢系统产生影响。SDH、MDH活性下降可能是因为优势菌株胞外代谢产物中的有效成分与酶结合,使酶分子结构发生改变。

图12 FWB1J和YMB1J菌株对SDH活性的影响Fig.12 Effect of FWB1J strain and YMB1J strain on SDH activity
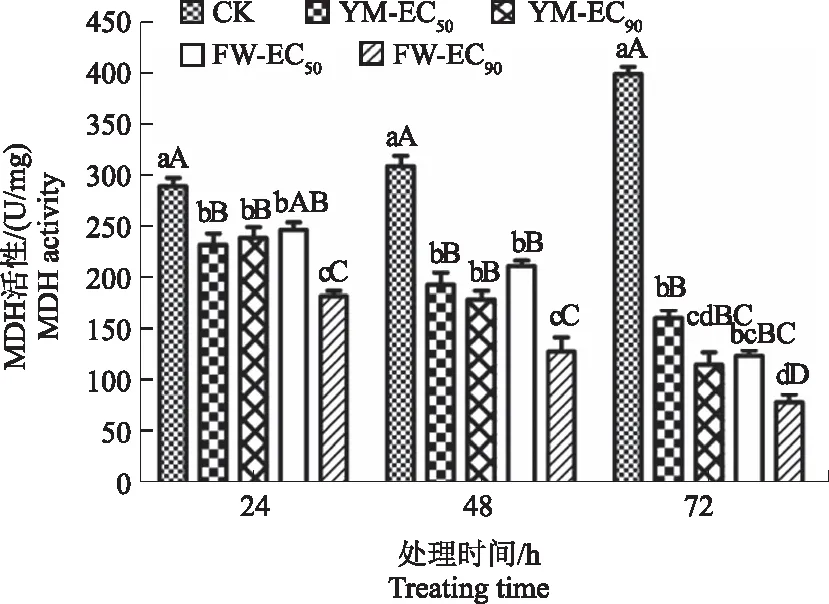
图13 FWB1J和YMB1J菌株对MDH活性的影响Fig.13 Effect of FWB1J strain and YMB1J strain on MDH activity
2.4.6 对杨梅枯萎病病原菌拓扑异构酶Ⅰ活性的影响 从图14可知,对照Form Ⅰ(超螺旋)逐渐减少,Form Ⅱ(开环或线性)逐渐增加。随着FWB1J和YMB1J菌株胞外代谢产物质量浓度的增加,Form Ⅱ(开环或线性)逐渐减少,Form Ⅰ(超螺旋)逐渐增加,其中经质量浓度为EC90的FWB1J菌株处理后,Form Ⅰ(超螺旋)最多。这说明2株优势菌株胞外代谢产物对拓扑异构酶活性有抑制作用,并且质量浓度越高,抑制拓扑异构酶Ⅰ对pBR322 DNA解旋的作用越强。
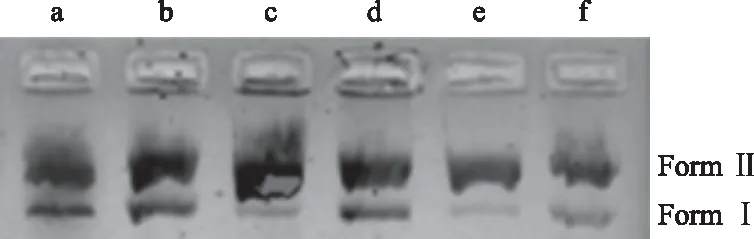
a:pBR322 DNA;b:FWB1J 菌株EC90组;c:FWB1J 菌株EC50组;d:YMB1J 菌株EC90组; e:YMB1J 菌株EC50组; f:对照组a:pBR322 DNA;b:FWB1J strain EC90 group; c:FWB1J strain EC50 group; d:YMB1J strain EC90 group; e:YMB1J strain EC50 group;f:Control group图14 FWB1J和YMB1J菌株对拓扑异构酶Ⅰ活性的影响Fig.14 Effect of FWB1J strain and YMB1J strain on topoisomerase Ⅰ
3 结论与讨论
植物内生菌多样性十分丰富,由于特殊的生存环境,在生长和代谢过程中植物内生菌可产生各种具有特殊化学结构类型和特殊生理功能的活性物质,使其在生物防治方面得到广泛关注。但近年来分离出的抗枯萎病的内生菌株较少,且对其拮抗机制的研究鲜有报道。因此,本研究从健康杨梅、凤尾草、鱼腥草、金银花植株中筛选拮抗杨梅枯萎病的内生菌,并对其抑菌机制进行探索。研究结果表明,从4种植物中共分离出内生菌22株,包括7株细菌,7株真菌,8株放线菌,其中从健康杨梅和凤尾草植株分离的内生真菌YMB1J、FWB1J菌株对杨梅枯萎病病原菌拟盘多毛孢菌拮抗作用最强,经鉴定FWB1J为木霉属(Trichoderma),YMB1J为假丝酵母属(Candida)。而近年来筛选出的抗枯萎病的优势内生菌大多属于芽孢杆菌属,且主要对由尖孢镰刀菌引起的枯萎病有效。如于蘋蘋等[28]筛选出的内生芽孢杆菌XJPL-YB-26菌株对由尖孢镰刀菌引起的西瓜枯萎病有较好的拮抗作用;郝晓娟等[29]发现番茄枯萎病拮抗菌JK-2菌株也属于芽孢杆菌属。经测定FWB1J和YMB1J菌株胞外代谢产物的EC50分别为0.034 7、0.029 0 g/mL,EC90分别为0.315 5、0.254 6 g/mL。而王一光等[30]发现,防治药剂80%代森锰锌WP对杨梅枯萎病的EC50为1.66 g/mL,说明菌株YMB1J、FWB1J胞外代谢产物对杨梅枯萎病病原菌的抑菌效果好于化学药物80%代森锰锌WP。
细胞壁是真菌的重要结构,与微生物形态的维持、代谢等生理特性密切相关。葡聚糖和几丁质是真菌细胞壁的最主要成分,是抗真菌药物作用的理想靶点[31-32]。几丁质酶是一种广泛存在于微生物中的糖苷酶,可催化水解细胞壁中的几丁质产生N-乙酰葡萄糖胺,从而破坏细胞壁的完整性[33]。本研究结果表明,经FWB1J、YMB1J菌株作用后,杨梅枯萎病病原菌的N-乙酰葡萄糖胺含量和几丁质酶活性均显著高于对照组,且随着时间的延长先升高后降低。张晓丽[34]的研究也证明,经紫茎泽兰挥发物Carvacrol处理后,稻瘟病菌和番茄灰霉病菌胞内N-乙酰葡萄糖胺含量和几丁质酶活性均显著升高。这表明,FWB1J、YMB1J菌株可激活杨梅枯萎病病原菌几丁质酶活性,从而水解几丁质,以此破坏细胞壁的完整性。
细胞膜是细胞的天然屏障,既可以稳定代谢的胞内环境,又能控制物质进出[35]。若细胞膜通透性增加,易使可溶性蛋白、可溶性糖等内含物渗漏[36]。此外,麦角甾醇是真菌细胞膜的重要成分之一,如果麦角甾醇合成受到抑制,膜的结构和功能会受到损害,甚至导致菌体死亡[37]。本研究结果表明,经FWB1J、YMB1J菌株处理后,杨梅枯萎病病原菌胞外可溶性蛋白、可溶性糖渗漏量明显升高,麦角甾醇含量逐渐下降。徐峥等[37]研究证实,抗真菌类药物可与麦角甾醇生物合成途径中各种酶作用,干扰或阻断麦角甾醇的生物合成。由此可知,FWB1J、YMB1J菌株可抑制麦角甾醇生物合成途径中相关酶活性,导致枯萎病病原菌细胞膜结构破坏,通透性增加,大分子外泄。
琥珀酸脱氢酶(SDH)和苹果酸脱氢酶(MDH)是细胞进行三羧酸循环中的关键酶,在能量代谢中起着重要作用,其活性变化可反映细胞的能量代谢状况[25]。本研究发现,FWB1J、YMB1J菌株对杨梅枯萎病病原菌胞内的SDH和MDH的活性具有极显著的抑制作用,其中经质量浓度为EC90的FWB1J菌株处理后病原菌的SDH和MDH活性最低,比对照分别降低了2.750、318.330 U/mg。这与徐明生[25]等研究鱼精蛋白对黑曲霉细胞内的SDH和MDH活性的影响结果相同。其作用机制可能是胞外代谢产物中有效成分与这2个酶侧链的氨基酸结合,改变其构象,使酶活性降低,从而抑制病原菌的呼吸代谢。
菌体内的生物大分子如蛋白质、DNA和RNA是衡量菌体生长状况的重要指标,菌体内RNA含量发生改变,可能影响其正常生长,造成代谢紊乱[36]。本研究结果表明,内生菌FWB1J和YMB1J菌株的胞外代谢产物可通过抑制RNA的合成影响杨梅枯萎病病原菌的正常生长。核酸是遗传信息的携带者,其含量变化会严重影响菌体的各种生理机能,而拓扑异构酶能参与DNA的断裂、修复、重组、复制和转录,其活性直接与菌体核酸的合成密切相关。本研究结果显示,内生菌FWB1J和YMB1J菌株可通过抑制拓扑异构酶的功能而阻碍病原菌DNA合成。汪业菊等[38]也研究发现,秦皮中的秦皮素可以抑制DNA拓扑异构酶Ⅰ的活性。
综上所述,分别从凤尾草、杨梅健康植株中筛选出的木霉属FWB1J、假丝酵母属YMB1J菌株对杨梅枯萎病病原菌有较强的抑制作用,其抑菌机制主要是通过破坏细胞壁及细胞膜的完整性,抑制三羧酸循环中的SDH和MDH活性,抑制DNA拓扑异构酶Ⅰ的活性,进而影响菌体核酸合成等途径来实现。因此,木霉属FWB1J、假丝酵母属YMB1J菌株有望用于由拟盘多毛孢菌引起的杨梅枯萎病防治,但其发酵条件的优化以及田间施用条件还有待进一步的研究。

