夏季仿刺参养殖池塘水体菌群地域性特征及其影响因素
杨小佩,王 荦,徐翰晨,丁 君,常亚青,郝振林
( 大连海洋大学,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023 )
仿刺参(Apostichopusjaponicus)由于具有丰富的营养和药用价值,深受消费者青睐,是我国北方主要的海水养殖品种之一[1]。近年来,我国仿刺参养殖产业迅猛发展,池塘养殖已然成为仿刺参增养殖的重要模式[2-3]。养殖池塘生态系统是一种复杂的水域生态系统,微生物群落的结构和功能在养殖环境中扮演着重要的角色,对维持水域生态系统稳定、水质调控、疾病防控等方面均具有重要的作用[4-6]。因此,保持水产养殖生态系统微生态平衡,对于防治养殖环境恶化及促进养殖生物健康生长尤为关键[7-8]。
水产养殖池塘微生物群落具有系统特异性,而当前关于养殖池塘生态系统微生物群落地域差异性相关方面的研究工作仍然相对匮乏。已有的研究表明,内部因子和外部因子是主导养殖池塘生态系统微生物群落结构和功能的两大因素[9-10]。内部因子主要是指食物网中各物种之间的相互作用;外部因子主要是指养殖环境的理化因子,如营养盐、温度、盐度等[11]。其中,外部理化因子是影响水域生态系统菌群结构的重要因素,季节的变动、营养物质的输入等变化均可造成养殖环境菌群种类和丰度的改变,进而影响养殖生物的生长及健康[12-13]。
为解析仿刺参养殖池塘水体微生态系统的稳定性,笔者以中国北方典型岸基半开放仿刺参养殖池塘为研究对象,利用高通量测序技术,揭示不同地区仿刺参养殖池塘水体菌群地域性差异和共性,并初步探讨水体菌群与其生境环境因子间的相互关系,进一步查明影响水体菌群结构的主导环境因子,以期为仿刺参养殖池塘的精准化管理和绿色健康养殖提供参考。
1 材料与方法
1.1 样品采集
选取长海、营口、乐亭和乳山作为北方典型岸基半开放仿刺参养殖池塘(图1),池塘水深2~3 m,水域面积约0.1 km2,底质均为泥质,水源来自于近海海域,利用潮汐带来的潮差进水和排水。选取的仿刺参养殖池塘仅养殖仿刺参单一品种,全年不投喂饲料及益生菌,保证仿刺参自然生长。
每个仿刺参养殖池塘均设置4个采样点,利用有机玻璃采水器,于2018年8月采集上层(离水面30 cm处)和下层(离池底30 cm处)水样各5 L,混匀。一部分水样经0.45 μm滤膜抽滤,用于水质指标检测;另一部分经0.22 μm醋酸纤维素滤膜抽滤后放置于无菌离心管中液氮保存,用于细菌总DNA的提取。不同地区仿刺参养殖池塘水体各项水质指标和细菌群落高通量测序样品,均设置3个平行。

图1 采样点示意Fig.1 Sampling locations
1.2 环境因子测定
采用HACH(HQd)水质分析仪器(美国HACH公司),现场测定温度、盐度、溶解氧、氧化还原电位(ORP)和pH。其他理化水质参数测定方法按照GB 17378—2007《海洋监测规范》进行。
1.3 DNA提取
选用OMEGA Soil DNA试剂盒提取仿刺参养殖池塘水体样品总DNA,为确保DNA无降解、无污染,DNA样品质量浓度要求≥50 ng/μL,纯度要求260 nm吸光度/280 nm吸光度(D260/D280)=1.8~2.0。利用1%琼脂糖凝胶电泳检测DNA,条带清晰完整无拖尾,质量合格。
1.4 PCR扩增与测序
细菌16S rRNA基因V3~V4片段的扩增引物为341F(5′-CCTACGGGNGGCWGCAG-3′)和806R(5′-GGACTACHVGGGTATCTAAT-3′),应用Illumina MiSeq测序平台完成序列测序。
1.5 数据分析
测序数据进行预处理生成优质序列后,在97%相似水平下,采用Vsearch软件进行运算分类单元(OTU)聚类得到运算分类单元。使用QIIME软件包挑选出各运算分类单元的代表序列,并将所有代表序列与SILVA数据库比对进行物种注释,保留置信区间大于0.7的注释结果。使用R软件进行细菌多样性及聚类分析。基于Bray-Crutis算法构建样品菌群结构图。选用SPSS 19.0软件中单因素方差分析进行多样本显著性差异分析(α=0.05)。
2 结 果
2.1 高通量测序结果
4个地区仿刺参养殖池塘12个水体样品共测得原始序列558 090条,过滤掉低质量和短长度序列,去除嵌合体序列后,共获得有效序列444 373条,聚类于14 544个运算分类单元。长海、营口、乐亭和乳山地区水体样品中运算分类单元数目分别为1045±78、1351±453、1239±400和1213±132。组间平均测序覆盖率均为97.83%~98.45%,能够真实反映样本菌群组成情况。
2.2 菌群α多样性分析
不同地区仿刺参养殖池塘水体菌群α多样性指数表明,营口和乳山地区仿刺参养殖池塘水体菌群丰富度(以ACE指数和Chao1指数衡量)显著(P<0.05)高于乐亭和长海,长海仿刺参养殖池塘水体菌群丰富度最低;营口地区仿刺参养殖池塘水体菌群多样性(以Shannon指数和Simpson指数衡量)显著高于其他3个地区(P<0.05)(表1)。

表1 水体菌群α多样性指数Tab.1 Alpha diversity index of bacterial community in the water of sea cucumber culture ponds
2.3 优势菌群结构特征分析
不同地区仿刺参养殖池塘水体菌群结构特征见图2。根据物种注释结果,4个地区仿刺参养殖池塘水体的细菌群落共有33门、50纲、75目、159科、532属。在门水平上,不同地区仿刺参养殖池塘水体优势菌群主要隶属于变形菌门和拟杆菌门,二者相对丰度占比68.64%~89.34%。其中,变形菌门作为水体第一优势菌门,相对丰度占比51.10%~71.98%。不同地区水体次优势菌门存在显著性差异,长海、乳山和乐亭次优势菌门均为拟杆菌门,相对丰度占比分别为26.46%、23.01%和17.35%;营口次优势菌门为放线菌门,相对丰度为18.54%。长海、乳山和乐亭第三优势菌门均为放线菌门,相对丰度占比分别为11.15%、8.98%和8.04%,营口的第三优势菌门为拟杆菌门,相对丰度为17.57%。
在属水平上,玫瑰变色菌属(Roseovarius)、Kiloniella、远洋杆菌属(CandidatusPelagibacter)、棕囊藻杆菌属(Phaeocystidibacter)为不同地区仿刺参养殖池塘水体的优势菌属,其次为假单胞菌属(Pseudomonas)、假交替单胞菌属(Pseudoalteromonas)和Pseudohongiella。其中,长海、乳山和乐亭地区仿刺参养殖池塘水体第一优势菌群均隶属于玫瑰变色菌属,相对丰度占比分别为18.68%、
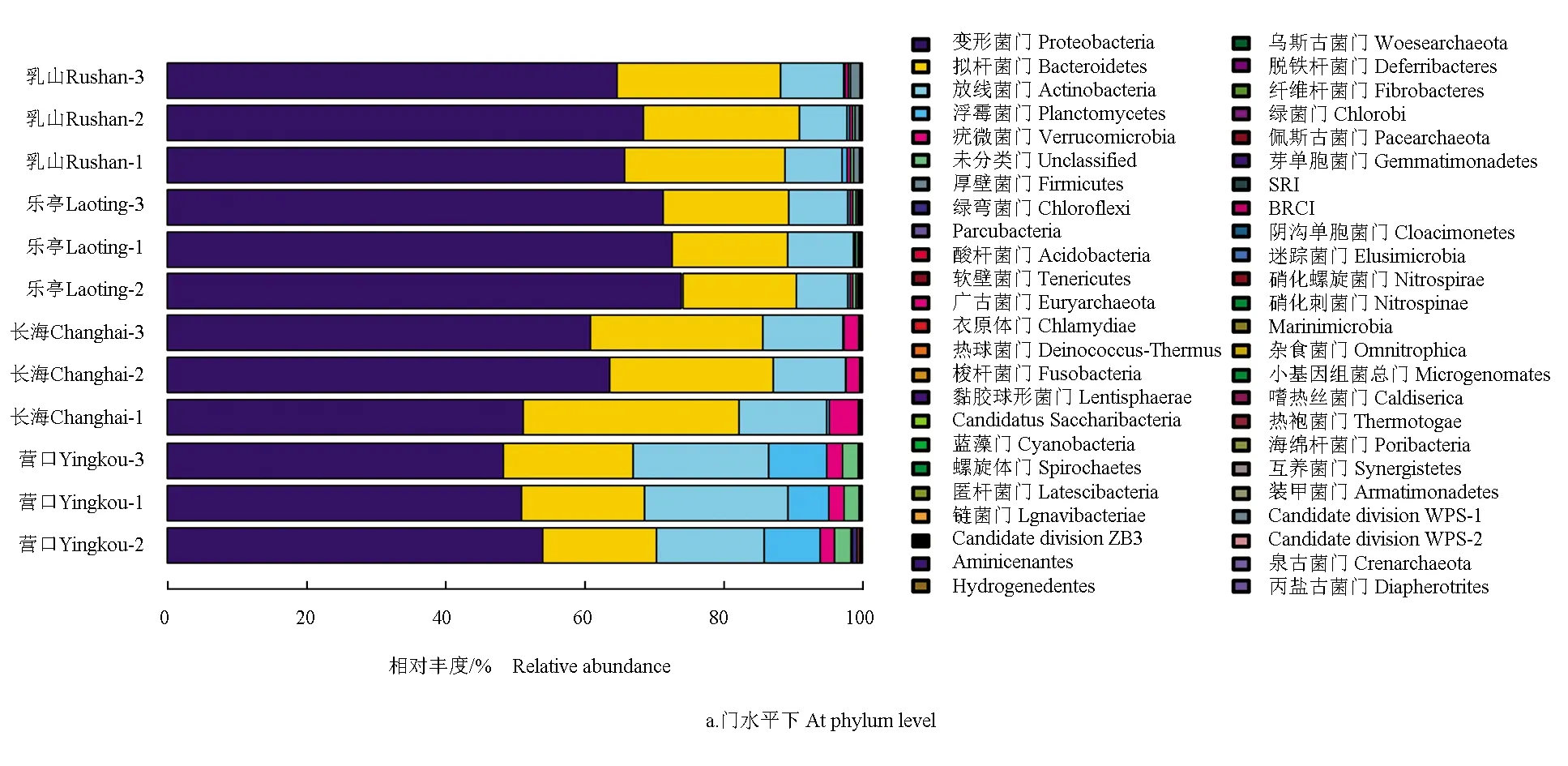
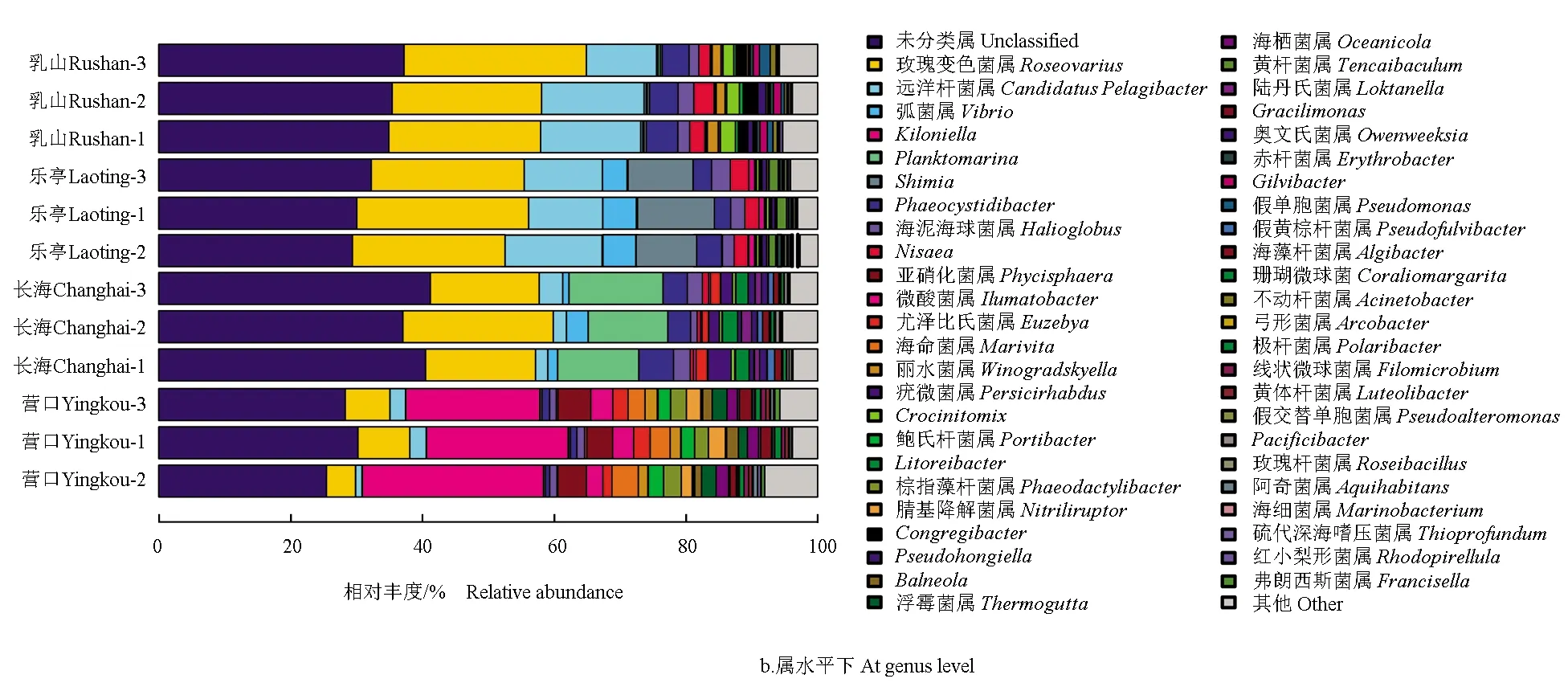
图2 不同地区仿刺参养殖池塘水体菌群结构特征Fig.2 Characteristics of bacterial community in the water of sea cucumber culture ponds in different areas
24.46%和24.65%。然而,营口地区仿刺参养殖池塘水体第一优势菌群则隶属于Kiloniella,相对丰度占比为23.07%。乐亭和乳山地区仿刺参养殖池塘水体次优势菌群均隶属于远洋杆菌属,相对丰度占比分别为11.57%和13.80%;长海和营口地区仿刺参养殖池塘水体次优势菌属分别为Planktomarina和玫瑰变色菌属,相对丰度占比分别为12.88%和6.36%。
2.4 差异菌群结构特征分析
利用Weighted Unifrac距离矩阵,对不同地区仿刺参养殖池塘水体菌群结构相似性进行聚类分析(图3)。其中,乐亭与乳山水体菌群结构相似度最高首先聚为一类,其次与长海聚为一类,营口地区则单独聚为一类。研究表明,夏季不同地区仿刺参养殖池塘水体菌群结构具有地域性差异,营口水体菌群结构显著有别于其他3个地区。

图3 不同地区仿刺参养殖池塘水体菌群聚类分析Fig.3 Cluster analysis of bacterial community in the water of sea cucumber culture ponds in different areas
为进一步探究营口地区仿刺参养殖池塘水体菌群结构的地域性差异,在空间维度上对不同地区仿刺参养殖池塘水体菌群进行线性判别LEfSe分析,以查明不同地区所对应的显著性特异菌群(P<0.05)。基于LDA判别值大于3.5的判定标准,共有不同分类水平的68个细菌类群在4个地区之间存在显著性差异(图4)。长海、乐亭和乳山3个地区显著性优势菌群相对集中于变形菌门和拟杆菌门。营口地区仿刺参养殖池塘水体差异菌群则主要隶属于放线菌门和浮霉菌门。其中,放线菌门以酸微菌(Ilumatobacter)、尤泽比氏菌(Euzebya)和腈基降解菌(Nitriliruptor)为代表。浮霉菌门以浮霉菌科为代表。


图4 不同地区仿刺参养殖池塘水体菌群LEfSe分析Fig.4 LEfSe analysis of bacterial community in the water of sea cucumber culture ponds in different areas
2.5 环境因子监测
根据GB 3097—1997《中华人民共和国海水水质标准》,所监测的长海、营口、乐亭和乳山4个地区仿刺参养殖池塘夏季水体环境因子各项水质指标,均达国家海水二类水质标准。不同地区仿刺参养殖池塘水体pH 7.96~8.23,呈弱碱性;水温23.88~26.23 ℃;盐度27.30~28.60;溶解氧为7.19~8.22 mg/L。同时,水体理化指标呈现出显著地域性差异。其中,营口地区仿刺参养殖池塘水体总磷、化学需氧量和有机碳含量显著高于其他地区。
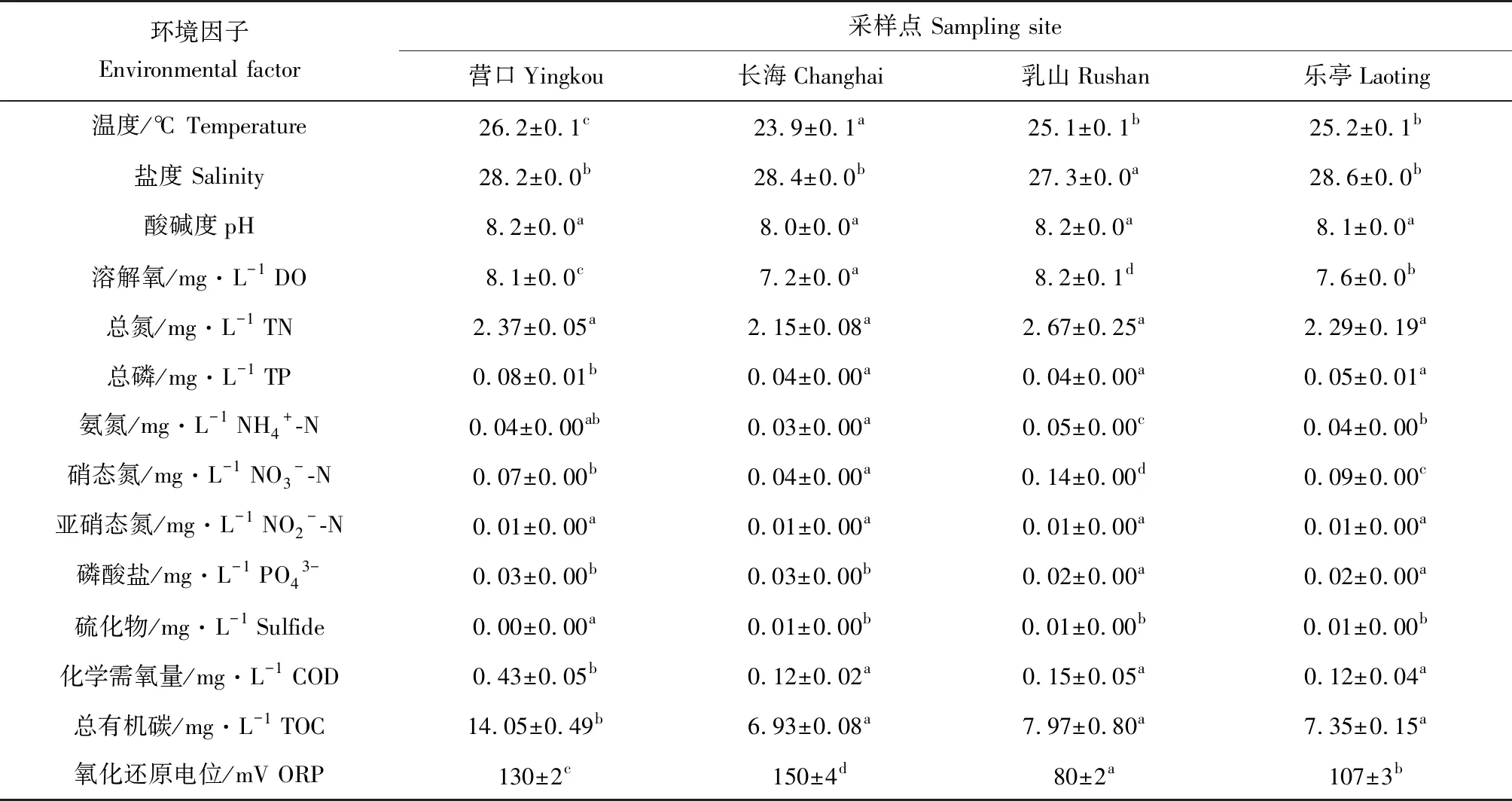
表2 水体环境因子监测Tab.2 Environmental factors in water samples
2.6 细菌群落影响因素
冗余分析(RDA)常用于解析细菌群落与其生境环境因子间的相互关系。门水平下,不同地区仿刺参养殖池塘水体菌群相对丰度与环境因子冗余分析结果见图5。蒙特卡罗排序检验显示,总有机碳、化学需氧量、磷酸盐、总磷、温度与水体菌群间存在显著的相关性(P<0.05),影响水体菌群的主导环境因子为总有机碳和化学需氧量,其次为磷酸盐、总磷和温度。其中,总有机碳、化学需氧量和磷酸盐与营口仿刺参养殖池塘水体菌群相对丰度呈现出正相关性,与长海、乐亭和乳山水体菌群相对丰度呈现出负相关。氨氮和硝态氮与长海、乐亭和乳山水体菌群之间的影响作用呈正相关,与营口呈负相关。

图5 菌群与环境因子RDA分析Fig.5 RDA analysis between bacterial communities and environmental factors
水体优势菌群与主导环境因子间的相关性分析结果见表3。根据相关性系数的大小,确定各种菌群与环境因子的相关性水平。本试验中,水体放线菌门与总磷含量呈极显著正相关(P<0.01),表明放线菌门受水中总磷影响较为显著。浮霉菌门和Kiloniella与有机物含量呈极显著正相关(P<0.01),相关系数高于0.910,表明浮霉菌门和Kiloniella受有机物含量影响极显著。玫瑰变色菌属(Roseovarius)与总有机碳含量和化学需氧量呈极显著负相关(P<0.01),相关系数分别为-0.818、-0.801,表明玫瑰变色菌属与总有机碳含量和化学需氧量具有极强的相关性。此外,变形菌门和拟杆菌门与主导环境因子间无显著相关性。
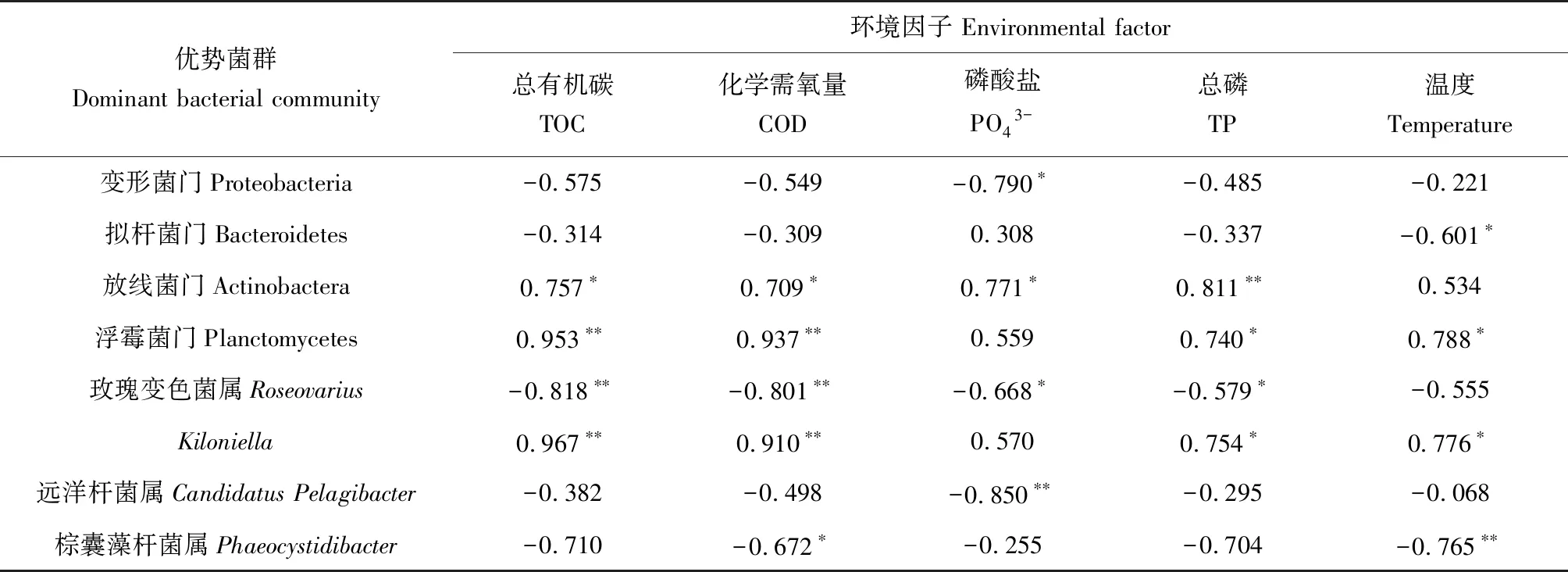
表3 水体优势菌群与主导环境因子相关性分析Tab.3 Correlation analysis between dominant bacterial communities and environmental factors in water
3 讨 论
3.1 不同地区仿刺参养殖池塘水体菌群多样性
微生物是池塘养殖生态系统的重要组成部分,其数量众多且种类丰富,在物质循环和转化过程中发挥着重要作用,对于维持养殖池塘生态系统微生态平衡及促进养殖生物健康生长具有重要的作用[14]。水体菌群物种丰度和多样性受环境因子的共同调控[15-17]。其中,温度是影响菌群多样性和丰富度的重要因素[18-19]。已有研究表明,高温通过加速细菌体内酶活性,控制其增殖代谢速率,使微生物迅速繁殖,多样性增加[20]。此外,有机物含量与菌群多样性具有显著的相关性[21],水体添加有机物质后,菌群多样性明显增加[22]。同时,有机物质的分解过程也加速了营养盐的流动,为细菌生长创造适宜的条件,使菌群结构更加稳定[23]。营口地区仿刺参养殖池塘水体菌群多样性显著高于其他3个地区(P<0.05),这主要是因为夏季营口地区仿刺参养殖池塘水体温度和有机质含量相对较高,为微生物的繁殖栖息提供有利的条件,因此导致该地区水体菌群多样性高于其他地区。
3.2 不同地区仿刺参养殖池塘水体菌群特征
本试验中,不同地区仿刺参养殖池塘水体夏季优势菌群均隶属于变形菌门和拟杆菌门,二者相对丰度占比超过68.64%,与已报道的仿刺参养殖池塘水体优势菌群相似[24-26]。其中,变形菌门作为第一优势菌门(相对丰度占比高达51.10%以上),主要是因为其在原核生物分子生物学分类或表型分类中占据了绝对的优势[27]。而拟杆菌门作为次优势菌门,是海洋浮游细菌的重要组成部分,其门下的黄杆菌纲和鞘脂杆菌纲与水中蛋白质代谢、氨基酸代谢及脂肪代谢等生物学过程有关,仿刺参养殖过程中产生的残饵及粪便等有机质的分解,造成拟杆菌门含量增多,使其成为仿刺参养殖池塘水体次优势菌门[28]。在属水平上,不同地区仿刺参养殖池塘水体夏季优势菌属主要为玫瑰变色菌属、远洋杆菌属、Kiloniella和棕囊藻杆菌属。
种群遗传学和群落生态学研究者发现,由于随机分布或环境选择,不同地区环境中均包含有一些独特的细菌种群,环境微生物的分布存在显著地域性差异[29]。本试验结果显示,不同地区仿刺参养殖池塘水体菌群结构存在显著地域性差异(P<0.05)。其中,长海、乐亭和乳山仿刺参养殖池塘水体菌群相对丰度聚为一类,营口仿刺参养殖池塘水体菌群聚为一类。LEfSe分析表明,营口地区仿刺参养殖池塘水体差异菌门主要为放线菌门和浮霉菌门。微生物群落组成对环境差异有着较强的敏感性,菌群结构与其环境因素密切相关,不同形态营养元素含量、水体理化指标等因子的改变均会导致水体细菌群落结构及功能发生变化[30-34]。放线菌门与磷含量密切相关,水体中总磷含量的增加会促进放线菌的生长繁殖[35-36]。浮霉菌门主要为氨氧化细菌、厌氧氨氧化细菌和异养细菌,部分浮霉菌门微生物不仅能耐受高质量浓度有机碳,其代谢过程也高度依赖环境中有机物含量,相对丰度随总有机碳质量浓度和化学需氧量升高而增加[37-43]。营口地区仿刺参养殖池塘水体差异菌门特征与其水中较高的磷和有机质含量呈现出一致性。
属水平上,营口地区仿刺参养殖池塘水体菌群丰富度代表性菌属为Kiloniella,其相对丰度与有机物(总有机碳和化学需氧量)呈极显著正相关(P<0.01)。Kiloniella包含多种酶,如色氨酸脱氨酶、碱性磷酸酶、亮氨酸芳酰胺酶及胰蛋白酶等[29],可以水解DNA,同时具有利用有机物中碳源的特性[44-45]。营口地区仿刺参养殖池塘水体中丰富的总有机碳和较高的化学需氧量,为Kiloniella的生长提供了有利条件,是其成为营口地区水体第一优势菌属的主要原因。此外,Kiloniella具有生物修复潜力,利用硝态氮或亚硝态氮作为末端电子受体进行反硝化作用,可以有效去除水中亚硝态氮污染物含量[46]。Kiloniella作为仿刺参养殖池塘水体中的优势菌属,可以在一定程度上为仿刺参健康生长提供优良的生态环境。此外,长海、乐亭和乳山地区仿刺参养殖池塘水体第一优势菌属为玫瑰变色菌属,其相对丰度与有机物含量呈极显著负相关(P<0.01)。玫瑰变色菌属作为有氧产氧的光合细菌,在暗光、少碳限制条件下,其竞争能力超过化学趋化菌,成为最具代谢活性的细菌[47-49]。水体中有机物(总有机碳和化学需氧量)含量越低,玫瑰变色菌属新陈代谢活性越强、竞争能力越大,相对丰度占比越高[50-51]。长海、乐亭和乳山地区水体中有机质含量较低,为玫瑰变色菌属细菌的繁殖提供了有利的条件。由此可见,不同地区仿刺参养殖池塘差异菌群相对丰度特征与其主导环境因子地域性差异相吻合。
3.3 不同地区仿刺参养殖池塘水体差异菌群及其影响因素
微生物菌群特征是其生境环境因子的反映,与环境理化性质密切相关且相互限制影响[52]。蒙特卡罗排序检验和冗余分析结果显示,不同地区仿刺参养殖池塘水体菌群与其生境环境因子之间存在显著性相关,影响水体菌群的主导环境因子为总有机碳和化学需氧量,其次为磷酸盐、总磷和温度,且所有主导环境因子均呈现出显著地域性差异。值得重视的是,主导环境因子总有机碳和化学需氧量均是反映水体环境有机物含量的评价指标。有机物不仅能为微生物提供碳源和能量,还能提供其生长繁殖所需的氮、磷、硫、铁等营养元素,水中有机质含量能够直接影响细菌的生物量和组成,进而对细菌群落结构的塑造起重要作用,是影响菌群结构变化的重要因素[53-54]。如拟杆菌门的某些细菌能够利用N-乙酰基-D-葡萄糖胺、浮游植物产生的高分子质量的溶解态有机碳[55];交替单胞菌目细菌能够利用N-乙酰基-D-葡萄糖胺,降解芳香族化合物,进行甲基营养代谢[56];玫瑰杆菌(Roseobacter)类群可以利用二甲基巯丙酸内盐、有机酸及浮游植物来源的碳水化合物[57]。另外,磷和温度也可以通过促进或抑制菌群生长繁殖而对仿刺参养殖池塘水体菌群产生一定的影响[58]。
4 结 论
本试验结果表明,不同地区仿刺参养殖池塘水体菌群呈现出显著的地域性差异,化学需氧量和总有机碳是影响水体菌群结构的主导环境因子。因本试验仅局限于夏季特定时间点,未能揭示仿刺参池塘养殖水体环境微生物群落的季节演替特征。后续需进一步针对不同季节不同地域开展大尺度的仿刺参养殖池塘生态系统微生物群落动态变化,以期为仿刺参养殖池塘管理提供精准的科学指导。

