指状青霉草酰乙酸水解酶的结构特征与原核表达分析
胡紫微,李至敏,张梦洁,徐依婷,李志敏**
(1. 江西农业大学 生物科学与工程学院,江西 南昌330045;2. 江西农业大学 理学院,江西 南昌330045)
指状青霉(Penicilliumdigitatum)导致柑橘果实采后腐烂形成的绿霉病是柑橘类果实在储存运输期间发生的最严重病害之一[1]。目前一般多用化学杀菌剂抑制指状青霉的生长来防治绿霉病,比如咪鲜胺(扑霉灵)、抑霉唑、噻苯唑、邻苯基苯酚钠等物质[2,3]。然而化学杀菌剂在柑橘果实的残留对人体的潜在风险,病原菌对化学杀菌剂的耐药性以及化学杀菌剂引发的食品安全、环境污染等问题,使得人们开始采用生物防治方法来控制柑橘果实采后病害[4]。生物防治策略主要包括微生物保鲜剂、植物源提取物、天然化合物、食品添加剂、公认安全的化合物等方面及其联合使用的策略[5]。然而这些策略方法并没有取得较好的防治绿霉病效果。
随着2012年指状青霉全基因组序列的公布[6],从分子水平解释指状青霉致病机理的研究越来越多。多个研究表明,在指状青霉致病过程中,果胶裂合酶基因(Pnl1)[7]、pH信号转录因子基因(PdpacC)[8]、分裂素激活蛋白激酶基因(PdMpkB)[9]等都发挥了关键作用。此外,人们发现真菌的致病性与其生长过程中草酸的分泌相关[10-11]。包括食品生物技术真菌黑曲霉(Aspergillusniger)、植物病原真菌灰霉菌(Botrytiscinerea)与核盘菌(Sclerotiniasclerotiorum)、人类条件致病菌烟曲霉(Aspergillusfumigatus)和许多褐腐担子菌、白腐担子菌在内的丝状真菌可以产生大量草酸[12]。毒力机制研究认为酸化触发了木质纤维素的降解,降低了寄主组织的活力,有利于病原体的增殖,同时草酸的合成可以诱导草酸钙结晶的形成,从而阻塞血管或导管[10,13]。真菌产生草酸主要有3种潜在途径:乙醛酸的氧化、羟基乙醛的氧化和草酰乙酸的水解[14]。
草酰乙酸水解酶(Oxaloacetate hydrolase,OAH,EC 3.7.1.1)催化草酰乙酸水解形成乙酸和草酸,是草酰乙酸水解生成草酸的关键酶(图1)[15-16]。体内研究发现将编码OAH的基因敲除失活后,灰霉菌合成草酸的能力基本丧失[14]。转录组研究发现指状青霉在侵染柑橘果实的过程中Oah基因转录水平大幅提高[7],由此可见指状青霉草酰乙酸水解酶(PdOAH)可能是该菌侵染柑橘果实的关键因子。由于PdOAH是指状青霉中一个可能的致病因子,针对PdOAH的抑制剂研究将会为指状青霉的防治提供新思路。PdOAH的结构特征信息有助于抑制剂的理性设计,原核表达纯化的重组蛋白将为PdOAH的生化特征和催化机理研究提供重要的基础材料。
本实验首先对PdOAH的生物信息学进行了详细研究,探索了其催化中心的关键氨基酸残基。然后人工合成了编码PdOAH的基因并将其构建到pET-21a载体,在大肠杆菌表达系统中进行了重组PdOAH的诱导表达和分离纯化,研究了温度和异丙基硫代半乳糖苷(IPTG)浓度对其诱导表达的影响。

图1 OAH催化草酰乙酸水解形成草酸和乙酸
1 材料与方法
1.1 材料与试剂
大肠杆菌BL21(DE3)感受态细胞由本实验室保藏。pET21a-OAH重组质粒由上海祥音生物科技有限公司合成。PageRuler预染蛋白Ladder购自ThermoFisher Scientific公司。0.22 μm过滤器购于Millipore公司。镍-次氮基三乙酸(Ni-NTA)琼脂糖凝胶树脂购于QIAGEN公司。胰蛋白胨、酵母提取物购于OXOID公司。质粒测序由上海祥音生物科技有限公司完成。其它主要试剂均为分析纯,购自北京索莱宝科技有限公司。
1.2 指状青霉草酰乙酸水解酶(PdOAH)的生物信息学分析
利用ExPAsy-ProtParam (https://web.expasy.org/protparam/)进行等电点、蛋白分子量、稳定性等预测。在NCBI中找到指状青霉来源的草酰乙酸水解酶基因序列,同时进行BLAST序列分析。利用在线软件ESPript 3.0 (http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)分析蛋白氨基酸结构。利用SWISS-MODEL (https://swissmodel.expasy.org/interactive)进行蛋白结构预测。利用 PyMOL软件对蛋白的三维空间结构进行模拟展示。
1.3 温度对重组PdOAH表达的影响
挑取pET21a-OAHBL21(DE3)单克隆菌落,将其接种于10 mL LB液体培养基(含100 μg/mL的Amp)中,于37 ℃、180 r/min振荡培养箱中过夜培养。次日,按1%接种量转接于100 mL新鲜的LB液体培养基(含100 μg/mL的Amp)中,于37 ℃、180 r/min下培养一定时间。当OD600 nm值为0.6左右时,于冰水浴中冷却30 min,加入诱导剂IPTG(终浓度为0.2 mmol/L),分别置于16、25、30、37 ℃,180 r/min条件下诱导表达24 h。在第3天,将菌液以4000 r/min离心15 min,然后收集菌体。用体积质量比为20∶1的20 mmol/L Tris-HCl(pH 7.5)缓冲液重悬菌体,并进行超声破碎(超声条件:变幅杆10 mm,工作时间2 s,间隔时间8 s,功率10%,工作总时间2 min);将细胞破碎液于4 ℃、12000 r/min离心30 min,得到上清和沉淀;加入4×蛋白上样缓冲液,混合均匀后在100 ℃下加热处理5 min;最后用12.5% (v/v)的SDS-PAGE检测目的蛋白的表达情况。加样体积均为10 μL。
1.4 IPTG浓度对PdOAH表达的影响
挑取pET21a-OAHBL21(DE3)单克隆菌落,将其接种于10 mL LB液体培养基(含100 μg/mL的Amp)中,于37 ℃、180 r/min振荡培养箱中过夜培养。次日,按1%接种量转接于100 mL新鲜的LB液体培养基(含100 μg/mL的Amp)中,于37 ℃、180 r/min条件下培养一定时间。当OD600 nm值约为0.6时,于冰水浴中冷却30 min,然后分别加入不同浓度(0、0.01、0.05、0.20和1.00 mmol/L)的IPTG,并置于16 ℃、180 r/min条件下诱导表达24 h。在第3天,将菌液以4000 r/min离心15 min,收集菌体。用20倍体积的20 mmol/L Tris-HCl(pH 7.5)缓冲液重悬菌体,并进行超声破碎(超声条件:变幅杆10 mm,工作时间2 s,间隔时间8 s,功率10%,工作总时间2 min);将细胞破碎液于4 ℃下以12000 r/min离心30 min,得到上清和沉淀;加入4×蛋白上样缓冲液,混合均匀后于100 ℃加热处理5 min;最后用12.5% (v/v)的SDS-PAGE检测目的蛋白的表达情况。加样体积均为10 μL。
1.5 重组PdOAH的诱导表达
挑取pET21a-OAHBL21(DE3)单克隆菌落,将其接种于10 mL LB液体培养基(含100 μg/mL的Amp)中,于37 ℃、180 r/min振荡培养箱中过夜培养。次日,按1%接种量转接于400 mL新鲜的LB液体培养基(含100 μg/mL的Amp)中扩大培养。当OD600 nm值为0.6左右时,于冰水浴中冷却30 min;然后加入IPTG(终浓度为0.2 mmol/L),置于16 ℃、180 r/min条件下诱导表达24 h。第3天,将菌液以4000 r/min的转速离心15 min,收集菌体,以备后续分离纯化使用。
1.6 重组PdOAH的分离纯化
将诱导表达得到的pET21a-OAHBL21(DE3)菌体用20倍体积(g/mL)的binding buffer(20 mmol/L Tris-HCl,pH 8.0缓冲液)重悬,用超声波细胞粉碎机将菌液进行超声破碎,将细胞破碎液置于4 ℃、12000 r/min冷冻高速离心机中离心1 h,将获得的上清液经0.22 μm滤膜过滤,然后上样于10 mL Ni-NTA树脂[事先用20 mmol/L Tris-HCl (pH 8.0)缓冲液平衡];随后用20~200 mmol/L咪唑洗脱缓冲液(含20~200 mmol/L咪唑、300 mmol/L NaCl、20 mmol/L Tris-HCl,pH 8.0)进行浓度梯度洗脱,分别收集不同咪唑浓度下的蛋白洗脱液。加入4×蛋白上样缓冲液,混合均匀后在100 ℃下处理5 min,获得样品,最后用12.5% (v/v)的SDS-聚丙烯酰胺凝胶电泳检测蛋白挂柱情况,分析杂蛋白和目的蛋白的分离情况,确定最佳的洗脱咪唑浓度。
2 结果与分析
2.1 PdOAH的生物信息学分析
生物信息学分析发现PdOAH基因的核苷酸大小为1005 bp,可编码334个氨基酸。PdOAH蛋白的理论分子量大小是36.53521 kDa,等电点(pI)为6.01,亲水性和不稳定性指数分别为-0.074和26.06,表明PdOAH为亲水性蛋白且是稳定的。氨基酸序列分析发现,PdOAH属于异柠檬酸裂解酶/磷酸烯醇丙酮酸变位酶超家族成员(ICL/PEPM superfamily),具有Mg2+/Mn2+结合位点(图2)。PdOAH与来源于其它3种真菌的OAH氨基酸序列比对结果如图3所示。氨基酸序列比对结果表明PdOAH与黑曲霉、灰霉菌及板栗疫病菌(Cryphonectriaparasitica)来源的OAH氨基酸序列同源性分别为83.59%、73.66%及72.66%。PdOAH蛋白的二级结构预测如图4B所示。该蛋白含有11个α-螺旋、6个β-折叠以及多个无规则卷曲,其中α-螺旋占比高达44.6%,含有149个氨基酸;β-折叠占比较低,为11.07%,含有37个氨基酸。
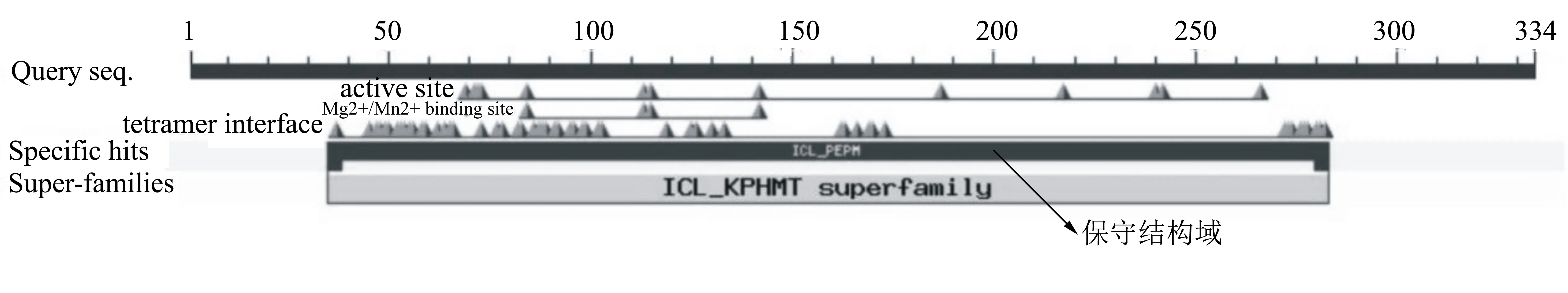
图2 PdOAH氨基酸序列的结构分析结果
2.2 PdOAH的建模结构分析
Chen等[17]于2010年解析出板栗疫病菌OAH的晶体结构(PDB ID:3m0k)。氨基酸序列分析发现PdOAH与板栗疫病菌OAH的氨基酸序列同源性高达72.66%(图3),因此选择板栗疫病菌OAH蛋白作为模板(PDB ID:3m0k),应用SWISS-MODEL在线工具对PdOAH进行同源建模,建模结果如图4所示。PdOAH蛋白的整体结构类似于ICL/PEPM超家族的其它成员[18],均由二聚体结合二聚体形成了同源四聚体(图4A)。PdOAH蛋白与ICL/PEPM超家族其它成员一样,催化活性中心位于结构的中心。催化中心的氨基酸残基大部分都位于α-螺旋和β-折叠的末端,这与前期预测的二级结构结果是一致的。PdOAH蛋白催化中心的结构示意图如图5所示。在催化中心中可能与产物草酸有氢键作用的氨基酸残基有Tyr69、Ala73、Thr71、Gly72、Asp113、Arg187、Asn240和Ser266(图5)。

QBN20786.1、BAM16481.1、AAS99938.1和ADF28676.1分别代表来源于指状青霉、黑曲霉、灰霉病、板栗疫病菌的OAH。三角形所示为参与酶催化的氨基酸残基。

A:PdOAH蛋白四聚体结构;B:PdOAH蛋白单体结构。关键氨基酸残基(绿色为碳原子,深蓝色为氮原子)和产物草酸(碳原子为淡蓝色,氧原子为红色)为棍棒结构,金属离子(Mn2+)为紫色球形。α-螺旋、β-折叠及无规则卷曲分别为红色、黄色和绿色。黑色虚线为催化中心的氢键。
2.3 温度对重组PdOAH原核表达的影响
固定诱导剂IPTG的终浓度为0.2 mmol/L,将pET21a-OAHBL21(DE3)表达菌株分别置于16、25、30、37 ℃,180 r/min条件下诱导表达24 h后,重组PdOAH蛋白的诱导表达情况如图6所示。泳道1、4、7、10分别对应上述4个温度诱导表达后的细胞破碎液(图6),由此可知PdOAH蛋白在大肠杆菌BL21(DE3)中表达量很高,但随着温度的升高表达量逐渐减少,由此表明pET21a-OAHBL21(DE3)菌株在上述4个温度下都能大量表达目的蛋白,而在16 ℃下诱导表达的目的蛋白含量最高。泳道2、5、8、11对应上述温度下表达细胞破碎离心后的上清液,在16 ℃条件下上清液中PdOAH含量最多(图6)。由此可见温度对重组PdOAH蛋白的诱导表达具有明显的影响。因此,后续将用16 ℃、180 r/min条件对pET21a-OAHBL21(DE3)菌株进行诱导表达。

OXL指草酸(碳原子为淡蓝色);关键氨基酸残基(碳原子为绿色)旁的数字为其在PdOAH蛋白质氨基酸序列中的位置。黑色虚线为催化中心的氢键。

M:蛋白质标准;泳道1~3号分别为16 ℃诱导表达的全菌、上清、沉淀;泳道4~6号分别为25 ℃诱导表达的全菌、上清、沉淀;泳道7~9号分别为30 ℃诱导表达的全菌、上清、沉淀;泳道10~12号分别为37 ℃诱导表达的全菌、上清、沉淀。
2.4 诱导剂IPTG浓度对重组PdOAH原核表达的影响
固定温度为16 ℃,将pET21a-OAHBL21(DE3)表达菌株分别加入终浓度为0、0.01、0.05、0.20和1.00 mmol/L的IPTG后诱导表达24 h,重组PdOAH蛋白的诱导表达情况如图7所示。泳道1、3、5、7、9分别对应上述5个IPTG浓度诱导表达后的细胞破碎液,由图7可知PdOAH蛋白在未加入IPTG诱导剂时基本不表达,0.01、0.05、0.20、1.00 mmol/L的IPTG对PdOAH蛋白的诱导表达量相当。泳道2、4、6、8、10对应上述5个IPTG浓度下表达细胞破碎离心后的上清液,结果表明IPTG浓度对其可溶性表达几乎没有影响(图7)。因此,后续将用0.20 mmol/L IPTG对pET21a-OAHBL21(DE3)菌株进行诱导表达。
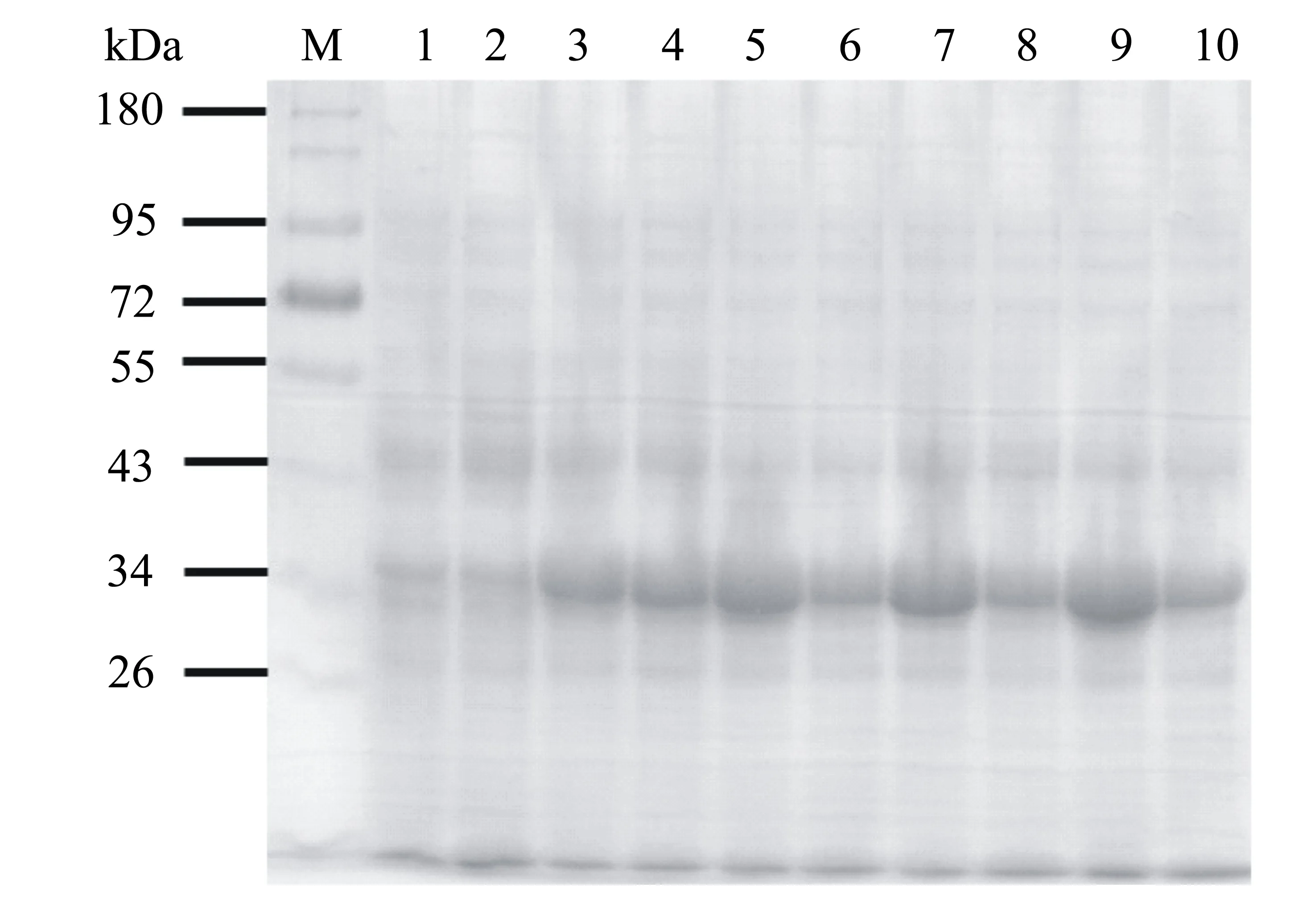
M:蛋白质标准;泳道1~2号分别为0 mmol/L IPTG诱导的全菌和上清;泳道3~4号分别为0.01 mmol/L IPTG诱导的全菌和上清;泳道5~6号分别为0.05 mmol/L IPTG诱导的全菌和上清;泳道7~8号分别为0.20 mmol/L IPTG诱导的全菌和上清;泳道9~10号分别为1.00 mmol/L IPTG诱导的全菌和上清。
2.5 重组PdOAH蛋白的分离纯化
利用Ni-NTA琼脂糖凝胶亲和层析技术分离纯化重组PdOAH蛋白。与表达的其它杂蛋白相比,目的PdOAH蛋白含有多聚组氨酸(6×His)标签,从而与Ni2+结合更紧密,因此杂蛋白和目的蛋白在不同浓度的咪唑洗脱液中可以分别被洗脱出来(图8)。流穿液(FT)中含有大量的杂蛋白,表明杂蛋白因不含6×His标签而不与Ni2+结合。然而,泳道FT同样显示约50%的目的PdOAH蛋白未与Ni2+紧密结合。可能的原因是重组PdOAH蛋白由于部分溶解、折叠不正确或与其它分子结合而引起表面结构的变化[19],导致6×His标签未完全暴露,造成PdOAH蛋白与Ni2+的亲和力降低,使得部分PdOAH蛋白未能挂柱。在200 mmol/L咪唑浓度下成功洗脱出大量目的PdOAH蛋白。收集纯度较高(图8中泳道7~11)的蛋白进行浓缩脱盐处理,以备后续酶活力测定使用。
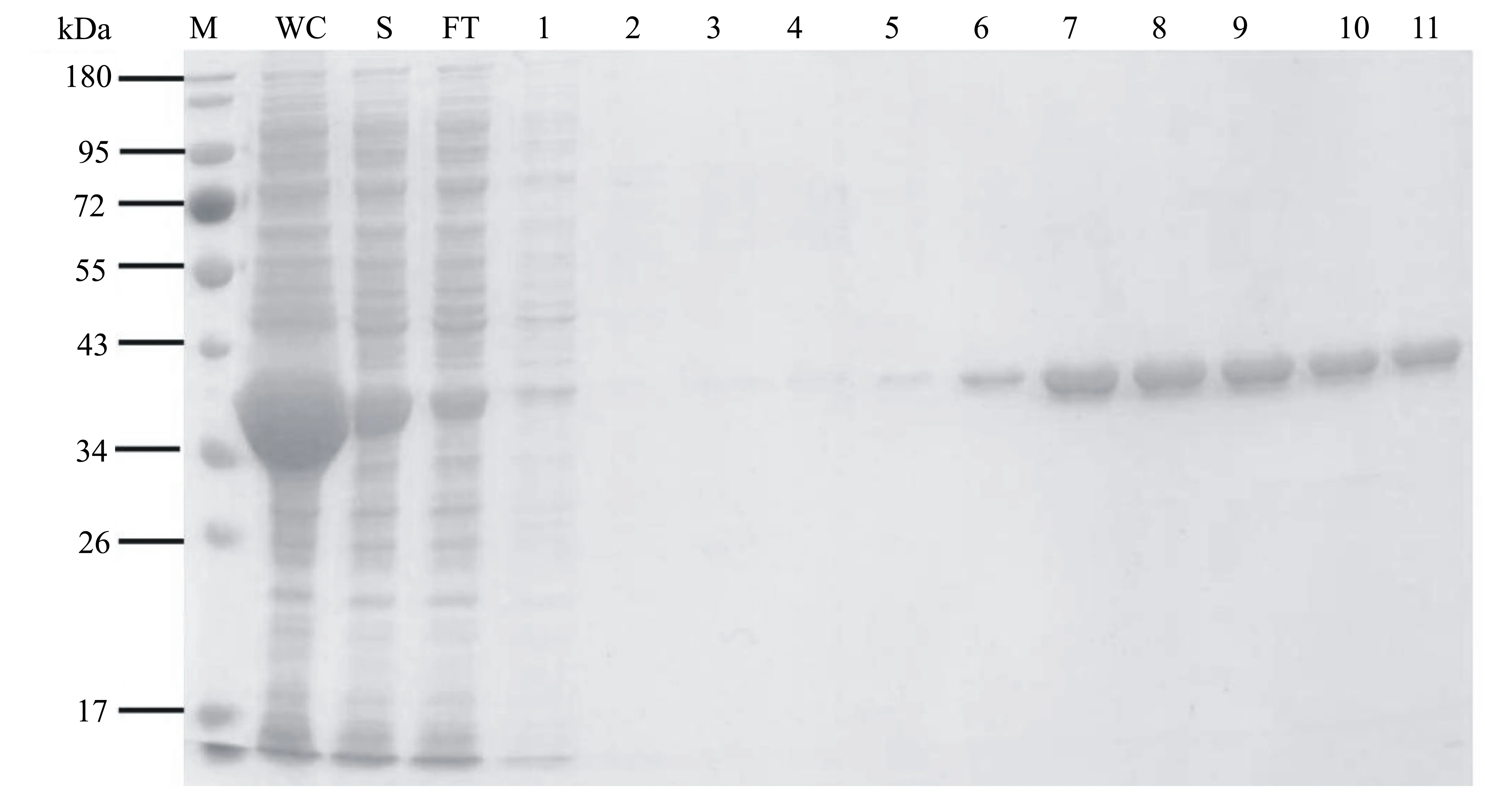
M:蛋白质标准;WC:全菌;S:上清液;FT:流穿液;1~4号分别为20、40、60、80 mmol/L咪唑洗脱液;5~11号均为200 mmol/L咪唑洗脱液。
3 讨论与结论
病原菌利用体内生物合成的草酸侵染和破坏植物组织,因此草酸的生物合成可能是病原菌致病的关键因素。真菌生物合成草酸的一个重要途径是OAH催化草酰乙酸水解。在对核盘菌草酸生物合成途径的研究中,人们发现当OAH基因缺失时,核盘菌体内和菌核中草酸的积累会消除,而将OAH基因重新导入缺失株后,草酸的积累又恢复到野生型的水平[20]。在对黑曲霉[14]、板栗疫病菌[18]、产黄青霉菌[21]的研究中,也存在类似的现象,从而进一步证明真菌中草酰乙酸的水解是形成草酸的一条重要途径,对草酸的生物合成具有重要贡献。因此,为了研究指状青霉中草酸的合成途径,后续需要对OAH基因进行敲除,从而确定指状青霉中草酸生成的基本途径,这对柑橘果实绿霉病的防治有重大意义。
生物信息学分析发现PdOAH蛋白属于异柠檬酸裂解酶/磷酸烯醇丙酮酸变位酶超家族。该家族蛋白催化含有C-C键或者P-C键底物的裂解,因而该家族又分为“C-C键裂解酶”和“P-C键裂解/形成酶”两大分支[17]。C-C键裂解酶分支主要成员有异柠檬酸裂合酶、2-甲基异柠檬酸裂合酶、草酰乙酸水解酶和花瓣死亡蛋白酶等,催化各种羟基酸底物C-C键的裂解,形成α-羟基羧酸[22-24]。P-C键裂解酶分支成员包括磷酸烯醇丙酮酸突变酶、磷酸基丙酮酸水解酶和羧基PEP突变酶等,催化α-酮羧酸底物中的磷酸键裂解形成烯酸中间体[25-27]。PdOAH蛋白属于C-C键裂解酶分支。氨基酸序列比对结果显示PdOAH蛋白与其它来源的OAH蛋白具有高度的同源性,并且催化活性中心的大部分氨基酸残基高度保守,这为后续研究PdOAH的催化机理奠定了基础。生物信息学预测的PdOAH蛋白的二级结构与同源建模获得的二级结构具有较高的一致性,说明该预测结构和建模结构质量较高。
本研究探索了不同温度和IPTG浓度对重组PdOAH原核表达量及可溶性的影响,确定了诱导表达的最适温度和最适IPTG浓度。在16 ℃条件下,重组PdOAH蛋白的表达量最高;当IPTG浓度大于0.2 mmol/L时,重组PdOAH蛋白可溶性最佳。Ni-NTA亲和层析纯化结果表明,在200 mmol/L咪唑洗脱液下可以获得纯度较高的重组PdOAH蛋白。本研究结果为今后进一步探索PdOAH蛋白的酶动力学参数和催化机理,以及开发草酰乙酸水解酶抑制剂奠定了基础,也将为柑橘果实绿霉病的防治提供科学依据。

