干细胞治疗终末期肝病的临床研究进展
余滢滢,王福生,施 明
1 干细胞治疗肝病概述
近年来,关于干细胞尤其是成体干细胞,在治疗肝脏疾病的基础研究和临床研究方面都取得了重要进展,为进一步推进临床应用奠定了基础。目前研究较多且相对成熟的是间充质干细胞(mesenchymal stem cells,MSCs)。MSCs存在于多种组织及器官,例如脐带组织、脐带血、胎盘、外周血、脂肪组织、骨髓等,其中骨髓中含量最为丰富。MSCs由于其多能性和多向性等特征,可以作为种子细胞应用于修复或替代受损及病变的多种组织器官,从而为目前一些无法有效治愈的重大疾病提供崭新的治疗手段,对再生医学产生重要的影响。此外,MSCs也可以释放各种生长因子和细胞因子,参与调节炎症和免疫反应,这使其免疫调节功能越来越受到关注。因此,MSCs已成为治疗炎症性或自身免疫性疾病的重要细胞来源。除了MSCs以外,应用经粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF)动员或未经动员的骨髓CD34+干细胞也是治疗肝病常用的干细胞种类。
2 干细胞治疗肝病的证据和机制
1999年Petersen等[1]在鼠肝内发现由骨髓干细胞(bone marrow stem cells,BMSCs)或骨髓造血干细胞转化形成的肝卵圆细胞甚至成熟的肝细胞和胆管细胞,首次描述了干细胞在一定条件下可以转化为肝细胞这一现象。Theise等[2]在异性间骨髓移植或肝移植的受体中也发现了来源于供体的肝细胞和胆管细胞。Alison等[3]在开展的一项临床试验中发现移植了男性骨髓细胞的女性患者肝脏内同样出现了Y染色体阳性的肝细胞。Korbling等[4]通过肝脏组织标本活检在移植了男性外周血干细胞的女性患者肝脏内也发现了来自男性供体的XY染色体阳性的肝细胞。上述研究结果都证明骨髓和外周血干细胞在人体内可以分化为肝细胞,但在当时这些干细胞的起源及其产生肝细胞方式都尚未知晓。而之后的动物实验也表明骨髓细胞或骨髓来源的MSCs(bone marrow derived MSCs,BM-MSCs)对急性肝损伤的动物肝脏有保护作用,能提高动物的生存率[5]。于是人们逐渐认识到,基于干细胞的多向分化和多能性,干细胞在肝病治疗方面存在巨大潜力,并逐步开展了大量的小规模临床研究。
以往认为,干细胞治疗是通过提供大量肝细胞样细胞替代受损的肝细胞功能来改善肝功能和恢复肝脏正常结构。但随着对干细胞治疗肝病机制的进一步了解,目前认为干细胞通过旁分泌机制改变组织微环境比向肝细胞样细胞的转分化更重要[6]。例如,MSCs可以通过旁分泌功能发挥局部效应,为肝脏提供营养和有利于增生修复的环境,促进受损肝脏增生及肝脏血管再生,抑制免疫细胞增殖及向肝脏迁移,调节肝脏及全身免疫炎症反应,从而减轻肝脏的损伤[7]。MSCs可以通过分泌IL-10、转化生长因子β(transforming growth factor β,TGF-β)、前列腺素 E2 等诱导调节性T细胞(regulatory T cell,Treg)的产生,抑制过度的炎症反应,减轻肝脏炎症,改善肝脏微环境,抑制肝细胞凋亡,促进肝细胞再生;通过分泌IL-10和TNF-α抑制肝星状细胞的活性,或通过Fas/FasL途径促进星状细胞的凋亡,从而抑制肝纤维化的形成[8-9]。例如有临床研究表明,应用自体BM-MSCs治疗HBV相关终末期肝病,患者肝功能明显改善的同时,外周血中Treg、Th17细胞以及细胞因子TGF-β、IL-17、TNF-α、IL-6水平发生明显改变,这一结果提示了MSCs具有调节免疫改善肝脏炎症环境的能力[10]。此外,MSCs也可以通过释放促细胞增生因子和基质金属蛋白酶-9刺激内源性肝细胞再生[11-12]。而来源于MSCs分泌的外泌体内含有丰富的蛋白质和miRNA,可以通过抑制肝细胞上皮-间充质转化和胶原生成来改善肝纤维化,也可以通过抑制肝星状细胞内的某些特定的信号通路(如抑制Smo的表达来抑制Hh信号的激活)来抑制细胞的增殖和激活,从而减轻肝纤维化的形成[13]。MSCs还可以提高肝组织血红素加氧酶-1(heme oxygenase,HO-1)的表达,通过HO-1的抗炎、抗凋亡作用,改善肝脏炎症环境,减少肝细胞凋亡,促进肝功能的恢复[14]。
3 干细胞治疗肝病的临床研究
目前,开展干细胞治疗肝病临床研究常用的干细胞为MSCs,以及经G-CSF骨髓动员后获取的干细胞。MSCs主要为自体或异体BM-MSCs,以及脐带来源的MSCs(umbilical cord-derived MSCs,UC-MSCs)。Mohamadnejad等[15]最早报道了关于MSCs治疗病毒性肝炎导致的终末期肝病的临床研究(见表1)。在该临床试验中慢性HBV感染相关的失代偿期肝硬化患者接受了自体BM-MSCs的治疗,患者的临床症状和生活质量明显改善,终末期肝病模型(model of end-stage liver disease,MELD)评分下降。之后国内外的一些临床研究也发现BM-MSCs和UC-MSCs能够短期内改善终末期肝病患者的临床症状和生活质量,降低肝硬化患者肝癌的发生率和病死率[16-19](见表1~2)。针对慢性HCV感染相关的终末期肝病患者,MSCs治疗能使Child-Pugh评分以及MELD评分明显降低,临床症状明显改善;此外,研究发现MSCs输注途径和是否分化为肝细胞样细胞对治疗效果无明显影响[20-21](见表1)。该结果可为干细胞输注途径和类型的选择提供参考,但以上结论还需要更多的临床研究支持。从骨髓获取MSCs为有创操作,对于肝硬化患者,获取自体BM-MSCs会增加额外的创伤,应用受到了一定的限制。而应用UC-MSCs对供者和受者无额外的有创操作,且来源广泛,细胞质量可控,伦理限制较少,故目前在临床研究中应用较为广泛。
经G-CSF骨髓动员后获取的CD34+BMSCs也是临床研究常用的干细胞类型。研究人员通过G-CSF进行骨髓动员后获取一定量外周血,再通过免疫磁珠分离等方法获得适宜数量的CD34+BMSCs,后经肝动脉、脾静脉或门静脉等回输入患者体内,研究结果显示患者耐受性良好,序贯器官衰竭估计(sequential organ failure assessment,SOFA)评分均明显下降,血清ALB水平升高,血清TBIL和ALT水平下降,国际标准化比值(international standarization ratio,INR)恢复正常,临床症状得到改善,并有效的延缓了肝性脑病、肝肾综合征和败血症等终末期肝病相关并发症的发展进程,生存率明显提高[22-26](见表3)。另外,针对未经动员的BMSCs的安全性和有效性,国内外也开展了相关临床研究,结果显示安全性良好,患者未出现严重不良反应,肝脏一过性弹性明显增强,体积逐渐恢复,肝功能和临床症状明显改善[27-32](见表4)。
针对酒精性肝硬化,有开展自体BM-MSCs治疗的临床研究,结果显示转化生长因子-1(transforming growth factor,TGF-1)、I型胶原蛋白和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等肝纤维化相关蛋白的表达减少,肝功能明显改善和Child-Pugh评分显著降低,无明显不良反应;肝脏病理显示:肝脏胶原的比例显著下降,肝脏组织结构明显改善[33-36](见表1)。应用G-SCF动员的BM-MSCs治疗,肝脏病理也显示:肝损伤部位巨噬细胞浸润增多,炎症和再生途径相关基因表达上调[37]。应用G-CSF动员的BMSCs治疗,患者耐受性较好,Child-Pugh评分、MELD评分以及SOFA评分均明显下降,肝功能明显改善,预后显著改善[23-24,38-39](见表4)。
随着对干细胞治疗机制的研究,干细胞免疫调节功能越来越受到关注,已成为治疗炎症性或自身免疫性疾病的重要依据。如经G-CSF动员获得的CD34+BMSCs可以改善自身免疫性肝病患者肝功能,促进ALB、INR、ALT和TBIL等指标恢复正常[23,37](见表3)。此外,Liang等[40]应用UC-MSCs治疗自身免疫性疾病[原发性干燥综合征、原发性胆汁性胆管炎(primary biliary cholangitis,PBC)、混合性结缔组织病、系统性硬化征、类风湿性关节炎等]导致的肝硬化,结果显示安全性好,在随访的2年内患者肝功能明显改善(见表3)。有两项分别应用BM-MSCs和UC-MSCs治疗PBC患者的研究结果显示,患者生活质量明显改善,血清中ALT、AST、γ-谷氨酰转移酶(γ-glutamyltransferase,γ-GT)和血清碱性磷酸酶(alkaline phosphatase,ALP)的水平均明显下降,外周血中CD4+CD25+Foxp3+T 细胞和IL-10水平均明显上升[41-42](见表1~2)。但Mohamadnejad等[15]通过肝动脉回输BM-MSCs分别治疗了1例PBC和1例自身免疫性肝炎(autoimmune hepatitis,AIH)导致的失代偿期肝硬化,发现患者虽然肝功能有一定程度的改善,但是出现了肾衰竭和肝肾综合征等并发症(见表1)。该研究团队的另一项临床研究通过外周静脉输注BMSCs治疗4例自身免疫性肝病和2例PBC患者,结果发现患者的临床症状不仅没有改善,而且出现了2例死亡事件[40](见表3)。这一结局提示外周静脉输注BMSCs对自身免疫性肝病患者可能是不利的,因此,BMSCs治疗AIH的有效性和安全性还须要进行更大样本量研究来评估。
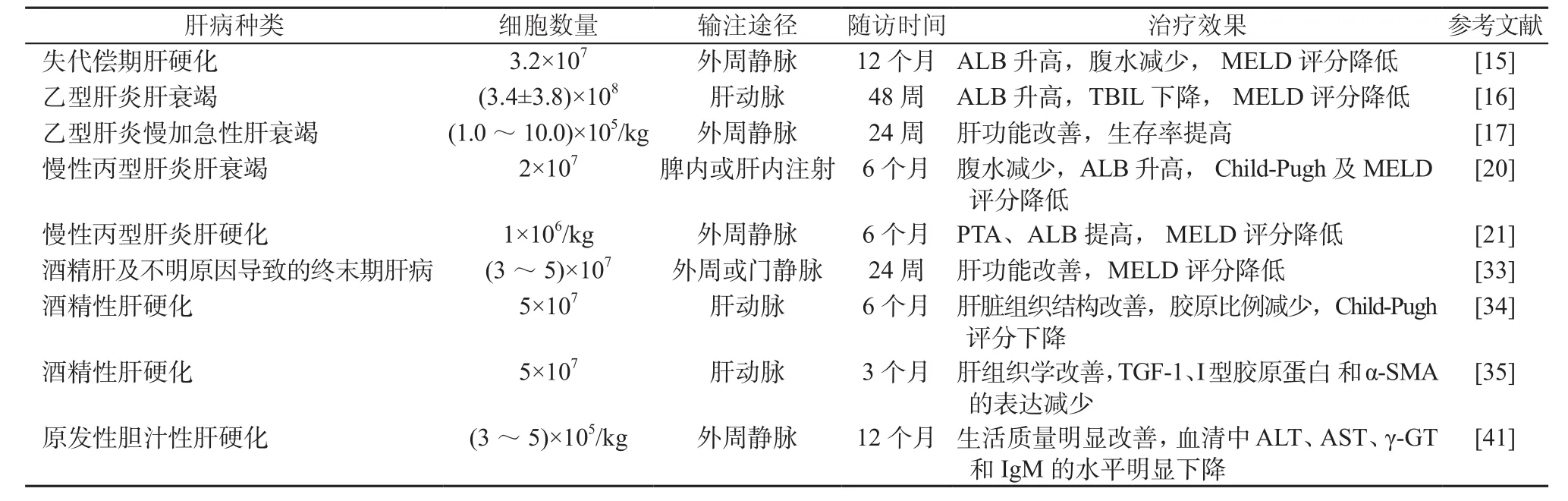
表1 MSCs治疗终末期肝病临床研究方案及主要结果Table 1 Clinical study protocols and main results about MSCs in treatment of end-stage liver disease

表2 UC-MSCs治疗终末期肝病临床研究方案及主要结果Table 2 Clinical study protocols and main results about UC-MSCs in treatment of end-stage liver disease
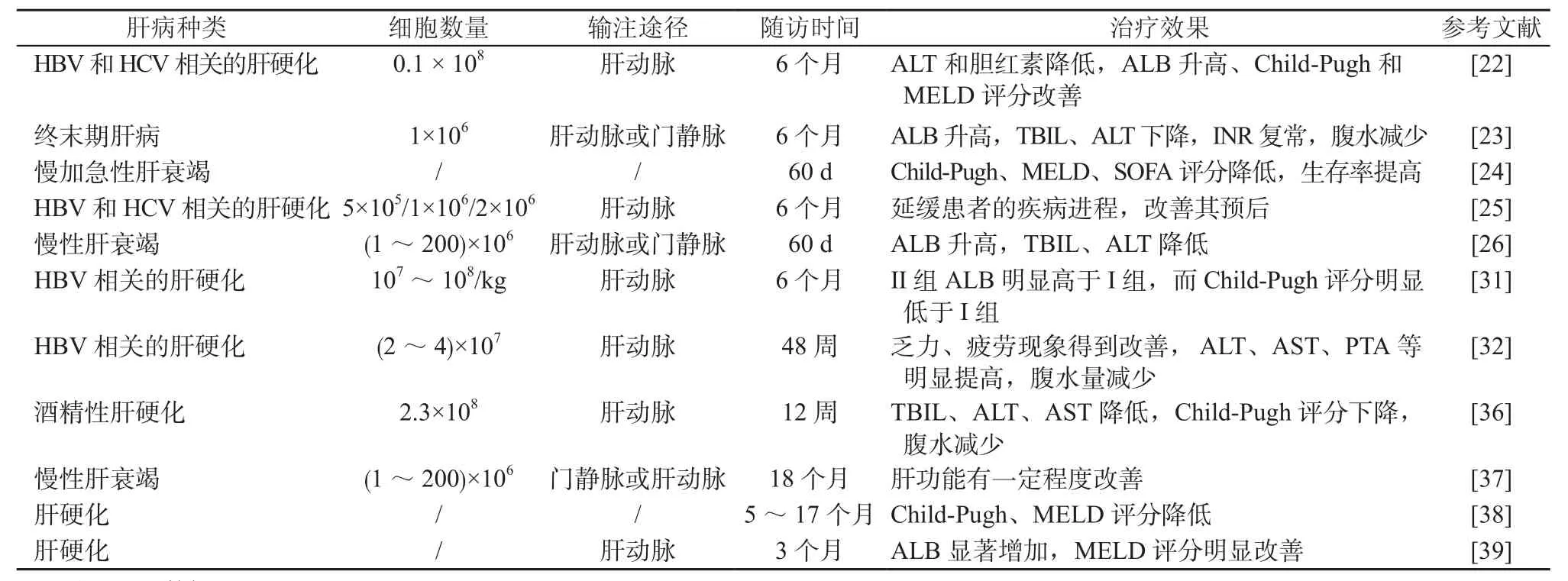
表3 G-CSF动员的BMSCs治疗终末期肝病临床研究方案及主要结果Table 3 Clinical study protocols and main results about BMSCs mobilized by G-CSF in treatment of end-stage liver disease
针对药物、遗传代谢性疾病(例如肝豆状核变性、酪氨酸血症等)、其他多因素合并以及不明原因导致的肝衰竭,干细胞治疗也取得了不错的成效。如应用自体骨髓单个核细胞移植、G-CSF动员的骨髓CD34+干细胞或BM-MSCs等,通过肝动脉或门静脉回输方式治疗上述原因导致的肝衰竭,结果显示安全性好,患者肝功能均明显改善,Child-Pugh、MELD 评分明显下降[24,28,30,33](见表1~2,4)。

表4 未经动员的BMSCs治疗终末期肝病临床研究方案及主要结果Table 4 Clinical study protocols and main results about unmobilized BMSCs in treatment of end-stage liver disease
4 结 语
总之,干细胞治疗终末期肝病的临床研究取得了很大进展,但目前的临床研究还存在不足之处,例如:大部分是单中心、小样本的临床研究,且研究方案各异、评价指标不一致等。同时,如何获得稳定、质量可控、能够满足临床需求的干细胞,怎样确保干细胞制品的有效性和安全性,细胞治疗的适应证、禁忌证如何,如何有效评估其安全性和有效性,干细胞最佳类型、最小输注数量和最佳输注途径、最佳治疗时机等问题尚待解决。目前,我国已颁布了《干细胞临床研究管理办法(试行)》,干细胞临床研究已实行临床研究机构备案和临床研究项目备案的双项备案制,在此制度的规范管理下,干细胞临床研究将会得到不断深入和有序的发展,干细胞治疗终末期肝病的临床应用指日可待。

