伊氏线虫真菌碳氮条件下的表型和毒力基因表达差异*
贺 然 王瑞珍 应 玥 曲良建 张永安
(1.中国林业科学研究院森林生态环境与保护研究所 国家林业和草原局森林保护学重点实验室 北京 100091; 2.北京市植物园 北京市花卉园艺工程技术研究中心 北京 100093)
松材线虫(Bursaphelenchusxylophilus)病自1982年在我国首次发生以来,造成松树(Pinusspp.)大量死亡,疫情不断扩展蔓延,且近年来有不断加重流行的趋势(叶建仁, 2019)。松材线虫病在亚洲和欧洲造成严重的生态和经济损失,其重要致病因子是全球公认的检疫性有害生物松材线虫(Futai, 2013; Vicenteetal., 2012; 叶建仁, 2019)。因此,如果不能尽快地有效地防控松材线虫病疫情,这一重大病害可能很快会在我国更大范围内流行,每年将会引发数亿株松树死亡,造成难以管控和治理的生态灾难(叶建仁, 2019)。目前我国对松材线虫的防治手段主要有化学防治、物理防治、生物防治及综合防治,但仍以化学防治为主,如使用化学药剂久效磷、甲胺磷、阿维菌素等进行点滴注干,虽然可以取得较好的防治效果,但对环境造成破坏,而且易使线虫产生抗性(蔡梦玲, 2019)。对松材线虫直接的大规模生物防治还没有典型实例,因此对松材线虫开展生物防治急需进一步研究和突破(张锴等, 2010)。
伊氏线虫真菌(Esteyavermicola,EV)是松材线虫的内寄生真菌,其产生的新月形孢子能够侵染并穿透线虫的角质层然后在松材线虫的体腔内繁殖,在室内纯培养条件下,24 h内90%的线虫被EV黏附性的弯月状孢子侵染,通常8~10天杀死所有的线虫,从线虫体内长出的菌丝形成弯月状的孢子进入下一个侵染循环(Liouetal., 1999; Wangetal., 2008),在松材线虫的生物防治方面具有良好的应用前景(Liouetal., 1999)。虽然EV在室内具有良好的防治松材线虫的效果,但在野外的防治效果却不太理想,对感染的松树需要数月的时间才能起到防治效果,而且需要松材线虫入侵前数周至数月提前喷洒或者注射EV(Wangetal., 2017; 2018)。因此,亟需提高EV的生长速率、产孢能力和杀线虫毒力,才能进一步提高EV的防治效果。目前主要通过马铃薯葡萄糖培养基(PDA)培养该真菌,菌株ATCC74485、CBS115803、CNU120806、NKF13222在PDA上生长一周菌落直径分别为3.0~4.8、3.0~3.7、4.0~4.5和3.1~3.5 cm(茅裕婷等, 2020)。自然界中,线虫真菌生存环境可获得的氮浓度很低,因此,感染线虫对这类真菌具有显著益处,可以弥补氮源不足(de Freitas Soaresetal., 2018)。而目前,以氮源为培养基的研究未见报导。本研究首次以氮源培养EV,以对比在碳氮培养下生长速率的差异,并探究EV在不同培养条件下杀线虫基因的表达差异,为明确EV在碳氮培养条件下的表达模式,提高EV的防治效果和以后大规模培养高毒力EV提供重要的理论支撑。
1 材料与方法
1.1 试验菌株
伊氏线虫真菌CBS115803,购于荷兰菌物保存中心。
1.2 培养基
2种培养基配方如下: 碳源培养基(代号C,6个重复样本分别编号为P1—P6): 24 g PDB(BD公司)和10 g琼脂溶于1 L双蒸水; 氮源培养基(代号N,6个重复样本分别编号为L1—L6): 5 g酵母粉(OXOID公司)和10 g琼脂溶于1 L双蒸水。碳氮混合培养基(C+N,6个重复样本): 上述2种培养基分别减半溶于1 L双蒸水中。
1.3 菌落生长、产孢量及菌落生长趋势图绘制
测量并记录3种培养基的菌落直径,计算每个处理的平均菌落直径和标准差。菌落生长趋势折线图由ggplot2-R包绘制。
1.4 转录组样品处理
分别将上述2种培养基配制固体C和N培养基,凝固后在培养基中放入已灭菌的尼龙膜(孔径3 μm,赛多利斯Sartorius),接种EV菌后于25 ℃培养7天。将长满菌丝和孢子的尼龙膜用无菌镊子取出,用超纯水冲洗尼龙膜,再用无菌的吸水纸吸掉尼龙膜接触培养基面的水分,而后将菌丝和孢子刮入2 mL无菌无核酸酶的干燥圆底离心管,迅速将样品管放入液氮中保存,供RNA提取与测序。
1.5 RNA提取与测序
RNA提取采用TaKaRa MiniBEST Plant RNA Extraction Kit试剂盒,按照操作说明书进行。通过琼脂糖凝胶电泳分析样品RNA完整性及是否存在DNA污染,使用NanoPhotometer spectrophotometer检测RNA纯度(OD260/280及OD260/230比值),使用Agilent 2100 bioanalyzer精确检测RNA完整性。测序完成后,经质控过滤获得clean reads,然后使用HISAT2 v2.0.5将其定位到参考基因组(SRA database in NCBI under the accession SRP097009)(Wangetal., 2018),基于基因模型注释文件生成拼接连接的数据库,并根据基因组的注释文件获得转录组功能注释结果。文库构建与RNA测序由诺禾致源科技股份有限公司采用Illumina测序完成。
1.6 基因表达水平定量和差异表达分析
采用当前最常用的每千个碱基的转录每百万映射读取数(fragements per kilobase of exon model per million mapped fragements, FPKM)估计基因的表达量,获得各样本中基因表达水平。通过计算Pearson相关系数评估重复样本相关性。使用DESeq2软件(1.16.1)进行2个比较组合之间的差异表达分析。结合经FDR法校正后的P值(Padj)以及|log2FoldChange|作为显著差异表达判断的依据。用H-cluster方法对差异基因表达量取log2(FPKM+1)并中心化校正后进行聚类。差异比较采用C为对照组,N为试验组,将差异表达基因划分为上调基因和下调基因,即样品N中的表达水平高于样品C中的表达水平为上调基因,反之为下调基因。
1.7 实时定量PCR验证
采用在线引物设计工具Primer3Plus(http:∥www.primer3plus.com/)设计基因特异性引物,采用R2(Fw: TCGTTGAGTAGACTCTGAATGCTG;Rv: AGCCAGATGTTCCACCCG)为内参基因(Llanosetal., 2015)。采用TransScript one-step gDNA Removal and cDNA Synthesis SuperMix(TransGen Biotech,北京)试剂盒进行DNA清除和反转录。验证的3个基因分别为ZGLK4627、novel315、ZGLK4572,所用的引物分别为CGATGCGATTGCCTCCTACT/AGTGCC AGAGATGGTGTTCG、CGCAGGGGAGACAAGATGTT/GGCAAAGCGTTTCTTGTCGT和GGCTGGATGGAGT CGTTTGA/TCGCCGGAGAGAGTGTTTTC。
2 结果与分析
2.1 碳氮培养下的表型
菌落形态上,N培养基菌落灰白色; C培养基则为暗绿色,菌落边缘灰白色; C+N培养基白绿色(图1)。生长速度上,N培养基的生长速度大于C培养基及C+N培养基(图2)。孢子产量上,N培养基产孢量最小,而且N培养基上不产生杆状孢子。C+N培养基上弯孢和杆孢均最多(图3)。
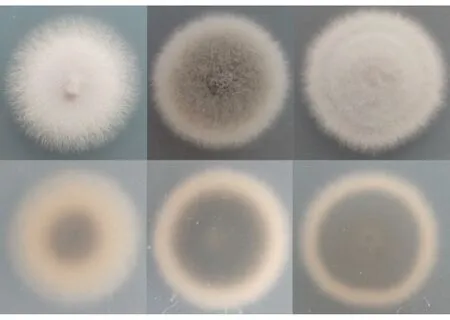
图1 3种培养基培养下的EV菌落形态Fig. 1 Morphology of EV colonies cultured in three mediums 左Left: N; 中Middle: C; 右Right: C+N; 上Up: 正面Front side; 下Down: 背面Back side.
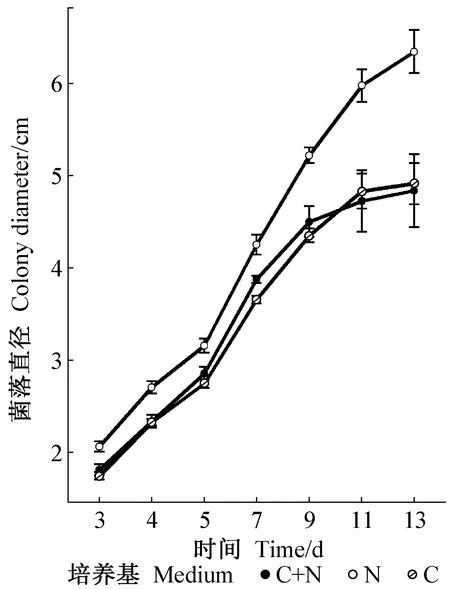
图2 3种培养基菌落生长趋势Fig. 2 Growth trajectory on three culture media
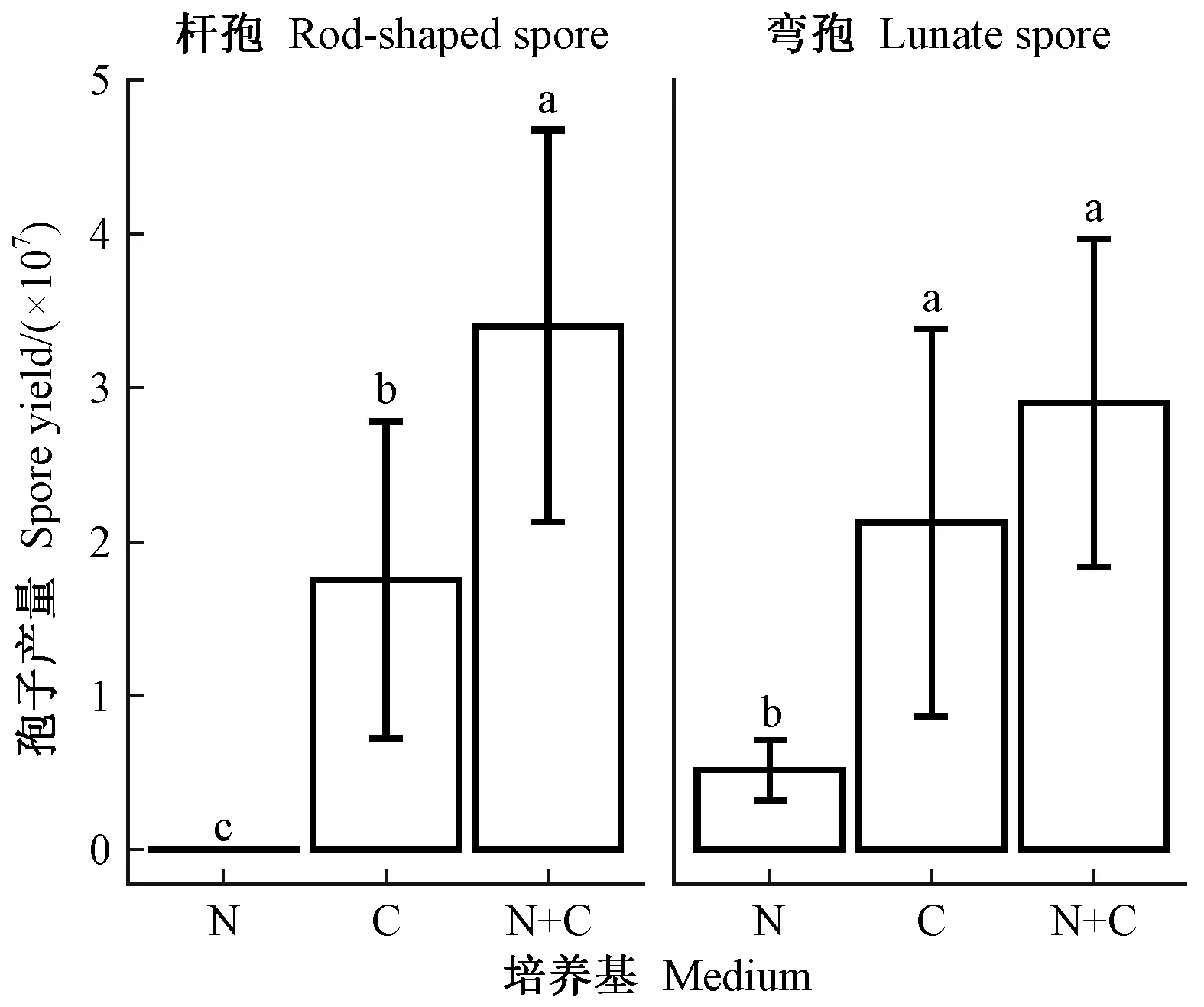
图3 3种培养基孢子产量Fig. 3 Spore yields on three culture media 误差线上字母表示差异显著性,相同字母表示在0.05水平无显著差异。The letters above the error bars present the significance of the difference and the same letter indicates non-significant at P<0.05.
2.2 转录组测序数据质量、mapping及基因定量分析
为了研究EV在C培养基和N培养基下杀线虫基因的表达情况,进行了2组转录表达的比较研究。每个样品产生了超过63 M的clean reads,总碱基数超过8.9Gb,Q30(碱基识别出错率小于1/1 000)占比超过93%。经过与EV基因组比对,97%的片段可定位到基因组上,其中比对到EV基因组唯一位置的片段数约96%~97%,比对到EV基因组多个位置的片段低于0.4%。从基因表达盒形图可以看出,N培养条件下EV基因表达水平高于C培养条件下EV基因表达水平(图4)。Pearson相关性分析表明,组内相关性大于0.9,组间相关性仅为0.5~0.6(图5),组间差异大于组内差异。

图4 12个样品表达水平Fig. 4 Expression level box plots of 12 samples
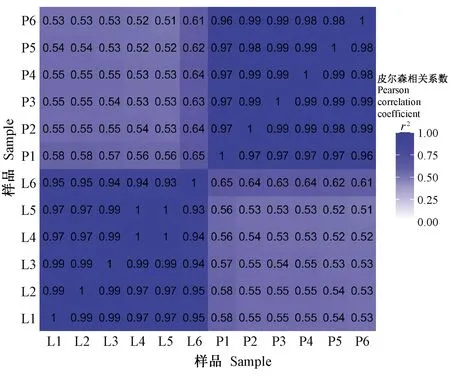
图5 12个样品相关性系数Fig. 5 Correlation coefficient graph of 12 samples
2.3 组间差异基因分析
在Padj(FDR)≤0.05且|log2FoldChange|≥0(即差异倍数≥2)作为显著差异表达阈值这一条件下,N组相对C组显著差异表达的基因共有7 138个,其中显著上调的3 571个,显著下调的3 567个(图6)。在C、N组中共同表达的核心基因有7 560个, 在N组中特有表达的基因474个,在C组中特有表达的基因295个(图7),可见,N培养条件下表达的基因更丰富。在特有表达的基因中,N组表达的转录因子15个,是C组表达的转录因子的3倍(5个)。MFS家族、糖转运蛋白(sugar_tr)和P450等基因在N组也高表达,在杀线虫过程中起重要作用的枯草杆菌蛋白酶S8(Peptidase_S8)在N组特异性表达了3个,而在C组则没有特异性表达。激酶(Pkinase)基因在N组特异性表达了5个,在C组则特异表达了4个激酶基因(表1)。

图6 差异基因表达量变化Fig. 6 Volcano diagram of differential gene

图7 不同比较组合间差异基因数量Fig. 7 Venn diagram of differential genes between different comparison groups
经过聚类分析,将差异基因表达水平变化趋势分为4个类群,同一类群中的基因在不同的处理条件下具有相似的表达水平变化趋势(图8)。在N组表达远高于C组表达的基因[log2(FPKM+1)约为6]聚为cluster_1,该组涉及到的基因为165个; 在C组表达远高于N组表达的基因[log2(FPKM+1)约为5]聚为cluster_2,该组涉及到的基因为65个; 在N组表达稍高于C组表达的基因[log2(FPKM+1)约为1]聚为cluster_3; 在C组表达稍高于N组表达的基因[log2(FPKM+1)约为1]聚为cluster_4,cluster_3和cluster_4涉及到的基因分别为3 406个和3 303个。特别值得关注的是,在cluster_1中(即N组高表达)有4个真菌转录因子(Fungal_trans)、1个Peptidase_S28、2个Peptidase_S8; 而在cluster_2(即C组高表达)中,则是无Fungal_trans、Peptidase_S28和Peptidase_S8(表2)。

表1 碳氮组特有表达基因统计Tab.1 Specific expression gene statistics between carbon and nitrogen group
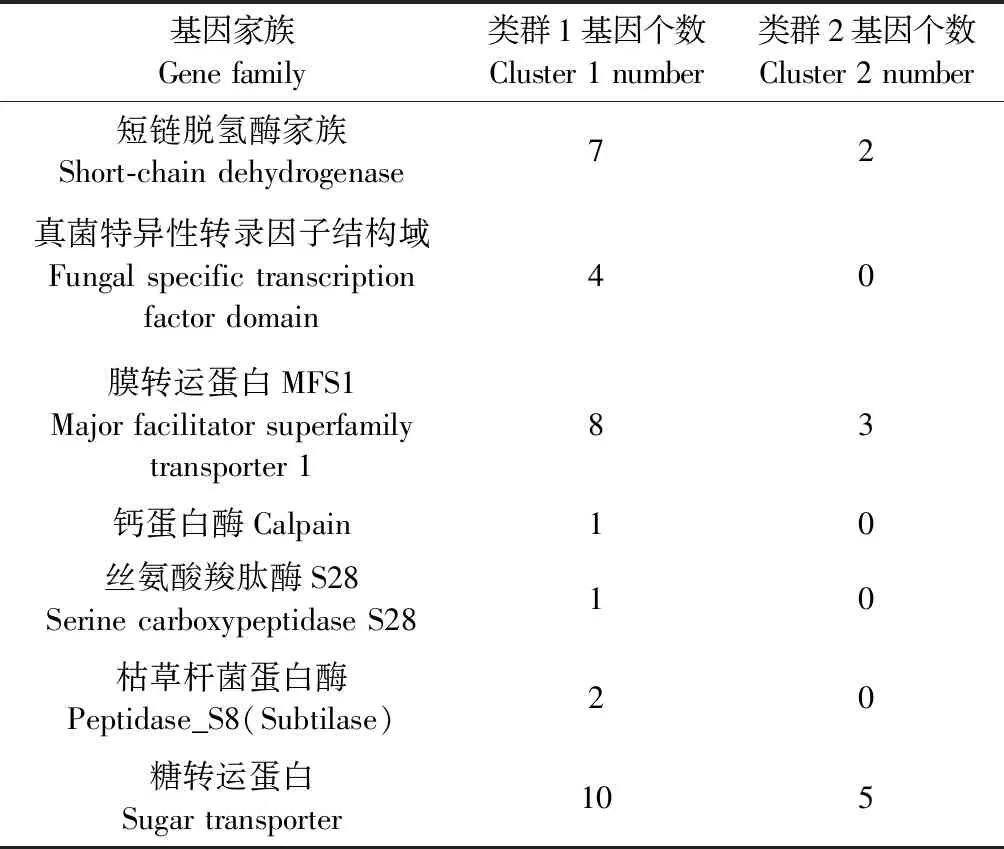
表2 图8中cluster_1和cluster_2表达基因统计Tab.2 Specific expression gene statistics between cluster_1 and cluster_2 inFigure 8
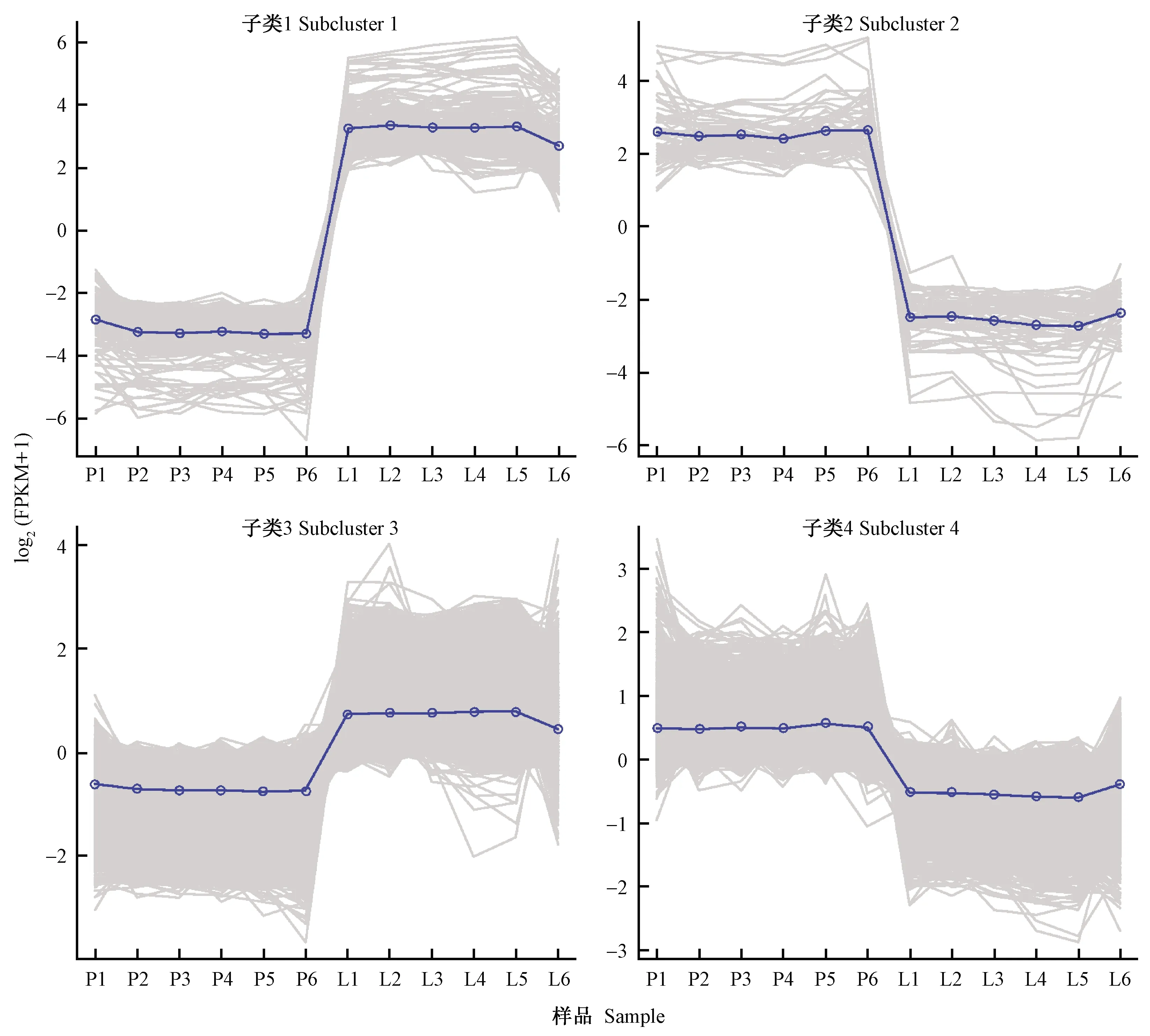
图8 基因表达水平变化趋势的聚类Fig. 8 Cluster line chart of the trend of gene expression levels
2.4 致病相关基因差异表达
1) 丝氨酸蛋白酶相关基因: 在致病真菌中,丝氨酸蛋白酶是昆虫和农业有害线虫的致病因子(Yangetal., 2007)。特别是枯草杆菌蛋白酶S8(subtilases/peptidase S8)具有致死线虫的活性,并参与侵染线虫的过程(Wangetal., 2009; 2007; Yangetal., 2005),而且枯草杆菌蛋白酶S8在食线虫真菌基因组中含量丰富(Wangetal., 2018)。为明确在C、N培养条件下EV真菌对线虫毒力的差异,统计了属于丝氨酸家族的peptidase S8、peptidase S28二类基因在组间的变化:共鉴定到显著上调(其P值和Padj值均为0)的属于枯草蛋白酶家族S8基因13个(表3)。基因长度分布在1 182~3 678 bp之间;分别为相对于C组表达的2.29~363.52倍,log2FoldChange为1.20~8.51。其中5个在病原宿主数据库(pathogen host interactions,PHI-base)中注释到,注释结果显示除一个基因不影响致病性外,其他4个基因的突变表型均导致对宿主致病力下降。只有一个基因(ZGLK1168)显著下调,log2FoldChange只有-0.96,下调的倍数较小。丝氨酸蛋白酶S28基因只有上调,上调的3个基因log2FoldChange分别为1.84、3.18和6.22,上调表达的差异倍数很大(表3)。
2) 毒素相关基因: 微生物产生的毒素是导致微生物致病性的重要毒力决定因素(Mohamadzadeh, 2009)。许多植物病原真菌通过分泌毒素杀死宿主细胞(Ottmannetal., 2009)。同样的,食线虫真菌也通过分泌毒素攻击线虫(Lpez-Llorcaetal., 2008)。食线虫真菌的化学生态学还远未弄清(Degenkolbetal., 2016a; 2016b)。目前已经鉴定到的具有杀线虫活性的物质有oligosporon、4′,5′-dihydrooligosporon、talathermophilins A和B、phomalactone、aurovertins D和F、paeciloxazine、apyridine carboxylic acid derivative和leucinostatins等,但这些杀线虫物质主要是从子囊菌纲中具有捕食结构的食线虫真菌(Nematode-trapping fungi)及侵染线虫卵和胞囊的食线虫真菌中分离到的(Degenkolbetal., 2016a)。关于线虫内寄生性真菌(Endoparasitic fungi)中杀线虫毒素的研究极少。内寄生真菌EV在不同碳氮培养条件下,毒素合成相关基因表达差异显著,与病原宿主数据库比对,多数毒素合成相关基因的突变表型表明,这些基因属于致病基因(表4)。
36个差异表达毒素相关基因,共有25个与毒素相关的基因上调,11个与毒素相关的基因下调。差异表达的16个T-toxin的调控合成基因(RTtB)中,13个基因上调,3个基因下调。2个AF-toxin合成相关基因(CaE-EAKt)上调,3个AK-toxin合成相关基因上调。这些毒素相关基因最高的上调132倍,为HC-毒素外排转运蛋白; 合成AK-toxin必须的ZGLK3633基因上调22.3倍。PHI数据库注释结果表明,36个差异表达基因中的33个基因可在PHI数据库中获得注释,其中的32个基因与致病性相关,其中8个基因的敲除可直接导致病原菌失去致病力,8个基因中的6个均在N组高表达(表4)。
2.5 实时定量PCR验证
选取3个基因ZGLK4627、novel315、ZGLK4572 进行实时定量PCR验证。结果显示,3个基因在N组中上调表达(图9),与转录组结果一致。
3 讨论
先前通过不同培养基培养研究真菌的主要方向是研究真菌在不同营养培养基中的生长特性,如产孢量、菌落特征、生长速度等(Meletiadisetal., 2001)。本研究表明,EV在N培养基中生长速度快,在C+N培养基中产孢量高。在C+N培养基中生长速度并没有N培养基中高(观测时间内),可能原因是C+N混合培养基中,EV首先利用单糖和其他寡糖,然后才利用其他营养。本研究发现在氮培养条件下EV基因的整体表达水平高于碳培养条件,而且氮培养条件下,EV特异表达的基因多于C组。在氮组中特异表达的基因中,有调控基因转录的转录因子、降解线虫体壁的枯草杆菌蛋白酶S8和在细胞的信号转导、代谢等生命活动中起广泛作用的激酶基因。
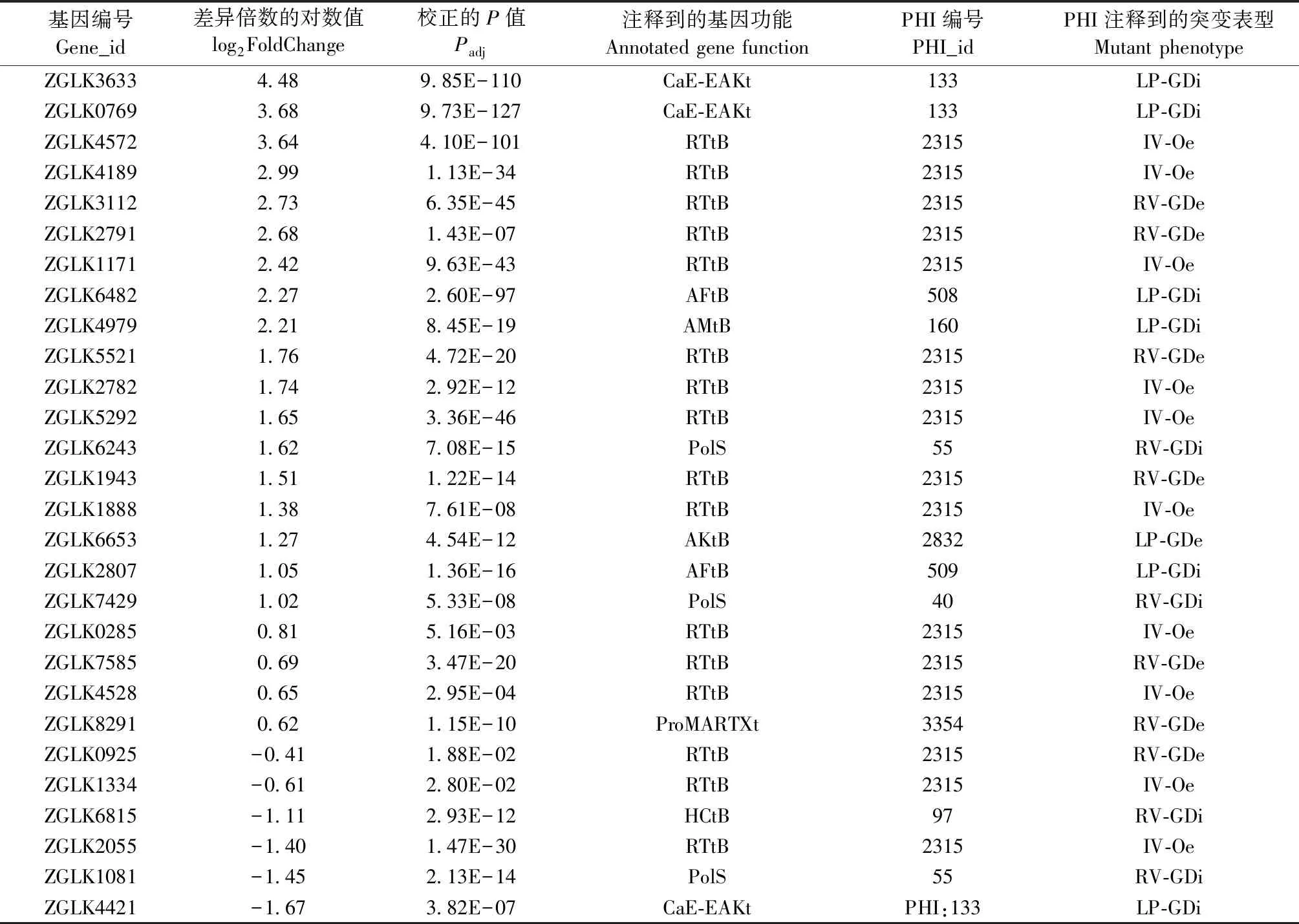
表4 差异表达毒素相关基因统计①Tab.4 Statistics of differential expression of toxin-related genes

图9 实时定量PCR对3条差异表达基因的验证Fig. 9 Confirmation of the expression profiles of 3 differential expression genes by real-time RT-PCR 误差线上字母表示差异显著性,相同字母表示在0.05水平无显著差异。 The letters above the error bars present the significance of the difference and the same letter indicates non-significant at P<0.05.
真菌的胞外枯草杆菌蛋白酶S8参与真菌的致病性,并在多种昆虫病原真菌和食线虫真菌中得到证实(Bidochkaetal., 2000; Huangetal., 2004; Keniryetal., 2002; Lietal., 2017; Luglietal., 1997; Mortonetal., 2003)。该种蛋白酶最初从昆虫病原绿僵菌(Metarhiziumanisopliae) (Legeretal., 1987)和白僵菌(Beauvariabassiana)中分离和鉴定(Bidochkaetal., 1987)。食线虫真菌产生的枯草杆菌蛋白酶能降解线虫角质中的蛋白及卵壳中的蛋白,在侵染线虫过程发挥重要作用(Mortonetal., 2004)。该蛋白酶可从少孢节丛孢菌(Arthrobotrysoligospora)(Wangetal., 2006)和厚垣孢普可尼亚菌(Pochoniachlamydosporia) (Segersetal., 1994)等食线虫真菌中分别纯化和鉴定。EV真菌在氮培养条件下Peptidase_S8家族中的多个基因表达显著上调,最高的表达差异倍数大于60倍。因此可以推测氮培养条件有利于杀线虫基因的表达。
许多微生物会产生有毒代谢产物,进而从营养来源中排除竞争性微生物。寄生的昆虫病原真菌和食线虫真菌通过毒素使宿主失去活力来促进感染(Mortonetal., 2004)。昆虫病原真菌绿僵菌产生一种称为destruxins的毒素,可以杀死昆虫,并且destruxin的产生与致病性相关(Kershawetal., 1999)。食线虫真菌也可产生毒素(Morgan-Jonesetal., 1985)。培养基、pH值等试验条件会影响杀线虫真菌代谢产物的产生,如不同的pH值和培养基导致厚垣孢普可尼亚菌杀线虫代谢物的差异;Khambay等(2000)进一步从该菌中分离到一种杀线虫代谢产物phomalactone,该毒素在侵染线虫幼虫的过程中发挥作用。食线虫真菌EV在氮培养条件下,大量的毒素合成基因或毒素调控基因高表达,该培养条件很可能会产生大量的毒素,但需要进一步的试验验证。EV真菌的杀线虫毒素有待进一步开发。基于EV不同培养条件下的表型数据及固有的EV高碳培养方式,建议培养时加入一定量的氮源,从而提高孢子产量。根据转录差异分析结果,N培养条件下可提高杀线虫基因和毒素产生基因的表达,或许可以缩短侵染松材线虫的时间,这需要进一步的试验验证。
4 结论
松材线虫生防真菌EV在N培养基下生长速度快,在C+N培养基中2种孢子的产量高。通过转录组数据,分析了C、N培养基下差异表达基因和特异表达基因。氮培养条件下的EV真菌表达的总基因数量和特异表达的基因数量高于碳培养条件下的基因表达。具有杀线虫作用的枯草杆菌蛋白酶、毒素合成等相关基因在氮培养下显著上调。研究结果可为高毒力EV菌株的培养和提高EV生防真菌的防治效果提供重要理论基础。

