外源H2S对盐碱胁迫下裸燕麦幼苗生长 和生理特性的影响
刘建新,刘瑞瑞,贾海燕,卜 婷,李 娜
(甘肃省高校陇东生物资源保护与利用省级重点实验室/陇东学院生命科学与技术学院,甘肃庆阳 745000)
土壤盐碱化是制约农业生产和生态环境建设的全球性问题。据报道,全球盐碱地面积大约 9.5×108hm2;中国西北、东北和滨海地区盐碱地广泛分布,总面积达3.6×107hm2,而且还呈逐年增加趋势[1]。中国内陆盐碱地盐化和碱化多相伴发生,且成分复杂、程度各异,对农作物生长发育造成盐碱混合胁迫[2]。土壤盐化与碱化分别以盐度和pH值升高为主要特征,但盐碱混合胁迫并不是盐胁迫(中性盐胁迫)和碱胁迫(碱性盐胁迫)的叠加,两者间的协同效应对作物的伤害常远大于单一盐、碱胁迫[3]。关于作物盐碱胁迫的研究目前多以单一盐[4]或碱[5]胁迫为主,盐碱混合胁迫研究相对少见。研究表明,盐碱混合胁迫会降低土壤渗透势,使作物离子失衡和生理代谢紊乱、生长受抑和产质量下降[2,6]。盐碱混合胁迫也导致植物活性氧代谢失调[7],降低线粒体功能[1]和叶绿体光能转换效率,甚至引起植株死亡[6,8]。因此,探索增强植物耐受盐碱胁迫的技术途径,对合理有效利用盐碱地资源,提高农作物产量和改善生态环境具有重要现实意义。
硫化氢(H2S)是继NO和CO之后在植物体中发现的第3种气体信号,它主要以L/D-半胱氨酸为底物通过L/D-半胱氨酸脱巯基酶催化产生[9]。目前,研究者多以NaHS作为外源H2S供体研究H2S对植物生长发育和生理代谢过程的调控,如用NaHS处理水蕹菜诱导了其内源H2S的产生,并由此改善植株能量状况和增强抗氧化能力,从而延缓叶片的黄化和衰老[10]。H2S参与植物对各种逆境响应的调节,能够提高植物对非生物胁迫的抗性,如提高植物抗旱性[11]、耐热性[12]、抗冷性[13]和重金属胁迫耐性[14]。H2S也可以增强植物的耐盐性。朱会朋等[15]研究表明,H2S能促进NaCl胁迫下杨树Na+外排和减弱K+外流;Deng等[16]指出,外源H2S主要通过降低Na+含量缓解NaCl胁迫对小麦幼苗的伤害;Chen等[17]证明,外源H2S通过NO介导的Na+/H+逆向转运蛋白及H+-ATP酶基因表达影响Na+、K+稳态,从而增强高盐胁迫对大麦的伤害。H2S还可增强水稻[18]、玉米[19]和茶[20]对NaCl胁迫的抗性等。这些关于H2S调控植物耐盐性的研究均以NaCl胁迫为条件,而有关盐碱混合胁迫下植物对外源H2S的响应机制研究鲜见报道。裸燕麦(Avenanuda)是中国西部地区广泛种植的一种禾本科燕麦属杂粮作物,具有较强的耐盐碱特性,被认为是改良盐碱地的先锋作物[2]。然而,盐碱混合胁迫是裸燕麦生长发育和产质量提高的重要制约因素之一。本试验以裸燕麦为材料,试图通过盆栽沙培试验,模拟裸燕麦种植区土壤盐碱环境,研究喷施H2S供体NaHS对植株生长、叶片活性氧代谢和渗透物质积累的影响,揭示H2S调控植物抗盐碱性的生理机制及探寻适宜的NaHS喷施浓度,以期为裸燕麦的抗盐碱栽培提供理论依据和指导。
1 材料与方法
1.1 供试材料及培养
H2S供体硫氢化钠(NaHS)和其他试剂均购自Sigma-Aldrich公司。模拟甘肃省中部裸燕麦种植区土壤盐分组成,按摩尔比NaCl∶Na2SO4∶Na2CO3∶NaHCO3=12∶8∶1∶9配制50 mmol·L-1盐碱混合溶液(浓度由预试验确定),盐碱混合溶液配制参考文献[21]的方法。
供试裸燕麦品种为定莜9号,种子购自甘肃省定西市农业科学研究院。挑选大小一致的健康裸燕麦种子,用1% NaClO消毒后在25 ℃催芽3 d,选发芽一致的萌发种子播种在塑料盆(口径200 mm,高140 mm)的珍珠岩基质中,每盆播150粒左右,置于日光温室常规培养,光强350~640 μmol·m-2·s-1,昼/夜温度为(22±5)℃/(17±7)℃,相对湿度为(65±9)%。幼苗长至2叶期进行间苗,每盆选留一致壮苗约100株,3叶期时浇Hoagland营养液300 mL进行养分补充,2 d后按试验设计进行处理。
1.2 试验处理
试验设7个处理:对照(CK),根部浇蒸馏水+叶面喷蒸馏水;T0,根部浇50 mmol·L-1盐碱混合溶液+叶面喷蒸馏水;T25,根部浇50 mmol·L-1盐碱混合溶液+叶面喷25 μmol·L-1NaHS;T50,根部浇50 mmol·L-1盐碱混合溶液+叶面喷50 μmol·L-1NaHS;T100,根部浇50 mmol·L-1盐碱混合溶液+叶面喷100 μmol·L-1NaHS;T200,根部浇50 mmol·L-1盐碱混合溶液+叶面喷200 μmol·L-1NaHS;T400,根部浇50 mmol·L-1盐碱混合溶液+叶面喷400 μmol·L-1NaHS。
盐碱混合溶液用Hoagland营养液配制。为避免盐碱冲击幼苗,按每天25 mmol·L-1递增至50 mmol·L-1后记为处理开始。根部浇灌每2 d进行一次,每盆浇灌量300 mL;叶面喷施仅在根部浇灌盐碱混合溶液达到50 mmol·L-1的第1天至第3天早晚各喷一次,以后不再喷施。喷施以叶片滴液为止,喷施量每盆15 mL左右,喷施液中添加0.01% Tween-80来降低表面张力。每4盆为1个重复,重复5次,随机排列。处理 7 d后取幼苗功能叶用液氮速冻后-80 ℃保存,测定生理指标,处理14 d后分别测定幼苗根系和地上部生物量。
1.3 测定指标与方法
1.4 数据统计分析
采用Microsofte Excel 2007计算和整理数据,用SPSS 20.0软件单因素方差分析(百分数数据进行反正弦平方根转换),用Duncan’s法差异显著性检验(α=0.05),结果用平均值±标准差表示。参考刘建新等[21]的方法计算生理指标的隶属函数综合评价值(D),综合评价H2S对盐碱胁迫裸燕麦幼苗生理响应的调控作用。
2 结果与分析
2.1 外源H2S对盐碱混合胁迫下裸燕麦幼苗叶片H2S含量和LCD活性的影响
与CK相比,盐碱混合胁迫(T0)显著提高了裸燕麦幼苗叶片内源H2S含量和LCD活性,增幅分别为18.9%和51.7%(图1)。盐碱混合胁迫下施用25~400 μmol·L-1NaHS处理(T25、T50、T100、T200、T400)均显著提高了幼苗叶片内源H2S含量和LCD活性,且随NaHS施用浓度升高,H2S含量和LCD活性呈不断增加趋势。
2.2 外源H2S对盐碱混合胁迫下裸燕麦幼苗生长的影响
从表1可见,盐碱混合胁迫(T0)下裸燕麦幼苗根、地上部鲜重和干重均显著低于CK;盐碱混合胁迫下,与T0处理相比,T25和T50处理可不同程度提高裸燕麦幼苗根、地上部鲜重和干重,其中T50处理的促进效果较好;其他喷施NaHS处理的根、地上部、全株的鲜重和干重与T0处理的差异不显著或较之显著下降。这说明喷施低浓度H2S可缓解盐碱胁迫对裸燕麦幼苗生长的抑 制,高浓度H2S会加重盐碱胁迫对生长的抑制 程度。
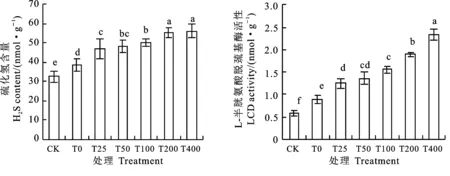
图柱上不同字母表示处理间差异显著(P<0.05)。图2~图4同。
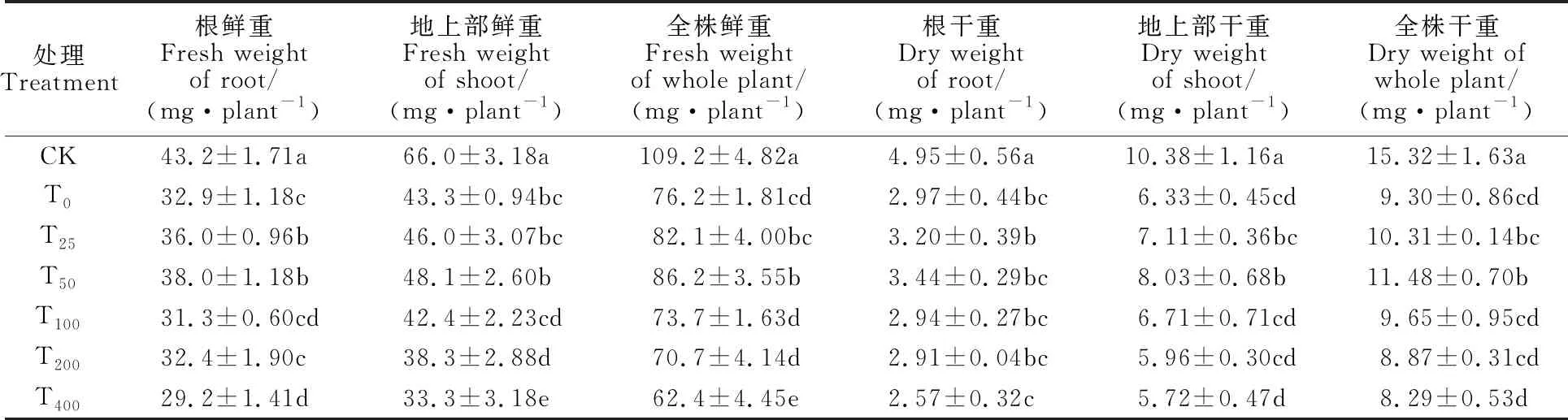
表1 外源H2S对盐碱混合胁迫下裸燕麦幼苗生物量的影响Table 1 Effect of exogenous H2S on the biomass of naked oat seedlings under salt-alkaline mixed stress
2.3 外源H2S对盐碱混合胁迫下裸燕麦幼苗叶片光合色素含量的影响
与CK相比,盐碱混合胁迫(T0)显著降低了裸燕麦幼苗叶片的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量(表2)。盐碱混合胁迫下T25~T400处理的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量较T0处理分别提高6.3%~23.4%、 6.4%~19.3%、7.1%~21.4 %和 37.4%~ 118.7%,其中T100处理对总叶绿素含量影响最明显,T50处理对类胡萝卜素含量影响最大。

表2 外源H2S对盐碱混合胁迫下裸燕麦幼苗光合色素含量的影响 Table 2 Effect of exogenous H2S on photosynthetic pigment contents of naked oat seedlings under salt-alkaline mixed stress mg·g-1
2.4 外源H2S对盐碱混合胁迫下裸燕麦幼苗叶片含量和质膜相对透性的影响


表3 外源H2S对盐碱混合胁迫下裸燕麦幼苗叶片 H2O2和MDA含量及质膜相对透性(RPPM)的影响Table 3 Effect of exogenous H2S on contents of and malondialdehyde(MDA) and relative permeability of plasma membrane(RPPM) in leaves of naked oat seedlings under salt-alkaline mixed stress
2.5 外源H2S对盐碱混合胁迫下裸燕麦幼苗叶片抗氧化系统的影响
与CK相比,盐碱混合胁迫(T0)显著提高了裸燕麦幼苗叶片SOD、CAT和POD活性,降低了APX活性,对ASA和GSH含量无显著影响(图2)。盐碱混合胁迫下,T25、T50、T100处理的SOD和CAT活性较T0处理均不同程度提高, T200处理的SOD和CAT活性与T0处理的差异不显著,T400处理的SOD和CAT活性显著低于T0处理;T25、T50、T100、T400处理的POD活性显著低于T0处理,T200处理的POD活性与T0处理差异不显著。T50、T100处理显著提高了APX活性,而T25和T200处理的APX活性与T0处理差异不显著,T400处理的APX活性显著下降; T25~T400处理对裸燕麦叶片ASA含量无显著影响,但均不同程度提高GSH含量,其中T50、T100、T200和T400处理的GSH含量增加20.6%、 33.0%、29.0%和35.7%,与T0处理差异均 显著。
2.6 外源H2S对盐碱混合胁迫下裸燕麦幼苗叶片渗透调节物质含量的影响
由图3可知,与CK相比,盐碱混合胁迫(T0)显著提高了裸燕麦叶片游离氨基酸、脯氨酸和可溶性蛋白质含量,降低了可溶性糖含量。盐碱混合胁迫下,与T0处理相比,T25处理对游离氨基酸含量无显著影响,但显著提高脯氨酸含量;T50、T100、T200、T400处理的游离氨基酸含量显著降低;T25处理的可溶性糖含量显著降低, T50处理显著升高, T100、T200和T400处理变化不大;T25~T400处理对可溶性蛋白质含量均无显著影响。

图2 外源H2S对盐碱混合胁迫下裸燕麦叶片SOD、CAT、POD和APX活性及ASA、GSH含量的影响Fig.2 Effects of exogenous H2S on SOD,CAT,POD and APX activities and ASA and GSH contents in leaves of naked oat seedlings under salt-alkaline mixed stress

图3 外源H2S对盐碱混合胁迫下裸燕麦叶片游离氨基酸、脯氨酸、可溶性糖和可溶性蛋白质含量的影响Fig.3 Effects of exogenous H2S on the contents of free amino acid,proline,soluble sugar and soluble protein in leaves of naked oat seedlings under salt-alkaline mixed stress
2.7 外源H2S对盐碱混合胁迫下裸燕麦幼苗生理效应的隶属函数综合评价
由图4可见,盐碱混合胁迫(T0)的综合评价值(D) 略高于CK,但差异不显著;盐碱混合胁迫下T25、T50和T100处理之间D值差异不显著,但显著高于其他处理,说明喷施一定浓度的H2S对裸燕麦幼苗生理有明显的综合改善效应。

图4 隶属函数综合评价外源H2S对 裸燕麦幼苗耐盐碱性的影响Fig.4 Effects of exogenous H2S on the tolerance of naked oat seedlings to salt-alkaline were evaluated by membership function
3 讨 论
植物体内H2S可通过LCD催化半胱氨酸分解成丙酮酸和氨时产生[9]。本试验结果表明,盐碱混合胁迫下裸燕麦幼苗叶片LCD活性和H2S含量显著升高(图1),说明LCD催化产生的H2S可能参与裸燕麦对盐碱胁迫的响应。Riemenschneider等[27]发现,外源H2S可诱导拟南芥内源H2S含量和LCD活性提高。本试验中,喷施25~400 μmol·L-1NaHS提高了盐碱混合胁迫下裸燕麦叶片H2S含量和LCD活性,且H2S含量和LCD活性随NaHS浓度增大而提高(图1)。这与前人在单一盐胁迫下其他植物上的研究结果一致[28],说明外施H2S供体能够通过激活LCD活性提高盐碱胁迫下植物内源H2S的含量。


