当归红芪超滤物对放射性H9C2细胞损伤 TNF-α/CTRP9信号通路相关因子表达的影响
孔姗姗,汪鸣,蒋虎刚,王新强,王艳平,邱璐,邱勇玉,赵信科
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃中医药大学附属医院,甘肃 兰州 730000
放射性心脏病(radiation-induced heart disease,RIHD)是目前已知的胸部恶性肿瘤放疗后死亡的主要非恶性原因之一,并且与其高发病率和死亡率相关[1-2]。目前,临床针对RIHD尚无确切的治疗方法,可用于对症治疗的药物盐酸贝那普利由于有头晕头痛、干咳、心慌、全身疲乏等不良反应而不能被广泛使用[3]。因此,深入研究RIHD的发病机制,寻找安全、有效防治RIHD的药物,提高正常心脏的耐受剂量是胸部恶性肿瘤放射治疗亟需解决的重要问题。国外研究发现,电离辐射可激活TNF-α信号通路,肿瘤坏死因子-α(TNF-α)可结合心肌细胞膜表面特异性受体直接参与多种心肌损伤[4-5],可能是RIHD的潜在发病机制之一。TNF-α作为肿瘤坏死因子相关蛋白9(CTRP9)的上游信号分子,在心肌损伤过程中可调控CTRP9的表达[6]。本课题组前期研究发现,当归红芪超滤物可通过抑制细胞凋亡、氧化应激、心肌纤维化等途径防治放射性心肌损伤[7],但其防治RIHD的具体机制尚未完全明确。因此,本实验以放射性H9C2细胞损伤为模型,基于TNF-α/CTRP9信号通路研究当归红芪超滤物抗辐射致心肌损伤的作用及潜在机制,为当归红芪超滤物防治RIHD提供依据。
1 实验材料
1.1 动物及细胞
SPF级成年SD大鼠30只,体质量(200±20)g,甘肃中医药大学科研实验中心提供,动物许可证号SCXK(甘)2018-049。饲养于甘肃中医药大学SPF级实验室,温度(23±2)℃,相对湿度45%~55%,12 h光暗周期循环,常规标准饲料喂养。H9C2细胞购于美国模式菌种保藏中心,编号CRL-1446。
1.2 药物
当归红芪超滤物,本课题组前期分离所得,批号20190619;盐酸贝那普利片,深圳信立泰药业股份有限公司,5 mg/片,批号20181114。
1.3 主要试剂与仪器
肌钙蛋白T(cTnT)、肌钙蛋白Ⅰ(cTnⅠ)及C-反应蛋白(CRP)ELISA试剂盒,杭州联科生物技术股份有限公司,批号分别为39560978、56430821、60732801;RNA提取试剂盒、反转录试剂盒及RT-PCR试剂盒,日本TAKARA公司,批号DRR053A;蛋白提取试剂盒,北京索莱宝科技有限公司,货号PC0020;TNF-α和CTRP9抗体,美国Immunoway公司,货号分别为YM3906、YM6867;转化生长因子-β(TGF-β)和α-平滑肌肌动蛋白(α-SMA)抗体,美国Immunoway公司,货号分别为YM6305、YM3365。超净工作台、Eppendorf移液枪、酶标仪(美国Thermo公司),Titan电镜(日本奥林巴斯),PE2400型PCR扩增仪(美国PE公司),高速低温离心机(美国Sigma公司),精密电子天平(OHAUS公司),CO2细胞培养箱(日本三洋,型号CabinetX-raysystem),激光共聚焦显微镜(日本奥林巴斯,OLYMPUSIX81),X-ray机(美国Faxitron公司)。
2 实验方法
2.1 造模
依据本课题组前期研究结果,同时参考相关文献辐射剂量[8-9],6 Gy为建立RIHD细胞模型的最佳辐射剂量。因此,本研究采用6 Gy辐射剂量X线照射制备RIHD模型。
2.2 药物血清制备
将30只实验大鼠按随机数字表分为盐酸贝那普利组、当归红芪超滤物组、盐酸贝那普利+当归红芪超滤物组,每组10只。给药前所有大鼠禁食8 h,灌胃给药,连续5 d,每日2次,每日给药量分别为盐酸贝那普利0.9 mg/kg、当归红芪超滤物0.5 g/kg、盐酸贝那普利0.9 mg/kg+当归红芪超滤物0.5 g/kg。大鼠第5日给药后90 min,腹腔注射1%戊巴比妥钠麻醉,腹主动脉取血,静置30 min,4 ℃、3000 r/min离心10 min,分离收集血清,置于-80 ℃冰箱保存。
2.3 分组及干预
将H9C2细胞随机分为空白组(不干预)、阴性对照组(0 Gy X线照射并予生理盐水干预)、模型组(6 Gy X线照射并予生理盐水干预)、盐酸贝那普利组(6 Gy X线照射并予盐酸贝那普利药物血清干预)、当归红芪超滤物组(6 Gy X线照射并予当归红芪超滤物药物血清干预)、盐酸贝那普利+当归红芪超滤物组(联合组,6 Gy X线照射并予盐酸贝那普利药物血清+当归红芪超滤物药物血清干预)。均为单次给药,给药体积为0.5 mL,给药时间为成模后,检测时间为干预后48 h。
2.4 H9C2细胞培养
超净工作台紫外灯照射30 min,取新鲜培养基和血清,37 ℃水浴加热,75%酒精擦拭并移至无菌操作台;取-150 ℃冻存的H9C2细胞,将其迅速置于37 ℃水浴中快速解冻,1000 r/min离心5 min,再用75%酒精擦拭,移至无菌操作台;弃上清,加入新鲜培养基,置于37 ℃、5%CO2培养箱内培养,次日观察并更换培养基,2~3 d传代1次。
2.5 ELISA检测肌钙蛋白T、肌钙蛋白Ⅰ及C-反应蛋白含量
于96孔酶标板内严格按照cTnT、cTnⅠ及CRP ELISA试剂盒说明书进行操作。加入待测样品10 μL,37 ℃孵育30 min,洗涤5次;滴加酶标抗体50 μL,37 ℃孵育30 min,洗涤5次;每孔加显色液A 50 μL,再加显色液B 50 μL,37 ℃避光显色10 min,最后加入终止反应液50 μL;于酶标仪450 nm波长处测量各孔OD值,计算标准曲线的回归方程,求得样品浓度。
2.6 RT-PCR检测肿瘤坏死因子-α和肿瘤坏死因子相关蛋白9 mRNA的表达
根据RNA试剂盒说明书提取心肌细胞总RNA,配制反转录体系;反转录程序:25 ℃、5 min,42 ℃、60 min,70 ℃、10 min,4 ℃保存。引物序列见表1。

表1 各基因PCR引物序列
2.7 Western blot检测肿瘤坏死因子-α和肿瘤坏死因子相关蛋白9的表达
取细胞中蛋白,BCA试剂盒对蛋白进行定量,取30 μg蛋白样品进行SDS-PAGE电泳,电转膜1 h至PVDF膜,37 ℃、5%脱脂奶粉封闭1 h,4 ℃孵育TNF-α、CTRP9、GAPDH(均1 1000∶ )一抗过夜,次日加入二抗(1∶ 1 0 000),37 ℃孵育1 h。ECL显影,Quantity One软件对蛋白灰度值进行分析。
2.8 免疫荧光检测转化生长因子-β和α-平滑肌肌动蛋白的表达
取对数生长期H9C2细胞,以1.5×105个细胞/孔置于6孔板进行细胞爬片,待细胞贴壁后,PBS洗涤;4%多聚甲醛固定15 min,PBS洗3次×5 min;0.25%Triton X-100进行透膜,2%牛血清白蛋白(1×TBST溶液配制)封闭30 min,4 ℃孵育稀释的一抗(1 200∶ )过夜;加稀释的荧光二抗工作液(1 500∶ )室温避光孵育2 h,PBS洗3次×5 min,DAPI室温孵育15 min,PBS洗3次×5 min,抗荧光淬灭剂封片,激光共聚焦显微镜观察,拍照分析。
3 统计学方法
采用SPSS24.0统计软件进行分析。计量资料以±s表示,多组间比较用方差分析,两两比较用LSD检验。P<0.05表示差异有统计学意义。
4 结果
4.1 ELISA检测结果
与空白组比较,阴性对照组H9C2细胞cTnT、cTnⅠ及CRP含量无明显变化(P>0.05),模型组H9C2细胞cTnT、cTnⅠ及CRP含量显著增加(P<0.01);与模型组比较,盐酸贝那普利组、当归红芪超滤物组和联合组H9C2细胞cTnT、cTnⅠ及CRP含量明显减少(P<0.05)。见表2。
表2 各组H9C2细胞cTnT、cTnⅠ及CRP表达比较(±s)

表2 各组H9C2细胞cTnT、cTnⅠ及CRP表达比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05
组别 n cTnT/(ng/L) cTn /Ⅰ(ng/L) CRP/(μmol/L)空白组 6 10.97± 1.86 7.51±3.05 2.67±0.73 阴性对照组 6 11.56± 2.17 6.08±2.31 3.92±0.80 模型组 6 89.23±14.79## 28.17±8.79## 35.98±4.37## 盐酸贝那普利组 6 34.28± 8.02* 13.06±3.11* 15.35±2.53* 当归红芪超滤物组 6 39.43±10.29* 15.84±3.75* 18.21±3.82* 联合组 6 26.76± 9.69* 10.04±2.52* 10.97±2.16*
4.2 RT-PCR检测结果
与空白组比较,阴性对照组H9C2细胞TNF-α和CTRP9基因表达无明显变化(P>0.05),模型组H9C2细胞TNF-α和CTRP9基因表达显著上调(P<0.01);与模型组比较,盐酸贝那普利组、当归红芪超滤物组、联合组H9C2细胞TNF-α和CTRP9基因表达明显下调(P<0.05)。见表3。
表3 各组H9C2细胞TNF-α和CTRP9 mRNA表达比较(±s)

表3 各组H9C2细胞TNF-α和CTRP9 mRNA表达比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05
组别 n TNF-α CTRP9 空白组 6 1.08±0.19 1.63±0.26 阴性对照组 6 1.13±0.12 1.59±0.22 模型组 6 2.25±0.30## 2.47±0.54## 盐酸贝那普利组 6 1.39±0.27* 1.43±0.22* 当归红芪超滤物组 6 1.44±0.18* 1.78±0.27* 联合组 6 1.16±0.21* 1.09±0.38*
4.3 Western blot检测结果
与空白组比较,阴性对照组H9C2细胞TNF-α和CTRP9蛋白表达无明显变化(P>0.05),模型组H9C2细胞TNF-α和CTRP9蛋白表达明显上调(P<0.01);与模型组比较,盐酸贝那普利组、当归红芪超滤物组、联合组H9C2细胞TNF-α和CTRP9蛋白表达明显下调(P<0.05)。见图1、表4。

图1 各组H9C2细胞TNF-α和CTRP9蛋白免疫印迹图
表4 各组H9C2细胞TNF-α和CTRP9蛋白表达比较(±s)
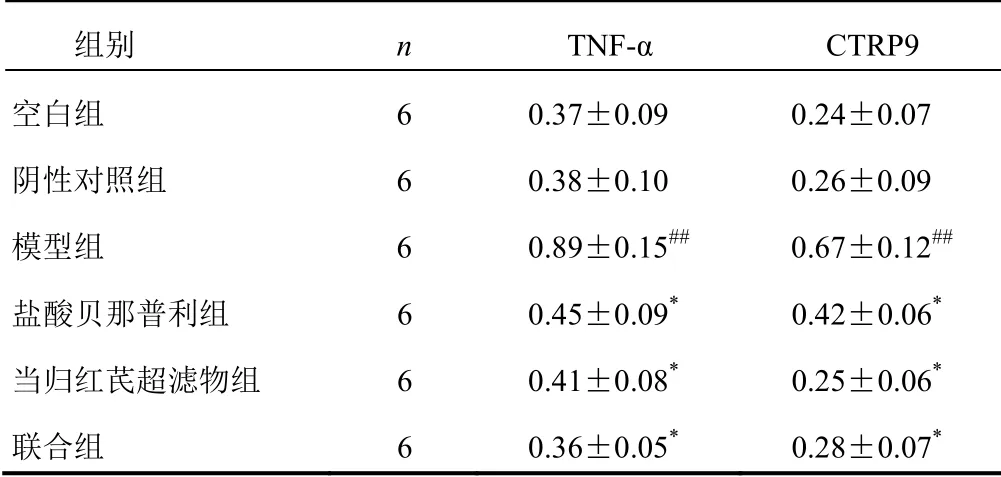
表4 各组H9C2细胞TNF-α和CTRP9蛋白表达比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05
组别 n TNF-α CTRP9 空白组 6 0.37±0.09 0.24±0.07 阴性对照组 6 0.38±0.10 0.26±0.09 模型组 6 0.89±0.15## 0.67±0.12## 盐酸贝那普利组 6 0.45±0.09* 0.42±0.06* 当归红芪超滤物组 6 0.41±0.08* 0.25±0.06* 联合组 6 0.36±0.05* 0.28±0.07*
4.4 免疫荧光检测结果
模型组H9C2细胞α-SMA和TGF-β表达较空白组、阴性对照组显著上调;盐酸贝那普利组、当归红芪超滤物组、联合组α-SMA和TGF-β表达较模型组显著下调。见图2。

图2 各组H9C2细胞α-SMA和TGF-β蛋白阳性表达(免疫荧光染色,×400)
5 讨论
中医学认为,放射性心肌损伤属外感火热邪毒,损伤心气、心血的致病范畴。依据其临床表现心悸、胸闷、胸痛、心律失常及心力衰竭等症状,可归属中医学“心悸”等范畴;其病位在心,主要致病因素为外感火热邪毒,从外侵袭人体,直中脏腑;具有火热之性,易耗津伤液,致气血两虚,心失所养,发为心悸[10]。又《素问•至真要大论篇》有“诸躁狂越,皆属于火”,因此,中医学认为射线是热毒之邪,照射心脏时引起热积血瘀,气阴两伤,久病入络,气血凝滞,导致纤维化发生,通过补益心气、养血活血等治法,可调整心脏功能[10-11]。当归红芪超滤物源自《内外伤辨惑论》当归补血汤,由黄芪和当归按5 1∶ 比例配制而成,具有补气生血、甘温除热功效,主治血虚发热等。
RIHD为心脏受放射性损伤后的迟发应激反应,其主要病理改变为心脏组织弥漫性间质纤维化和胶原沉积,以及由于心肌成纤维细胞积累和内膜增生导致的动脉和小动脉腔狭窄,进而出现一系列心血管并发症[12]。研究表明,X线照射后大鼠心肌组织TNF-α表达明显升高[13],且TNF-α促进心肌纤维化的进展[14]。α-SMA和TGF-β1作为心肌成纤维细胞观察指标,可通过刺激心肌成纤维细胞活化,导致活化的心肌成纤维细胞分泌胶原,从而参与心肌纤维化过程[15]。近年有关TNF-α/CTRP9信号通路在心血管系统的研究日益增多。研究表明,CTRP9在血浆中水平极低,其在大鼠心脏组织中高表达,提示心脏局部产生的CTRP9可能参与心脏正常生理功能调控,同时参与心血管疾病的病理生理过程[16];CTRP9可通过AMPK依赖机制和抑制NADPH氧化酶的表达[17],发挥抗心肌缺血再灌注损伤的作用[18-19]。
本研究发现,辐射及给药后,与空白组比较,阴性对照组cTnT、cTnⅠ及CRP含量无明显变化,模型组cTnT、cTnⅠ及CRP含量均显著增加,提示辐射可导致明显心肌细胞损伤;Western blot和RT-PCR结果显示,模型组TNF-α和CTRP9蛋白及基因表达较空白组、阴性对照组上调,提示TNF-α/CTRP9通路激活,参与了辐射损伤过程;各给药组H9C2细胞TNF-α和CTRP9蛋白及基因表达较模型组下调,提示盐酸贝那普利、当归红芪超滤物通过抑制TNF-α/CTRP9通路激活,参与了辐射损伤后修复;免疫荧光结果显示,与空白组比较,模型组α-SMA和TGF-β表达上调,盐酸贝那普利组、当归红芪超滤物组、联合组α-SMA和TGF-β表达下调,提示当归红芪超滤物、盐酸贝那普利可通过抑制α-SMA和TGF-β表达,减轻心肌损伤及心肌纤维化的发生。
综上,当归红芪超滤物、盐酸贝那普利可通过调控TNF-α/CTRP9信号通路减轻放射性心肌损伤后心肌纤维化的发生,发挥心肌保护作用。本研究揭示了当归红芪超滤物抗辐射致心肌损伤的作用及潜在机制,可为当归红芪超滤物防治RIHD提供依据。

