斜叶黄檀精油脂质体的制备及其抑制黑色素合成的研究
周伟 何云侠 廖良坤 李艳 付调坤 李如一 李积华 阮榕生
摘 要:研究不同濃度斜叶黄檀精油(0、5、10、15、20 mg/L)对制备的脂质体稳定性及其抑制斑马鱼胚胎黑色素合成的影响。通过粒径、多分散系数、Zeta电位、包封率指标来表征斜叶黄檀精油脂质体,评价其在4 ℃下储藏4周的稳定性。结果发现,10 mg/L的斜叶黄檀精油脂质体在储藏过程中最为稳定,包封率达到最大,为45.10%±0.27%。斜叶黄檀精油脂质体可呈浓度依赖式的降低斑马鱼胚胎的酪氨酸酶活性和黑色素含量;20 mg/L的斜叶黄檀精油脂质体对斑马鱼胚胎的酪氨酸酶活性和黑色素含量的抑制作用与30 mg/L的斜叶黄檀精油的效果无显著差异。本研究构建了相对稳定的斜叶黄檀精油脂质体载体,研究了斜叶黄檀精油脂质体的褪黑效果,为斜叶黄檀精油脂质体作为皮肤增白剂的开发和利用提供了理论基础。
关键词:斜叶黄檀精油;脂质体;斑马鱼胚胎;黑色素;酪氨酸酶
中图分类号:S377 文献标识码:A
Preparation of Dalbergia pinnata (Lour.) Prain Essential Oil Piposomes and Its Inhibition on Melanin Synthesis
ZHOU Wei1,2,3, HE Yunxia2, LIAO Liangkun2,3, LI Yan4, FU Tiaokun2,3, LI Ruyi2,3, LI Jihua2,3*, RUAN Roger1
1. State Key Laboratory of Food Science and Technology / College of Food Science & Technology, Nanchang University, Nanchang, Jiangxi 330047, China; 2. Agricultural Products Processing Research Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Tropical Crop Products Processing, Ministry of Agriculture and Rural Affairs, Zhanjiang, Guangdong 524001, China; 3. Hainan Key Laboratory of Storage & Processing of Fruits and Vegetables, Zhanjiang, Guangdong 524001, China; 4. College of Tropical Crops, Yunnan Agricultural University, Puer, Yunnan 665099, China
Abstract: The effect of Dalbergia pinnata (Lour.) Prain essential oil concentrations (0, 5, 10, 15, 20 mg/L) on the stability of prepared liposomes and the inhibition of melanin synthesis in zebrafish embryos was studied. The stability of liposome was evaluated by particle size, PDI, Zeta potential and encapsulation efficiency at 4 ℃ for 4 weeks. The results showed that 10 mg/L liposomes were most stable during storage and the encapsulation efficiency reached the maximum 45.10%±0.27%. D. pinnata (Lour.) Prain essential oil liposome could reduce the tyrosinase activity and melanin content of zebrafish embryos in a concentration-dependent manner. And the inhibition of 20 mg/L D. pinnata (Lour.) Prain essential oil liposome on the tyrosinase activity and melanin content of zebrafish embryos was not significantly different from that of 30 mg/L D. pinnata (Lour.) Prain essential oil. In this paper, a relatively stable carrier of D. pinnata (Lour.) Prain essential oil was constructed, and the anti-melanogenesis effect of D. pinnata (Lour.) Prain essential oil liposome was studied, which would provide a theoretical basis for the development and utilization of D. pinnata (Lour.) Prain essential oil liposome as a skin whitening agent.
Keywords: Dalbergia pinnata (Lour.) Prain essential oil; liposome; zebrafish embryo; melanin; tyrosinase
DOI: 10.3969/j.issn.1000-2561.2021.03.037
斜叶黄檀[Dalbergia pinnata (Lour.) Prain]为豆科黄檀属植物,主产于广西、海南等地,其木质部富含丰富的芳香树脂,是有名的传统香料,与两粤黄檀一起被民间称为“降真香”。斜叶黄檀富含肉桂醛、榄香素等化合物,具有多种生物活性,能起到镇痛、消炎、止血的作用[1]。斜叶黄檀精油[Dalbergia pinnata (Lour.) Prain essential oil]是由斜叶黄檀经过萃取提炼而得,是其精华所在,亦可称作降真香精油[2]。研究表明,斜叶黄檀精油具有褪黑、抗菌、抗氧化等功效[3]。但斜葉黄檀精油与其他植物精油类似,是一种油状液体,具有易挥发,难溶于水,对温度、紫外线敏感,暴露在空气中易分解等缺点[4],因此选择一种合适的载体技术包埋精油十分必要。脂质体(liposomes)是磷脂分散在水中形成的一种具有双分子层结构的封闭囊泡,可包裹亲水和亲脂性的药物,对包埋物具有靶向、控释和保护等作用,逐渐被广泛应用于化妆品、食品、农业与医药等领域中[5]。通过脂质体包埋可提高精油在水中的溶解性,保护其活性物质,防止其在运输过程中被酶和免疫系统破坏,并提高其稳定性[6];还具有缓释作用,延长被包埋物的杀菌作用[7-8],并提高精油的生物利用度[9-10]。
黑色素的合成是生物体内重要的新陈代谢,在其合成的过程中酪氨酸酶起到关键作用,酪氨酸酶的异常表达会引起皮肤色素沉着[11]。因此,可通过拮抗酪氨酸酶的催化活性或生物合成来有效地抑制黑色素生成。基于前期课题组对斜叶黄檀精油抑制黑色素生成的活性研究[3],本文采用乙醇注入法制备不同浓度的斜叶黄檀精油脂质体,测定其粒径、电位、包封率以及储藏稳定性,选出构建较稳定斜叶黄檀精油脂质体的浓度;采用斑马鱼作为模型生物,通过观察其形态及测定酪氨酸酶活性和黑色素含量,探究斜叶黄檀精油脂质体在斑马鱼模型中对黑色素生成的抑制活性。
1 材料与方法
1.1 材料
斜叶黄檀精油:由海南天香文化有限公司提供(海口),磷脂S75(大豆卵磷脂含的磷脂酰胆碱71%和磷脂酰乙醇胺10%):德国Lipoid公司产品;胆固醇、吐温80均采购于索莱宝科技有限公司;氢氧化钠、无水乙醇为分析纯:国药集团化学试剂有限公司产品;3,4-二羟基苯丙氨酸(L-DOPA)购于Sigma公司。
1.2 方法
1.2.1 斜叶黄檀精油脂质体的制备 采用乙醇注入法制备斜叶黄檀精油脂质体[12],准确称取磷脂S75:0.5 g,胆固醇:0.1 g,吐温80:0.128 g,斜叶黄檀精油:0、5、10、15、20 mg/L溶于15 mL乙醇溶液中。取50 mL蒸馏水,50 ℃预热,将乙醇混合溶液逐滴加入到持续搅拌的蒸馏水中,置于旋转蒸发仪中在45~50 ℃下减压蒸发除去乙醇后定容到50 mL,放入超声波清洗器中超声20 min,即得到斜叶黄檀精油脂质体,未添加斜叶黄檀精油为空白脂质体。
1.2.2 粒径、Zeta电位及PDI测定 精油脂质体和空白脂质体用去离子水稀释10倍,采用马尔文Zetaszier Nano-ZS测定平均粒径、多分散系数(polydispersity index,PDI)以及Zeta电位,样品测定前于25 ℃下平衡2 min。
1.2.3 斜叶黄檀精油脂质体包封率的测定 参考Peng等[13]的测定方法并稍作修改,将1 mL脂质体放入超滤管(分子截留值为100 kDa;Millipore, UK),并用蒸馏水稀释,然后将脂质体样品以2000 r/min离心10 min(分离脂质体和游离的斜叶黄檀精油),通过UV-Vis光谱法(UV 178,日本Shimadzu公司)测定吸光度并利用标准曲线确定未包埋的斜叶黄檀精油浓度。最后通过以下公式计算包封率:包封率=(Wt-Wf)/Wt×100%,其中,Wt为加入的斜叶黄檀精油的含量(mg),Wf为游离的斜叶黄檀精油含量(mg)。
1.2.4 斜叶黄檀精油脂质体的储藏稳定性 将斜叶黄檀精油脂质体样品(上述1.2.1制备)于4 ℃下储藏4周,每隔1周分别测定其粒径、Zeta电位、PDI、包封率等指标。
1.2.5 斑马鱼胚胎试验 (1)斑马鱼胚胎繁殖及采集。将野生AB型斑马鱼(由广东医科大学附属医院的斑马鱼平台提供)在实验室循环水产养殖系统中饲养。饲养条件为:室内保持14 h(亮)/10 h(暗)光照控制,室温26 ℃,水温28 ℃。通过自然产卵获得胚胎,傍晚时将成年斑马鱼按雌雄比1∶1放入孵化盒中,雌雄用隔板分开,次日抽掉隔板,2 h后进行鱼卵采集,选取发育正常的胚胎进行试验。
(2)斑马鱼胚胎暴露实验。为了观察在不同浓度脂质体处理下斑马鱼体内黑色素生成情况,将收集的胚胎放入含有胚胎水的6孔板中,于28 ℃的恒温培养箱中培养。24 hpf,将斑马鱼胚胎分别转移到含斜叶黄檀精油(30 mg/L),脂质体(0、5、10、15、20 mg/L)的新鲜胚胎水中。48 hpf,使用倒置荧光显微镜观察到不同的黑色素抑制剂对斑马鱼色素沉着的影响[14],并拍照记录。
(3)斑马鱼胚胎中酪氨酸酶活性的测定。分别收集不同浓度药物处理24 h的幼鱼,将30个胚胎放入装有300 μL冷裂解液缓冲液的EP管中,然后在冰浴条件下超声处理35 s(超声探头2 mm,超声5 s,间断10 s),之后在4 ℃下以10000 r/min离心15 min。取20 μL粗酶加入到含有180 μL L-DOPA的96板孔中,在37 ℃的黑暗处孵育30 min后,于475 nm下测量吸光度[15]。空白对照组的酪氨酸酶相对活性表示为100%,样品的酪氨酸酶活性表示为与对照组相比的百分数。每一样品浓度设3个复孔,取平均值。
(4)斑马鱼胚胎中黑色素含量的测定。将前述“(3)”中离心获得的沉淀物溶于300 μL NaOH(1 mol/L)中,将EP管口用封口膜封好,95 ℃干浴30 min,用酶标仪在405 nm下测量吸光度。相对黑色素含量表示为:样品组OD405/空白对照组OD405× 100%。
1.3 数据处理
每组实验至少3组平行,实验结果用平均值±标准差表示,应用SPSS 22.0软件对数据进行分析,采用t检验。
2 结果与分析
2.1 斜叶黄檀精油脂质体的制备及表征
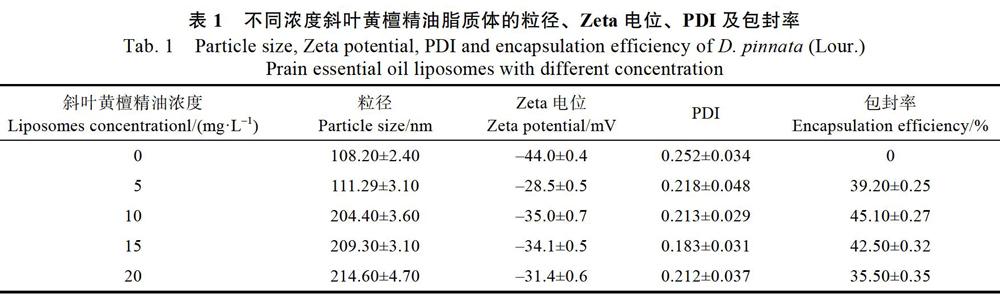
通过测定粒径、Zeta电位、PDI及包封率对所制备的不同浓度斜叶黄檀精油脂质体进行表征结果见表1。由表1可见,随着斜叶黄檀精油的浓度不断增大,其粒径不断增加,这可能是由于脂质体包裹了更多的精油,从而引起其粒径增加。Cui等[16]研究发现随着包埋的丁香精油的浓度不断增加,脂质体的粒径也逐渐增加。空白脂质体Zeta电位约为?44.0 mV,而斜叶黄檀精油脂质体的Zeta电位的绝对值均小于空白脂质体的,Zeta电位的差异可能是由于斜叶黄檀精油插入到脂质膜中造成的。因为在脂质体囊泡形成过程中,囊泡的稳定性和磷脂的分布受到磷脂磷酸端大小、磷脂亲水端极性及精油在膜内的堆积等因素的影响[17]。斜叶黄檀精油的添加降低了脂质体Zeta电位的绝对值,从而可能会影响脂质体的稳定性[18]。PDI即多分散系数,可表示脂质体颗粒的均一程度。PDI越大,表明脂质体直径分布越宽,越不均匀;PDI越小,脂质体直径分布越集中、均匀。PDI数值在0~0.3范围内,表明体系具有均匀的分散性[19]。而制备的斜叶黄檀脂质体PDI均在0.2左右,说明其分散性良好。当精油浓度小于10 mg/L时,脂质体包封率会随着精油浓度的升高而增大,当精油浓度增至10 mg/L时,脂质体包封率达到最大值,为45.10%±0.27%;然而精油浓度持續增加时,脂质体包封率逐渐下降。这可能是由于斜叶黄檀精油浓度进一步升高,一定量的磷脂形成的脂质体对斜叶黄檀精油的包封能力是有限的,这一能力主要与包封物质的性质有关,当斜叶黄檀精油过多,超过脂质膜的饱和度,包封率反而会下降[17]。
2.2 斜叶黄檀精油脂质体的稳定性评价
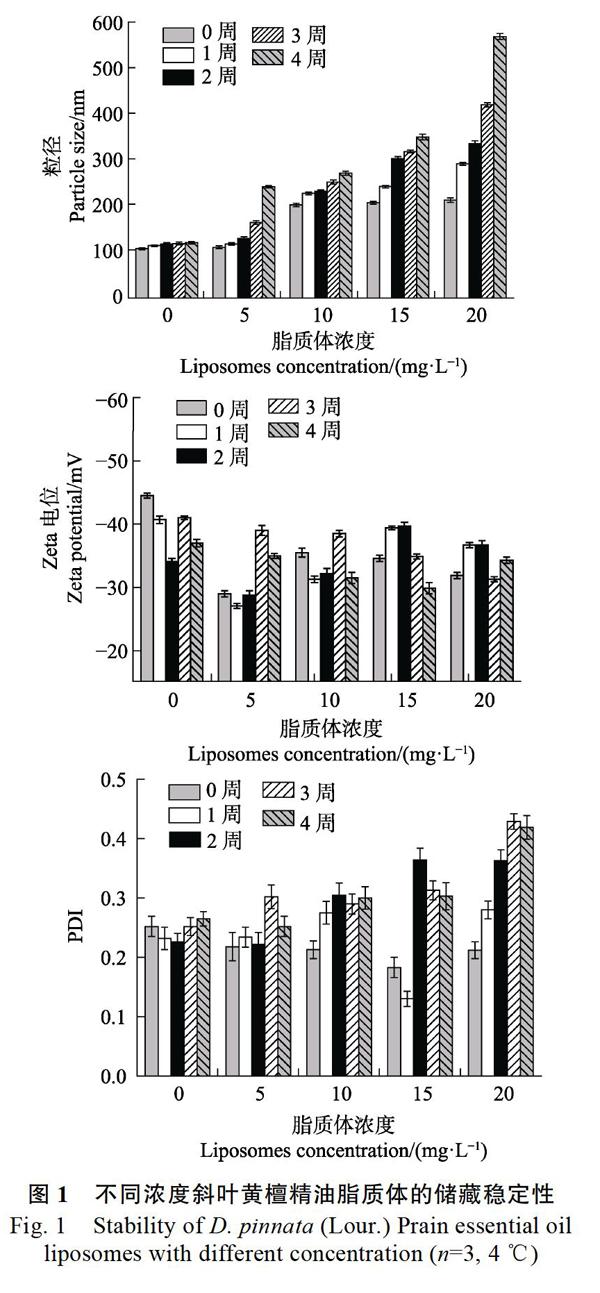
将脂质体在4 ℃下储藏4周,通过测定粒径、PDI和Zeta电位指标来考察斜叶黄檀精油脂质体的储藏稳定性。从图1可见,随着储藏时间的延长,斜叶黄檀精油脂质体的粒径呈现出不断增加的趋势。尤其是浓度为20 mg/L的脂质体增幅最为明显,储藏4周后粒径由原来的214.6 nm增加至573.8 nm;而10 mg/L的脂质体粒径增幅最小,由原来的204.4 nm增加至273.9 nm。Zeta电位是表征胶体分散系稳定性的重要指标,Zeta电位绝对值越大,体系越稳定,即溶解或分散可以抵抗聚集[20]。保存4周后,斜叶黄檀精油脂质体均保持负电荷,Zeta电位的绝对值在30~40 mV左右,表明其均相对稳定。10 mg/L的斜叶黄檀精油制备的脂质体的粒径变化幅度最小,电位的绝对值约为30~40 mV,无显著变化,PDI约为0.2~0.3,说明所制备的脂质体的体系在储藏过程中具有良好的稳定性。
2.3 斜叶黄檀精油脂质体对黑色素合成的影响
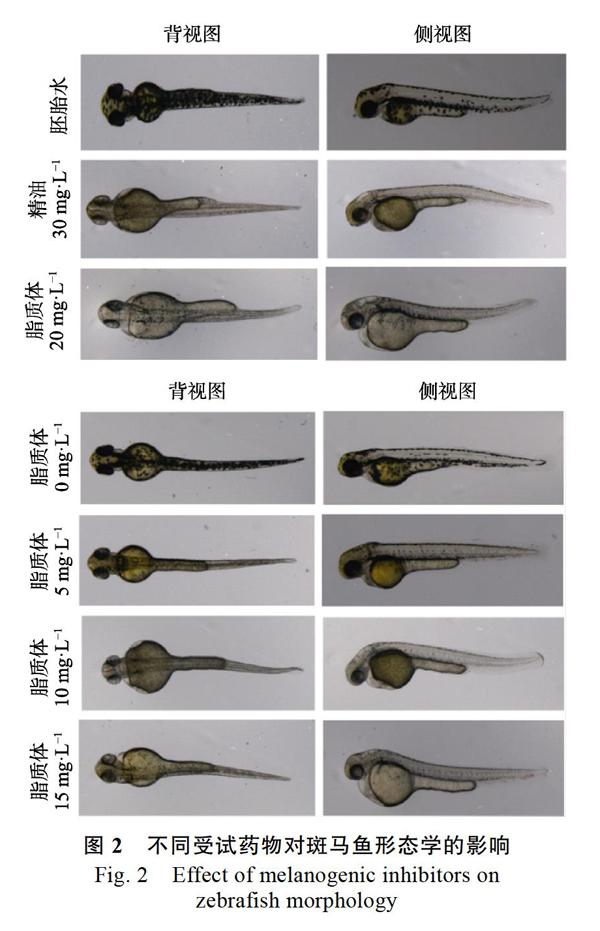
2.3.1 斜叶黄檀精油脂质体对斑马鱼黑色素细胞的形态学影响 将24 hpf的斑马鱼胚胎经过斜叶黄檀精油(30 mg/L)及斜叶黄檀精油脂质体(0、5、10、15、20 mg/L)处理24 h,结果见图2。空白对照组中,在斑马鱼胚胎的脊柱,眼睛和卵黄囊的上下两侧可明显观察到大量的黑点,这是沉积在斑马鱼胚胎中的黑色素。与对照组相比,用斜叶黄檀精油脂质体处理24 h的斑马鱼胚胎的黑色素生长都有不同程度的减少,且随着脂质体中斜叶黄檀的含量不断增加,其黑色素的总量是逐渐减少的。尤其是用20 mg/L的斜叶黄檀精油脂质体处理的斑马鱼,其黑色素明显减少,没有明显的黑色素沉着点。同时可以看出,用30 mg/L的斜叶黄檀精油处理的斑马鱼,无论从背面还是侧面观察,黑色素含量明显下降,且其黑色素沉着与20 mg/L的斜叶黄檀精油脂质体样品处理的斑马鱼差别不大。
2.3.2 精油脂质体对斑马鱼胚胎酪氨酸酶活性和相对黑色素含量的影响 斜叶黄檀精油脂质体对斑马鱼黑色素细胞酪氨酸酶活性具有抑制作用,随着脂质体中斜叶黄檀精油浓度的不断增加,酪氨酸酶的活性逐渐降低,与空白对照组相比,当浓度为0 mg/L时,差异不显著;5~20 mg/L处理组酪氨酸酶的活性均被显著抑制(图3A)。与空白对照组相比,当脂质体浓度为5~20 mg/L时,均显著抑制了斑马鱼的黑色素生成,且作用呈浓度依赖性,当浓度为20 mg/L时,其抑制作用最强(图3B)。同时可以看出,用20 mg/L的精油脂质体所处理的斑马鱼黑色素含量与用30 mg/L的精油处理的斑马鱼无显著差异,说明经脂质体包裹后的斜叶黄檀精油抑制黑色素合成的效果显著增强。
3 讨论
脂质体是通过磷脂和胆固醇在水性介质中的自组装形成的具有封闭双层结构的球形囊泡,其具有生物相容性,可生物降解,非免疫原性且无毒。采用脂质体包裹斜叶黄檀精油,可有效改善其溶解度和化学稳定性,从而提高其生物利用性[21]。
本研究利用脂质体对斜叶黄檀精油进行包埋,以提高其理化稳定性和精油的生物利用率。通过对粒径、电位、PDI、包封率等指标的考察,发现当脂质体包埋的斜叶黄檀精油浓度为10 mg/L时,制备的脂质体平均粒径为(204.4±3.6)nm,Zeta电位为(?35.0±0.7)mV,PDI为0.213±0.029,包封率达到最大值45.10%±0.27%,各项指标较为理想。经过4周的稳定性实验表明,10 mg/L脂质体的粒径变化幅度最小,Zeta电位和PDI均无显著性变化,说明所制备的脂质体的体系相对比较稳定。赵呈婷等[22]采用波薄膜-超声分散法制备了丁香精油脂质体,通过研究发现当丁香精油浓度为5 mg/mL时,其稳定性最好。通过原子力显微镜观察发现丁香精油脂质体的颗粒分散均匀、无明显聚集现象,而且丁香精油脂质体具有长效杀菌作用。
斑马鱼因全身条纹似斑马而得名,属于辐鳍亚纲鲤科短担尼鱼属。斑马鱼拥有与人类相似的黑素细胞和黑素体,因周身透明,色素细胞在个体发育过程中易被识别、观察,而且斑马鱼属低温低氧鱼,饲养容易,产卵量大,具有较强的耐寒性和耐热性,因此在黑素细胞相关研究中有不可替代的作用[23-24]。因此,本研究以斑马鱼为动物模型,以L-DOPA为底物,测定斜叶黄檀精油脂质体对酪氨酸酶活性和黑色素合成的影响。结果表明,斜叶黄檀精油脂质体可显著抑制斑马鱼胚胎的酪氨酸酶活性以及黑色素的沉着,且20 mg/L的斜叶黄檀精油脂质体对斑马鱼胚胎的酪氨酸酶活性和黑色素含量的抑制作用与30 mg/L的斜叶黄檀精油的效果无显著差异。本研究为制备更加稳定且更好生理活性的斜叶黄檀精油载体剂型提供了理论指导,对其在制药和化妆品工业中用作皮肤增白剂提供了一个新的选择。
参考文献
[1] 廖良坤, 张苏慧, 周 伟, 等. 斜叶黄檀精油功能活性[J]. 食品工业科技, 2018, 39(19): 45-51.
[2] 张苏慧, 廖良坤, 魏晓奕, 等. 超临界CO2萃取斜叶黄檀精油工艺优化及精油成分分析[J]. 热带作物学报, 2018, 39(4): 791-794.
[3] Zhou W, He Y X, Lei X L, et al. Chemical composition and evaluation of antioxidant activities, antimicrobial, and anti-melanogenesis effect of the essential oils extracted from Dalbergia pinnata (Lour.) Prain[J]. Journal of Ethnopharmacology, 2020, 254: 112731.
[4] Cui H Y, Li W, Li C Z, et al. Intelligent release of cinnamon oil from engineered proteoliposome via stimulation of Bacillus cereus protease[J]. Food Control, 2016, 67: 68-74.
[5] Riham Gharib, Hélène Greige-Gerges, Sophie Fourmentin, et al. Liposomes incorporating cyclodextrin–drug inclusion complexes: Current state of knowledge[J]. Carbohydrate Polymers, 2015, 129: 175-186.
[6] Hammoud Zahraa, Gharib Riham, Fourmentin Sophie, et al. New findings on the incorporation of essential oil components into liposomes composed of lipoid S100 and cholesterol[J]. International Journal of Pharmaceutics, 2019, 561: 161-170.
[7] 樂文慧, 黄早成, 肖苏尧, 等. 白藜芦醇固体脂质体制备工艺研究[J]. 食品科学, 2010, 31(18): 59-62.
[8] Lin L, Zhang X, Zhao C, et al. Liposome containing nutmeg oil as the targeted preservative against Listeria monocyto-genes in dumplings[J]. Rsc Adv, 2016, 6(2): 978-986.
[9] 陶 紫. 香茅草精油微乳体系的构建及其抗氧化和抗肿瘤细胞活性的研究[D]. 广州: 华南理工大学, 2018.
[10] Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocar-riers for drug delivery[J]. Nature Materials, 2013, 12(11): 991-1003.
[11] Liang Y F, Sun L, Wee Ser, et al. Classification of non-tumorous skin pigmentation disorders using voting based probabilistic linear discriminant analysis[J]. Com-puters in Biology and Medicine, 2018, 99: 123-132.
[12] Sebaaly C, Jraij A, Fessi H, et al. Preparation and characterization of clove essential oil-loaded lipo?somes[J]. Food Chemistry, 2015, 178: 52-62.
[13] Peng S F, Zou L Q, Liu W, et al. Storage stability and anti-bacterial activity of eugenol nanoliposomes prepared by an ethanol injection-dynamic high-pressure microfluidization method[J]. Journal of Food Protection, 2015, 78(1): 22-30.
[14] Taylor K L, Lister J A, Zeng Z Q, et al. Differentiated melanocyte cell division occurs in vivo and is promoted by mutations in Mitf[J]. Development, 2011, 138(16): 3579- 3589.
[15] Chen Y M, Su W C, Li C, et al. Anti-melanogenesis of novel kojic acid derivatives in B16F10 cells and zebrafish[J]. In?ternational Journal of Biological Macromolecules, 2019, 123: 723-731.
[16] Cui H Y, Zhao C T, Lin L. The specific antibacterial activity of liposome-encapsulated clove oil and its application in tofu[J]. Food Control, 2015, 56: 128-134.
[17] 葛 彥. 茶树精油脂质体/壳聚糖缓释抗菌材料的制备及性能研究[D]. 无锡: 江南大学, 2015.
[18] 周 伟, 刘玮琳, 刘 伟, 等. 不同因素对中链脂肪酸脂质体Zeta电位的影响[J]. 食品科学, 2012, 33(19): 128-132.
[19] Wannes W A, Mhamdi B, Sriti J, et al. Antioxidant activities of the essential oils and methanol extracts from myrtle (Myrtus communis var. italica L.) leaf, stem and flower[J]. Food and Chemical Toxicology, 2010, 48(5): 1362-1370.
[20] Zhong Y, Wang J, Wang Y, et al. Preparation and evaluation of liposome-encapsulated codrug LMX[J]. International Journal of Pharmaceutics, 2012, 438(1-2): 240-248.
[21] Detoni C B, de Oliveira D M, Santo I E, et al. Evaluation of thermal-oxidative stability and antiglioma activity of Zanthoxylum tingoassuiba essential oil entrapped into multi- and unilamellar liposomes[J]. J Liposome Res, 2012, 22(1): 1-7.
[22] 赵呈婷. 刺激响应型丁香精油脂质体对金黄色葡萄球菌的抑制作用及其在豆制品中的应用研究[D]. 镇江:江苏大学, 2016.
[23] 王天晶, 罗光浦, 刘子君, 等. 菟丝子水提物对黑色素合成的影响[J]. 皮肤科学通报, 2017, 34(6): 679-683.
[24] 陆 彬, 楼鸳鸯, 陈楚楚, 等. 熊果苷抑制斑马鱼胚胎黑色素合成的研究[J]. 湖南科技大学学报(自然科学版), 2015, 30(1): 116-120.
责任编辑:沈德发
收稿日期 2020-04-21;修回日期 2020-05-21
基金项目 海南省自然科学基金项目(No. 220RC701);中国热带农业科学院基本科研业务费专项(No. 1630122017017);以农业领域为单元的广东省现代农业产业共性关键技术研发创新团队建设项目(No. 2019KJ117)。
作者简介 周 伟(1987—),男,博士研究生,副研究员,研究方向:热带食品加工与贮藏。*通信作者(Corresponding author):李积华(LI Jihua),E-mail:foodpaper@126.com。

