人用狂犬病疫苗原代地鼠肾细胞蛋白质国家对照品的建立
石磊泰,李加,张月兰,王辉,雷继军,郭中平,李玉华
1.中国食品药品检定研究院,北京102629;2.北京生物制品研究所有限责任公司,北京100176;3.武汉生物制品研究所有限责任公司,湖北 武汉430070;4.国家药典委员会,北京100061
从1965年武汉生物制品研究所和兰州生物制品研究所联合中国药品生物制品检定所用北京株狂犬病病毒固定毒株,在原代地鼠肾细胞适应传代,研制成功原代地鼠肾细胞培养的人用狂犬病灭活疫苗,至今为止,在我国已有50多年的使用历史[1-3]。目前该类疫苗仍在市场流通,为我国狂犬病的预防做出了卓越的贡献。狂犬病是致死性疾病,全世界每年因其死亡约59 000人[4],我国近年的狂犬病疫情虽有所缓解,但情况仍不容乐观。我国人用狂犬病疫苗市场需求量较大,2015—2019年连续5年人用狂犬病疫苗(地鼠肾细胞)的批签发量就分别达到了80万、80万、100万、120万和63万人份[5]。狂犬病疫苗接种无禁忌症,受种群体广泛,因此其有效性和安全性就显得尤为重要,而就安全性而言,疫苗中的杂质控制值得关注。
宿主蛋白作为来源于细胞基质的一类异源成分,可能诱导机体产生未知的免疫应答而影响疫苗的功效,也可能引起超敏反应或其他不良反应,有必要进行有效控制。虽然WHO的技术指导原则中未对宿主蛋白残留量作出含量限定[6-7],但我国药品监管机构早在《中国药典》三部(2010版)中就明确了地鼠肾细胞蛋白质残留量的限量标准[8],并建立了有效的检测方法[9-10],在人用狂犬病疫苗(地鼠肾细胞)的质量控制中发挥了技术支撑和监管的作用。
在不改变现有检测方法的前提下,我们优化了检测体系,研制出原代地鼠肾细胞蛋白质国家标准品[11],替换试剂盒自带标准品,确保了检定结果的科学性和准确性。为了配合原代地鼠肾细胞蛋白质国家标准品的合理、有效使用,有必要建立原代地鼠肾细胞蛋白质国家对照品,以保证检验检测体系的准确、可靠。本研究采用ELISA法,用原代地鼠肾细胞蛋白质标准品(量值为4.0μg/mL)对原代地鼠肾细胞蛋白质对照品进行协作标定赋值,并进行均匀性和稳定性分析。
1 材料与方法
1.1 协作标定样品 原代地鼠肾细胞蛋白质标准品,批号为:250024-201901,经中国食品药品检定研究院标准化委员会批准使用,量值为4.0μg/mL,冻干剂型,95%可信限为:(4.0±0.5)μg/mL,6支/实验室;待标定原代地鼠肾细胞蛋白质对照品,冻干剂型,6支/实验室。
1.2 协作标定方案 由中国食品药品检定研究院设计协作标定方案并发放协作标定作业指导书,各实验室使用统一的标准操作规范和统一的实验记录,采用原代地鼠肾细胞蛋白质残留量ELISA检测试剂盒[由北京生物制品研究所有限责任公司(原天坛生物)提供,批号为:20190414和20190415],用原代地鼠肾细胞蛋白质标准品绘制标准曲线(6.25~200 ng/mL),计算原代地鼠肾细胞蛋白质对照品含量。
1.3 数据汇总及结果分析 邀请4家实验室进行协作标定,各参与单位每次实验独立检测6次,涉及2个批次试剂盒,每批3个数据,中国食品药品检定研究院汇总各协作单位检测结果,经统计学软件SPSS 20.0分析,计算原代地鼠肾细胞蛋白质对照品的量值。
1.4 对照品均匀性和稳定性分析
1.4.1 均匀性 对于均匀性好的样品,当总体单元数大于500时,抽取单元数不小于15个的要求,该标准品物理检查合格数为2 000支,均匀性检验抽取的数目为16支,采用pH值考察均匀性指标。
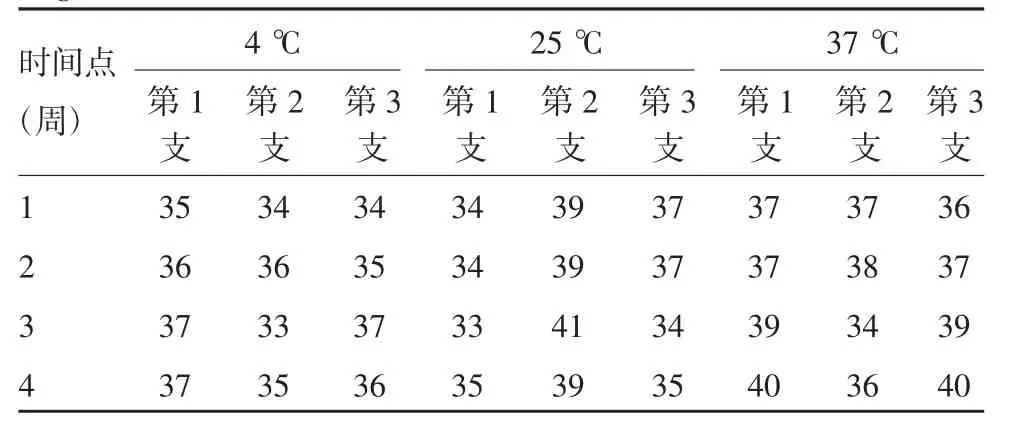
1.4.2 稳定性 将样品分别在4、25和37℃放置不同时间(1、2、3和4周),不同时间点取3支,于-20℃保存。待所有样本放置结束后,采用统一的ELISA方法,将样本用0.5 mL灭菌注射用水复溶,进行抗原含量检测。
2 结果
2.1 原代地鼠肾细胞蛋白质对照品协作标定结果数据统计结果显示,最终原代地鼠肾细胞蛋白质对照品量值为34.7 ng/mL;95%参考范围按95%可信限公式(x±1.96S)计算,其中x=34.7 ng/mL,S=5.2,得出95%参考范围为:(34.7±10.1)ng/mL。见表1。
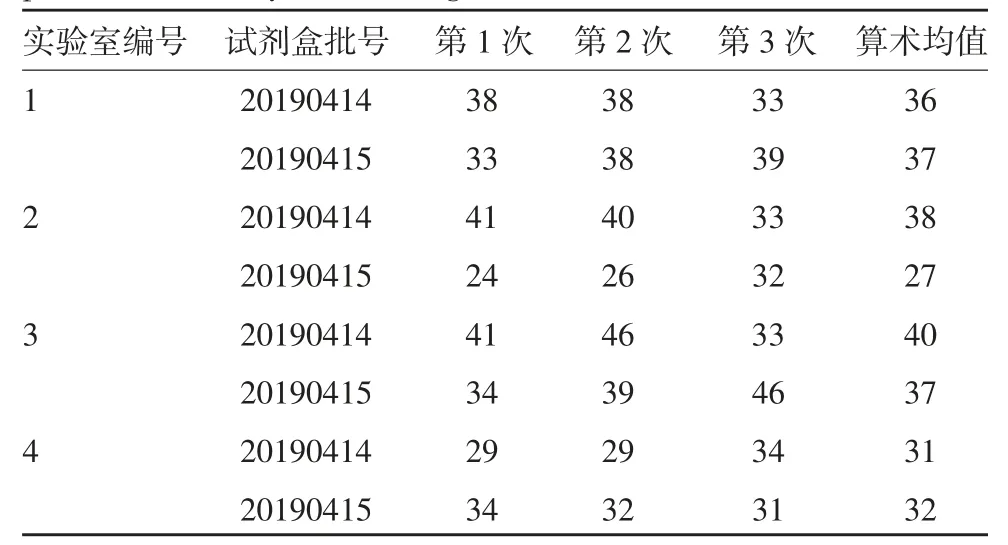
表1 ELISA法对原代地鼠肾细胞蛋白质对照品进行协作标定的结果(ng/mL)Tab.1 Collaborative calibration of primary hamster kidney cell protein control by ELISA(ng/mL)
2.2 原代地鼠肾细胞蛋白质对照品均匀性 检测结果经统计学中的方差分析,根据自由度(15,32)及给定的显著性水平α=0.05,由F表查得临界值F0.05=2.02,经统计学分析得均匀性检验的统计量F=0.50,由此得出F 2.3 原代地鼠肾细胞蛋白质对照品稳定性 检测结果经统计学中的方差分析,根据自由度(3,8)及给定的显著性水平α=0.05,由F表查得临界值F0.05=4.07,经统计学分析可得4℃稳定性检验的统计量F1=0.94,25℃稳定性检验的统计量F2=0.03,37℃稳定性检验的统计量F3=0.59,比较得出F1 表2 原代地鼠肾细胞蛋白质对照品均匀性考察(pH)Tab.2 Uniformity of primary hamster kidney cell protein control(pH) 表3 原代地鼠肾细胞蛋白质对照品稳定性考察(ng/mL)Tab.3 Stability of primary hamster kidney cell protein control(ng/mL) 我国人用狂犬病疫苗(地鼠肾细胞)生产是以原代地鼠肾细胞为细胞基质,经过研发之初后不断的工艺优化,现在比较固定的生产流程是细胞培养、病毒接种、病毒收获液浓缩、灭活、纯化、半成品配制及成品分装等步骤[8]。疫苗成品中主要成分为病毒抗原,此外还有宿主细胞残留蛋白,这些残留蛋白可对人体产生致敏反应,因此宿主蛋白残留量的控制显得尤为重要。 目前我国人用狂犬病疫苗(地鼠肾细胞)蛋白质残留量检测采用ELISA法,限量标准为不高于24μg/剂[8],为了定好标尺、严把质量关,我们研制了原代地鼠肾细胞蛋白质国家标准品[11],为检测实验是否成立,保证检验检测体系的准确、可靠,有必要建立原代地鼠肾细胞蛋白质对照品。 采用已有的检验检测体系,引入北京生物制品研究所有限责任公司(原天坛生物)生产的2个不同批次的ELISA试剂盒进行检测,用原代地鼠肾细胞蛋白质标准品(4.0μg/mL)绘制标准曲线(6.25~200 ng/mL),邀请4个实验室进行协作标定,各参与单位每次实验独立检测,标准品赋值每个实验室提供不少于6个数据(2批试剂盒,每批3个数据),对采集到的24个数据进行统计学分析处理,最终原代地鼠肾细胞蛋白质对照品量值定为34.7 ng/mL,95%参考范围为(34.7±10.1)ng/mL。 标准物质的特性应该是均匀的,即在规定的细分范围内其特性保持不变。为了检验样品是否均匀,通常随机抽取一定数量的最小包装单元,采用精密度高的实验方法,对抽出的各样品在同样的实验条件下进行测定,从而使各样品间的差异完全由样品的不均匀性反映出来。方差分析是用来统计检验均匀性的最常用方法,该方法是通过组间方差和组内方差的比较来判断各组测量值之间有无系统性差异,如果两者的比小于统计检验的临界值,则认为样品是均匀的[12]。用pH值来考察标准品的均匀性,根据自由度(15,32)及给定的显著性水平α=0.05,可由F表查得临界值F0.05=2.02,经统计学分析可得均匀性检验的统计量F=0.50,由此得出F 标准物质的稳定性包括短期稳定性和长期稳定性,长期稳定性是长期监测积累数据。短期稳定性是指在运输条件下标准物质在运输过程中的稳定性,根据制品性质放置不同温度(一般放置4、25、37℃)、不同时间(1、2、3和4周),进行生物学活性测定,以评估其稳定情况[13-14]。根据自由度(3,8)及给定的显著性水平α=0.05,可由F表查得临界值F0.05=4.07,经统计学分析可得4℃稳定性检验的统计量F1=0.94,25℃稳定性检验的统计量F2=0.03,37℃稳定性检验的统计量F3=0.59,比较得出F1 本研究成功建立了人用狂犬病疫苗(地鼠肾细胞)宿主蛋白残留检测(ELISA法)的原代地鼠肾细胞蛋白质对照品(批号为:250025-201901),已经赋值并通过了均匀性和稳定性检验考察,可用于人用狂犬病疫苗(地鼠肾细胞)宿主蛋白检测体系,判断实验是否成立,将对以地鼠肾细胞为基质的人用狂犬病疫苗的质量控制起到重要作用。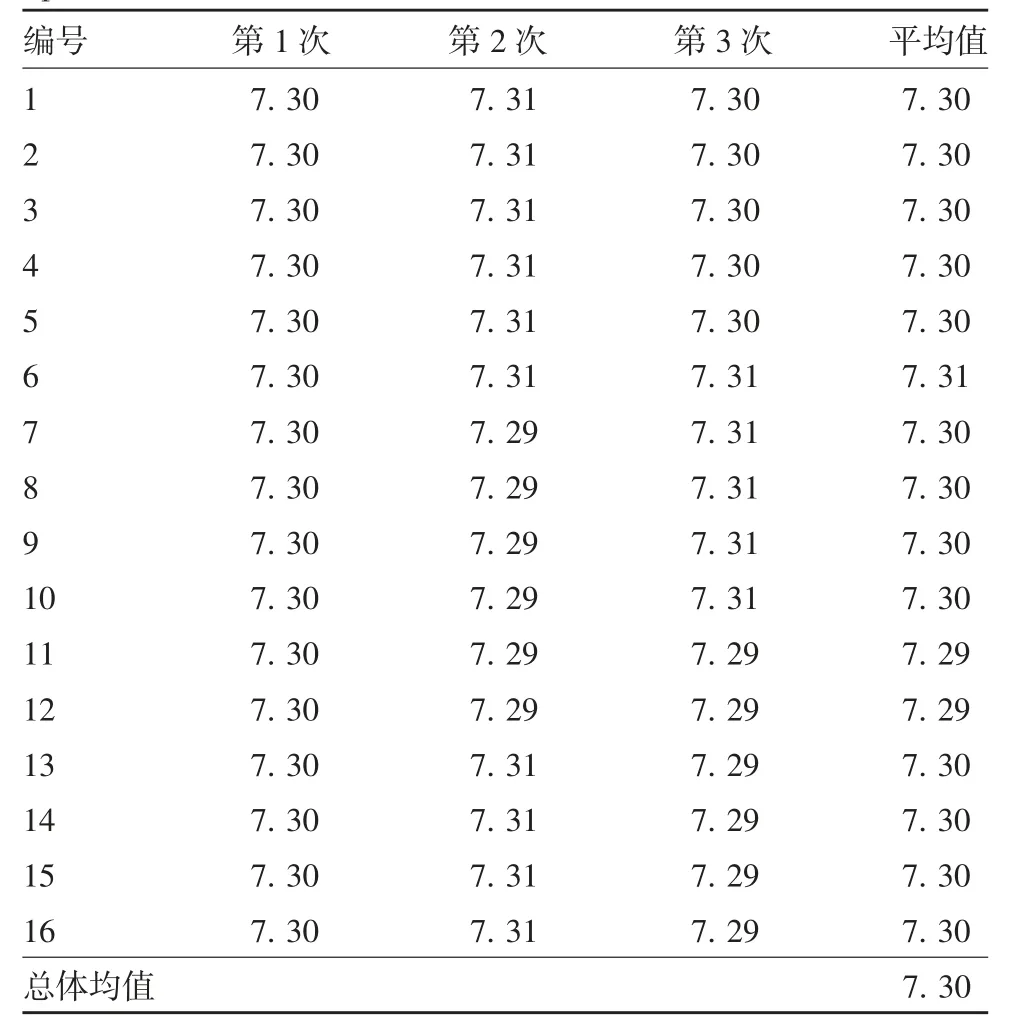
3 讨论

