肉桂精油对小鼠肝肠组织抗氧化能力以及肠道菌群结构的调节作用
肖 瀛,许豪杰,杨昌铭,宋晓秋,周小理
(上海应用技术大学香料香精技术与工程学院,上海 201418)
肉桂又称玉桂,是樟科樟属植物,原产中国,早在春秋时期肉桂就被作为食用香辛料使用[1],15世纪时肉桂更作为重要香辛料存在于世界贸易中,是烘焙食品、肉制品与饮料中最主要的香料之一[2]。肉桂精油作为肉桂的主要提取物,在食品添加剂、调香、医药等领域具有不可替代的优势[3],仅美国可口可乐公司每年就需400 t肉桂精油[4]。
越来越多的证据表明,膳食结构是影响整个肠道菌群组成最重要的因素[5],人类肠道微生物群通过产生非人类基因组编码的酶,提高机体肝脏和肠道黏膜酶的活性[6],对关键膳食成分的分解、吸收和代谢作出重要贡献;因此肠道微生物与人体免疫调节紧密关联,对于维持人体健康具有重要影响[7]。肉桂精油中富含肉桂醛及其他芳香化合物[8],具有体外抑菌(李斯特菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌等食源性微生物)和抗氧化等活性[9-10]。然而,肉桂精油的日常膳食摄入对于肠道菌群的影响鲜有报道。
本研究采用二代测序Illumina MiSeq技术,通过使小鼠摄入不同剂量的肉桂精油,探究肉桂精油对于小鼠肝组织酶活性,肝、十二指肠、结肠组织机体抗氧化能力及肠道菌群构成的调节作用,评价肉桂精油的摄入对于机体健康的潜在影响。
1 材料与方法
1.1 动物、材料与试剂
SPF级C57BL/6健康雄性小鼠24 只,体质量(18±2)g,8 周龄,购自上海灵畅生物科技有限公司。实验动物生产许可证号:SCXK(沪)2018-0003;动物处理及饲养条件遵照动物福利的相关规定及《中华人民共和国实验动物管理条例》和《实验动物质量管理办法》实施。实验饲料为美国AIN-93G标准饲料,购于南通特洛菲饲料科技有限公司;实验所用垫料、饲料经过辐照杀菌处理,饮用水经高压灭菌处理,符合SPF级动物使用标准。
肉桂精油(纯度99%) 西安绿天生物科技有限公司;经气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)鉴定为肉桂醛质量分数58.3%、乙酸肉桂酯质量分数10.5%、丁香酚质量分数2.3%。
吐温-80 上海泰坦科技股份有限公司;肝素钠、无水硫酸钠、无水乙醚、氯化钠、浓硫酸、乙酸、丙酸、丁酸 国药集团化学试剂(上海)有限公司;天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、总胆汁酸(total bile acid,TBA)、总抗氧化能力(total antioxidant capacity,T-AOC)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)检测试剂盒南京建成生物工程研究所有限公司;粪便DNA快速纯化试剂盒(QIAamp DNA Stool Mini Kit) 德国Qiagen公司;荧光定量试剂SYBR Premix ExTaq、DNA纯化试剂盒、D2000 DNA Marker 天根生化科技(北京)有限公司。
1.2 仪器与设备
BIOBASE-EL10A酶标仪 山东博科生物产业有限公司;XMTD-204数显式电热恒温水浴锅 天津市欧诺仪器有限公司;XW-80型混合器 江苏海门其林贝尔仪器有限公司;K280R冷冻离心机 英国森特恩公司;TQ8040 GC-MS仪 日本岛津公司;Miseq PE300高通量测序平台 美国Illumina公司;TGL-16M台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 动物分组及处理
8 周龄小鼠在SPF级动物房内,温度20~25 ℃、相对湿度50%~55%,给予12 h光照/12 h黑暗交替条件,自由饮食、饮水适应1 周。然后随机分为对照(CON)组、肉桂精油低剂量(CIN-L)组、肉桂精油高剂量(CIN-H)组。每组2 笼,每笼8 只。
使用体积分数0.5%吐温-80作为乳化剂混合肉桂精油,CIN-L、CIN-H组小鼠分别灌胃100、300 mg/(kg·d),连续灌胃4 周,对照组每天灌胃等体积0.5%吐温-80,灌胃体积0.2 mL/只。所有小鼠均处于适宜生存环境中,自由进食、饮水。
1.3.2 体质量测定
小鼠自适应期开始至灌胃结束,每天灌胃前观察小鼠状态,每周固定时间称取并记录小鼠体质量。
1.3.3 血浆AST、ALT活力和TBA浓度测定
灌胃结束后,小鼠禁食禁水12 h,次日早晨,称体质量后用无水乙醚麻醉,眼球取血,放入预先准备好经0.1 g/100 mL肝素钠溶液预处理的1.5 mL无菌离心管中,3 000 r/min离心15 min,取上清液于1.5 mL离心管中,-80 ℃冰箱保存,待测。按照试剂盒说明书相关操作进行血浆AST、ALT活力和TBA浓度测定, AST、ALT活力以每毫克蛋白质量计。
1.3.4 十二指肠、结肠、肝组织抗氧化能力及脏器指数的测定
眼球取血完毕后,小鼠颈椎脱臼处死,解剖,取心、肝、脾、肾、结肠、十二指肠6 个脏器和腹脂,称质量。每只小鼠取相同位置肝、十二指肠和结肠组织0.1 g,放入匀浆器中,加入9 倍体积的生理盐水,于冰浴条件下匀浆,制成10 g/100 mL的组织匀浆液。将组织匀浆液于4 ℃、3 500 r/min下离心10 min,取上清液,-80 ℃保存,用于抗氧化能力测定。按照试剂盒说明书操作步骤测定小鼠肝、十二指肠、结肠组织T-AOC,T-SOD、CAT活力和MDA含量,均以蛋白质量计。脏器和腹脂指数均按下式计算。

1.3.5 肠道菌群样本收集
灌胃第4周开始,每日9∶00将小鼠按组转移到干净的铺有无菌滤纸的空鼠笼中,待小鼠排便后立即收集粪便样本装入灭菌的5 mL运输管中,每只小鼠每日收集1 次,每次收集约0.2 g,收集好的粪便样本于-80 ℃冰箱冻存,连续收集3 d。
1.3.6 粪便中DNA提取与菌群测序
按照试剂盒说明书对24 管小鼠粪便样品提取DNA,将DNA样品寄送至上海美吉生物医药科技有限公司,按照V3~V4区域设计引物聚合酶链式反应扩增序列。引物序列为338F:5’-ACTCCTACGGGAGGCAGCAG-3’;806R:5’-GGACTACHVGGGTWTCTAAT-3’。采用Illumina MiSeq PE300平台对小鼠粪便肠道菌群进行高通量测序,获得16S rDNA数据。
1.3.7 粪便中SCFAs的测定
取0.1 g粪便置于2 mL离心管中,加入500 μL饱和NaCl溶液,在冰浴条件下用粉碎机打碎均质至无明显块状,加入20 μL体积分数10% H2SO4进行酸化,漩涡振荡混匀,于通风橱中加入500 μL无水乙醚萃取短链脂肪酸(short chain fatty acids,SCFAs),振荡混匀后14 000 r/min离心15 min,取上清液置于装有0.25 g无水硫酸钠的2 mL离心管中,再以同样条件离心,取上清液于气相瓶中待测。
GC-MS条件:Rtx®-WAX色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;柱温100 ℃;离子源温度220 ℃;接口温度250 ℃;升温程序:100 ℃以7.5 ℃/min的速率升温至140 ℃,保持4 min,再以60 ℃/min升温至200 ℃;样品进样量1 μL;载气He;分流比10∶1;流速2 mL/min;溶剂延迟1.5 min;Q3 Scan方式采集1.5~9.5 min,质量扫描范围m/z20.0~300.0。
将检测到的质谱信息与标准谱图对照,结合检索数据库及各物质碎片离子m/z进行SCFAs定性分析。采用外标法定量,绘制乙酸、丙酸、丁酸标准工作曲线,根据峰面积计算粪便中SCFAs含量。
1.4 数据统计分析
体质量、脏器指数、酶活性、抗氧化指标、SCFAs含量结果以平均值±标准差表示,采用SPSS 22.0软件用Duncan’s方法进行单因素方差分析,P<0.05表示有显著性差异。肠道菌群原始数据通过Usearch平台进行优化处理,按照97%相似性对不含单序列的非重复序列进行操作分类单元(operational taxonomic unit,OTU)聚类,并采用RDP classifier贝叶斯算法进行分类学分析。使用美吉生物云平台(www.majorbio.com)在OTU分类基础上进行多样性分析并采用Student’st检验进行组间差异显著性分析,对多样本群落组成进行可视化分析,使用Wilcoxon秩和检验分析方法进行组间差异显著性检验。
2 结果与分析
2.1 肉桂精油对小鼠体质量和脏器指数的影响

表1 肉桂精油对小鼠体质量和脏器指数的影响Table 1 Effect of cinnamon oil on body mass and visceral organ indexes of mice
本实验灌胃期间各组小鼠饮食、饮水正常,3 组小鼠的体质量与脏器指数变化如表1所示。CIN-L、CIN-H组与CON组相比,小鼠体质量略有降低,但无显著性差异(P>0.05)。与CON组相比,CIN-L、CIN-H组小鼠的心、肝、脾、肾、结肠、十二指肠的脏器指数均无显著性变化(P>0.05),腹脂指数显著降低(P<0.05)。
2.2 肉桂精油对小鼠肝脏代谢相关酶活力的影响
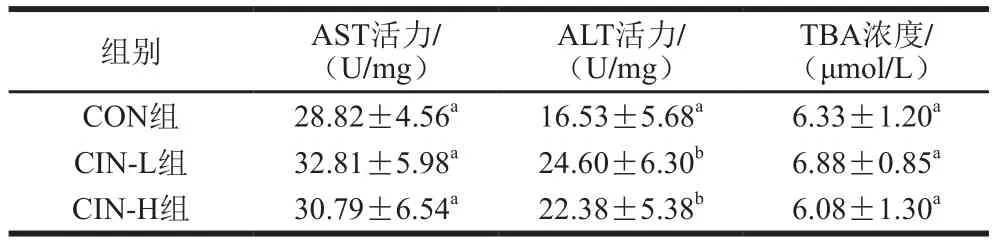
表2 肉桂精油对小鼠血浆肝脏代谢相关酶活力的影响Table 2 Effect of cinnamon oil on liver metabolism-related enzyme activities in mice
AST、ALT为催化体内蛋白质氨基酸转化的酶,在肝脏中含量丰富,AST、ALT活力是肝脏代谢的重要指标,TBA是胆固醇在肝脏分解及肠-肝循环中的代谢产物,与胆固醇的吸收、代谢及调节关系密切。由表2可知,CON、CIN-L、CIN-H组间小鼠血浆AST活力、TBA浓度均无显著差异(P>0.05),而摄入肉桂精油后,与CON组相比,CIN-L、CIN-H组小鼠血浆ALT活力显著提高(P<0.05)。
2.3 肉桂精油对小鼠十二指肠、结肠、肝组织抗氧化水平的影响

表3 肉桂精油对小鼠十二指肠抗氧化指标水平的影响Table 3 Effect of cinnamon oil on antioxidant capacity in duodenum of mice

表4 肉桂精油对小鼠结肠抗氧化水平的影响Table 4 Effect of cinnamon oil on antioxidant capacity in colon of mice

表5 肉桂精油对小鼠肝脏抗氧化水平的影响Table 5 Effect of cinnamon oil on antioxidant capacity in liver of mice
由表3可知,摄入肉桂精油后,在小鼠十二指肠中,与CON组相比,CIN-L、CIN-H组抗氧化活性指标整体上呈现不同程度的下降,其中T-AOC、MDA含量显著降低(P<0.05);这可能是由于肉桂精油的抗氧化代偿作用导致抗氧化酶活力整体下降,同时导致氧化损伤指标MDA含量也降低。由表4可知,摄入肉桂精油后,与CON组相比,CIN-L、CIN-H组小鼠结肠中T-SOD活力、T-AOC、MDA含量有所提高,但变化不显著,CIN-H组CAT活力显著提高(P<0.05)。由表5可知,摄入肉桂精油后,与CON组相比,CIN-L、CIN-H组小鼠肝组织内CAT、T-SOD活力均显著降低(P<0.05),CIN-L组T-AOC降低但变化不显著,CIN-H组T-AOC显著降低(P<0.05),MDA含量随着肉桂精油摄入量的增加而增加,但变化不显著(P>0.05)。以上结果表明,肉桂精油对小鼠肝脏抗氧化活性有一定抑制作用,但对小鼠肠道氧化应激水平有着调控作用。
2.4 肉桂精油对小鼠肠道菌群多样性的影响
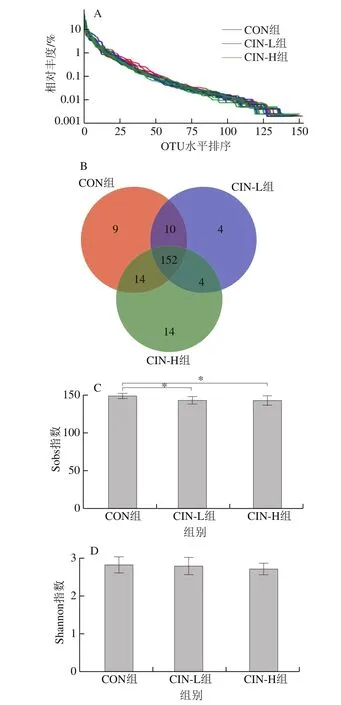
图1 摄入肉桂精油后小鼠肠道菌群多样性的变化Fig.1 Effect of cinnamon oil on intestinal floral diversity in mice

图2 不同组小鼠肠道菌群OTUs水平主坐标分析Fig.2 Principal coordinate analysis of operational taxonomic units(OTUs) of intestinal flora in mice from different groups
本研究采集3 组小鼠共24 份肠道菌群样本,经过OTU聚类后,共获得207 个OTU,均归属于同1 个域、界,但来自于7 门、13 纲、17 目、32 科、70 属、106 个物种。由图1A可知,对3 组小鼠肠道菌群OTU水平进行分析,绘制的Rank-Abundance曲线长且平滑程度高,表明样本的物种丰富度高,且分布均匀。通过Venn图[11]比较CON组与CIN-L、CIN-H组小鼠肠道菌群的物种组成情况和相似度,由图1B可知,3 组小鼠肠道菌群共有OTUs数为152,CON组独有OTUs数为9,CIN-L、CIN-H组的独有OTUs数分别为4和14,CIN-H组独有OTUs数高于CIN-L和CON组。对3 组小鼠肠道菌群OTU进行多样性分析,由图1C、D可知,CON组Sobs指数显著高于CIN-L、CIN-H组(P<0.05),说明肉桂精油会导致小鼠肠道菌群的丰富度下降,但3 组Shannon指数无显著差异,表明摄入肉桂精油不会对小鼠肠道菌群多样性产生明显影响。
3 组小鼠肠道菌群OTUs的主坐标分析结果如图2所示。第1主成分对样本菌群结构差异的贡献率为42.43%,第2主成分为19.18%。3 组间区别明显,摄入肉桂精油后,CIN-L、CIN-H组均与CON组距离较远,且与CIN-L组相比,CIN-H组与CON组距离更远,说明肉桂精油能够调节小鼠体内肠道菌群总体结构变化,摄入肉桂精油后,小鼠肠道菌群结构存在明显差异,且呈剂量依赖效应。
2.5 肉桂精油对小鼠肠道菌群物种组成的影响
由图3A可知,3 组小鼠肠道菌群组成以厚壁菌门(Fimicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)为主,其中Fimicutes和Bacteroidetes为主要优势菌门。摄入肉桂精油后,小鼠粪便中软壁菌门(Tenericutes)相对丰度降低明显。
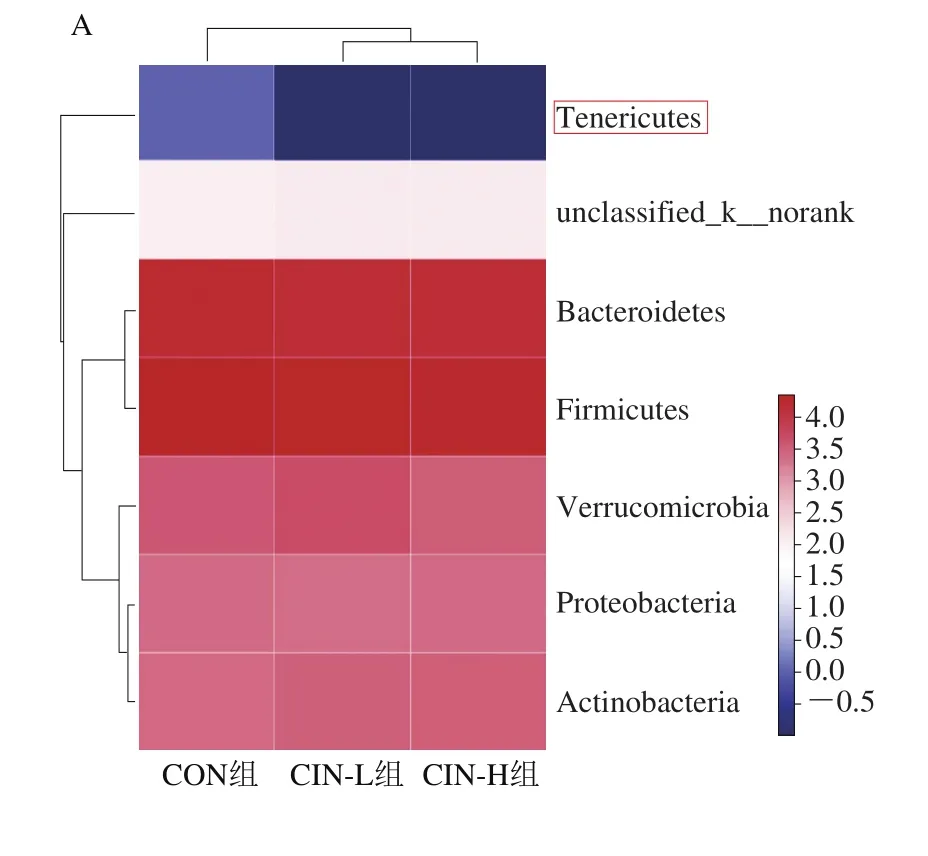

图3 不同组小鼠肠道菌群门水平(A)和属水平(B)分布热图Fig.3 Heatmaps showing the phylum-level (A) and genus-level (B)distribution of intestinal flora of mice from different groups
由图3B可知,CON组小鼠肠道菌群中苏黎世杆菌属(Turicibacter)、厌氧细杆菌属(Anaerofilum)、胃瘤球菌属([Ruminococcus]_torques_group)、葡萄球菌属(Staphylococcus)、产乙醇醋弧菌属([Acetivibrio]_ethanolgignens_group)、布劳特氏菌属(Blautia)、瘤胃梭菌属(Ruminiclostridium_9)、厌氧棍状菌属(Anaerotruncus)、螺杆菌属(Helicobacter)的相对丰度明显较CIN-L、CIN-H组高。与CON组相比,摄入肉桂精油后,CIN-L、CIN-H组小鼠肠道菌群中罗氏菌属(Roseburia)和粪芽孢菌属(Coprobacillus)的相对丰度均明显增加,高剂量组中Lachnospiraceae_NK4A136_group、梭菌属(Clostridium_sensu_stricto_1)、unclassified_f_Erysipelotrichaceae、unclassified_f_Ruminococcaceae、肠球菌属(Enterococcus)相对丰度明显增加。

图4 基于属水平的小鼠肠道菌群组间差异显著性Fig.4 Significance test of the genus-level differences in intestinal bacteria among mice groups
使用Wilcoxon秩和检验分析方法进行组间差异显著性检验,结果如图4所示。在属水平上,摄入肉桂精油导致小鼠肠道菌群中Blautia、[Acetivibrio]_ethanolgignens_group、[Ruminococcus]_torques_group、Roseburia、Coprobacillus等20 种菌属有显著性差异。其中,与CON组相比,摄入肉桂精油后,CIN-L、CIN-H组小鼠肠道菌群中Blautia、[Acetivibrio]_ethanolgignens_group、[Ruminococcus]_torques_group相对丰度均显著降低,Roseburia、Coprobacillus相对丰度均显著上升(P<0.05或P<0.01)。此外,与CON组相比,CIN-L组Ruminiclostridium_9、变形杆菌属(Proteus)、unclassified_f_Erysipelotrichaceae、埃格特菌属(Eggerthella)的相对丰度显著降低(P<0.05或P<0.01);与CON组相比,CIN-H组真杆菌属([Eubacterium]_fissicatena_group)、Anaerotruncus等菌属相对丰度显著降低,而Clostridium_sensu_stricto_1、Enterococcus、unclassified_f_Erysipelotrichaceae、unclassified_f_Ruminococcaceae等菌属相对丰度显著升高(P<0.05或P<0.01)。以上结果表明,肉桂精油对于小鼠肠道菌群门水平影响不明显,而对于属水平菌群结构影响明显。
2.6 肉桂精油对小鼠粪便中SCFAs含量的影响

表6 摄入肉桂精油后小鼠粪便中SCFAs含量变化Table 6 Effect of cinnamon essential oil on SCFAs contents in feces of mice
由表6可知,3 组小鼠粪便中丁酸含量无明显变化。与CON组相比,CIN-L组小鼠粪便中乙酸、丙酸含量降低但均不显著,总酸含量显著降低(P<0.05);与CON组相比,CIN-H组小鼠粪便中乙酸、丙酸、总酸的含量均显著降低(P<0.05)。这表明摄入高剂量肉桂精油会抑制小鼠肠道中产酸菌的生理活性。
3 讨 论
膳食与肠道菌群多样性密切相关,通过“微生物-肠-肝”轴等途径影响机体免疫能力、激素水平和代谢通路,从而影响宿主生理状态[12]。普遍认为,膳食纤维与低聚糖等能够调节肠道菌群的结构和稳态进而影响机体健康[13],而食用香料对肠道菌群结构的影响鲜有报道。肉桂精油是一种普遍使用的食用香料,肉桂精油中起主要作用的组分是肉桂醛、乙酸肉桂酯和丁香酚,肉桂醛与乙酸肉桂酯是同系物,它们与丁香酚都可以在精油中发挥抗氧化和抑菌效应[10,14]。本实验探究肉桂精油对小鼠肠道菌群结构和机体抗氧化水平的影响,结果表明,摄入肉桂精油会影响小鼠肠道菌群结构,但在门水平上影响不明显,仅Tenericutes相对丰度下降较为明显。同时,CIN-L、CIN-H组小鼠体脂含量下降显著,肝脏代谢相关酶活力上升。这与Tamura等[15]的研究结果类似,在高脂高糖饲料中添加肉桂醛,显示出具有降低肾周和附睾脂肪组织质量的趋势。Pedersen等[16]研究表明,Tenericutes为肥胖个体中的优势菌种,推测Tenericutes丰度可能与肥胖水平有关。因此,膳食中摄入肉桂精油能够促进小鼠体脂降低,可能与调节Tenericutes丰度进而调控脂肪相关代谢有关。
先前有研究报道,通过末端限制性片段多态性技术分析肉桂精油能对大鼠肠道梭菌属IV簇细菌和拟杆菌属的影响发现,拟杆菌属数量增加,梭菌属组成发生改变,梭菌属IV簇细菌数量减少[17]。本研究通过Illumina MiSeq测序技术对小鼠肠道菌群进行分析,摄入肉桂精油后,未发现拟杆菌属相对丰度有明显增加,肠道菌群中Blautia、[Ruminococcus]_torques_group、[Eubacterium]_fissicatena_group、Anaerotruncus等属的相对丰度显著降低。这些菌群与SCFAs产生有关,其中乙酸主要由Blautia等产生、丙酸主要由Ruminococcus等产生[18],这可能导致小鼠粪便中SCFAs中乙酸、丙酸含量的降低。虽然肠道内SCFAs中约有95%作为细胞能量来源物质的底物被使用[19],但某些有害菌(机会致病菌)也会增加肠道内产气和乙酸、丙酸等SCFAs含量,可能造成机体内脏敏感性提高和肠道动力的异常[20],而肠道内产生过多的丁酸会诱发肠易激综合症或导致肠易激症状的加重[21]。因此,摄入肉桂精油可以通过降低SCFAs水平,适度调节肠道消化功能。
多种肠道代谢疾病的发生与肠道微生态平衡被破坏、肠道菌群结构改变,造成肠道通透性增加、肠道腐败物质增多有关[22],如溃疡性结肠炎和克罗恩病等炎症性肠病或肥胖和糖尿病等代谢综合征。研究表明肠易激综合症、溃疡性结肠炎和克罗恩病患者肠道内Blautia和Ruminococcus丰度较正常人群要高[23-24]。Ruminococcus丰度与生物体的衰老进程和肠道微生物群落结构脆弱情况呈正相关[25]。[Eubacterium]_fissicatena_group是一类口腔机会致病菌[26],可以通过“口腔-肠道”途径传播定植于结肠[27],其丰度的增加会导致溃疡性结肠炎的产生[28]。Anaerotruncus属于Tenericutes,因此其丰度可能影响机体肥胖水平和肝脏生理活性。肉桂精油的摄入可以降低肠道中机会致病菌丰度,抑制口腔中致病菌的转移,从而预防代谢综合征和肠道疾病的发生。此外,摄入肉桂精油可导致Roseburia、Coprobacillus、Lachnospiraceae_NK4A136_group、unclassified_f_Erysipelotrichaceae、Clostridium_sensu_stricto_1相对丰度显著增加,这类产丁酸菌的分解代谢产物能够为机体糖酵解提供底物,与肠道益生菌产生共生作用,且与肥胖、结肠癌的抑制有关[29]。有研究表明,Roseburia丰度的降低与克罗恩病和溃疡性结肠炎患者的肠道微生态失衡具有相关性[30],且在缓解内毒素血症、改善免疫紊乱和肠道屏障功能方面发挥作用[31];Coprobacillus具有维持肠道稳态的作用,且其丰度的降低与肠易激综合症2 个亚型症状的缓解有关[32-33];unclassified_f_Erysipelotrichaceae的丰度与机体胃肠道疾病的炎症和新陈代谢紊乱呈负相关,与肠道营养吸收呈正相关[34]。Clostridium_sensu_stricto_1属于梭菌属,能够调节以琥珀酸为主的氨基酸代谢[35],从而降低高血压、缺血性心脏病、II型糖尿病和肥胖风险[36]。因此,肉桂精油的摄入可以降低肠道中条件致病菌丰度,增加有益菌群丰度,调节肠道菌群结构,从而干预肠道生态紊乱。
本研究发现肉桂精油可调节机体肠道氧化还原状态平衡,这可能与调节肠道菌群有关。当机体内自由基数量超过机体的抗氧化能力时,会导致氧化应激反应[37]。已有研究表明自由基增多会改变肠道内环境,促进大肠杆菌、葡萄球菌等条件性致病菌的增殖,抑制乳酸菌、双歧杆菌等益生菌的生长[38-39]。而膳食中抗氧化剂可以有效清除自由基,促进肠道内有益菌增殖,抑制条件致病菌增殖[40],Wei Hongkui等[41]的研究表明,植物多酚类化合物对肠球菌属和大肠杆菌等产自由基细菌的生长具有抑制作用。另一方面,肠道中有益菌群可通过上调SOD、谷胱甘肽过氧化物酶等抗氧化相关酶系的表达,保持肠道内氧化还原状态的平衡[42]。
综上所述,肉桂精油作为一种食物香料提取物,能够调节肠道氧化还原状态平衡,调节肠道菌群结构。肉桂精油对于肠道菌群结构的调节主要表现在属水平上,即降低Blautia、[Eubacterium]_fissicatena_group等条件致病菌相对丰度,增加Roseburia、Coprobacillus等有益菌群相对丰度,表明其具有潜在促进机体健康的作用。

