胡萝卜类黄酮含量的测定及DcCHS基因家族的鉴定分析
张新业,王雨欣,孙艳香,朱 姝,王聪艳,李文静
(1.廊坊师范学院 生命科学学院,河北廊坊 065000;2.河北省动物多样性重点实验室,河北廊坊 065000; 3.廊坊市细胞工程与应用研究重点实验室,河北廊坊 065000)
类黄酮(flavonoids),又称黄酮类化合物,是一类重要的植物次级代谢产物,包括查尔酮(chalcones)、黄酮(flavones)、黄酮醇(flavonols)、花青素(anthocyanins)等[1]。类黄酮具有广泛的生理作用,能够参与植物色素的形成[2-3],协助植物抵御非生物胁迫,并调节植物生长发育[4]。此外,类黄酮还具有一定的药理功能,如抗氧化、抗过敏、抗病毒、抗肿瘤等[5]。因此,植物类黄酮的研究越来越受到重视。
查尔酮合成酶(chalconesynthase,CHS)属于植物聚酮合酶超家族[6],是类黄酮合成过程中的第一个关键酶,能够催化三分子丙二酰辅酶A(malonyl-CoA)与一分子香豆酰辅酶A(p-Coumaroyl-CoA)缩合形成柚皮素查耳酮(naringeninchalcone),该产物是其他黄酮类物质合成的基础[7-8]。CHS基因首次从欧芹细胞培养物中获得[9]。近年来,随着基因组测序技术和生物信息学的发展,小立碗藓(Physcomitrellapatens)[10]、番茄(Solanumlycopersicum)[11]、辣椒(Capsicumannuum)[12]、葡萄(Vitisvinifera)[13]、玉米(Zeamays)[14]和香蕉(Musaacuminate)[15]中的CHS基因家族被陆续鉴定。由于物种的不同,CHS基因家族成员的数目会有所差异。尽管如此,不同物种来源的CHS基因在结构上较为保守,通常含有两个外显子和一个内含子,外显子1可编码37~64个氨基酸残基,外显子2编码约340个氨基酸残基[16]。此外,分子进化可能会引起CHS基因的内含子数目发生变化[17]。CHS基因表达量的改变不仅能够影响类黄酮的含量,而且可以调节植物花色、育性及抗逆性。Sun等[18]在矮牵牛(Petuniahybrida)中过表达香雪兰(Freesiahybrida)CHS基因,使矮牵牛的类黄酮含量及花色均发生改变。邵莉等[19]研究表明,矮牵牛中CHS基因的转录被抑制后,不仅影响花色,还可导致雄性不育。Chen等[20]在烟草(Nicotianatabacum)中过表达紫茎泽兰(Eupatoriumadenophorum)EaCHS1基因,除可提高烟草的类黄酮含量外,还增强了其抗盐能力。
胡萝卜(Daucuscarotasubsp.sativus)属伞形科,是一种块根作物,具有重要的经济价值[21],其营养丰富,含有大量的α-胡萝卜素和β-胡萝卜素,是维生素K和维生素B6的良好来源[22]。到目前为止,胡萝卜CHS基因家族还未见报道。胡萝卜基因组测序的完成,为在全基因组水平上研究其CHS基因家族奠定基础。本研究测定不同发育时期胡萝卜根和叶中类黄酮的含量,同时利用生物信息学的方法鉴定胡萝卜CHS基因家族,并对其进行染色体定位、基因结构、进化树构建等分析,可为进一步研究CHS基因家族在胡萝卜类黄酮代谢过程中的作用提供理论依据。
1 材料与方法
1.1 类黄酮含量测定
胡萝卜品种‘橘红一号’种子经浸种后,种植于混合基质[V(蛭石)∶V(营养土)=1∶1]中,置于人工气候室内(25 ℃光照14 h,18 ℃黑暗 10 h,光照强度为240 μmol·m-2·s-1)进行培养。于苗期和收获期分别采集胡萝卜的根和叶, 105 ℃杀青15 min,70 ℃烘干至恒量。将烘干的胡萝卜组织粉碎,过40目筛,称取约0.05 g样品,加入1 mL含量为60%的乙醇,60 ℃超声提取30 min,12 000 r·min-1离心10 min,取上清,用相同浓度的乙醇溶液定容至1 mL,即为样品待 测液。
利用亚硝酸钠-硝酸铝显色法进行类黄酮含量的测定(北京迪信泰检测科技有限公司)。取60 μL样品待测液于1.5 mL离心管中,加入 15 μL含量5%的亚硝酸钠溶液,混匀,室温静置 5 min;加入15 μL质量分数为10%的硝酸铝溶液,混匀,室温静置5 min;加入120 μL含量为4%的氢氧化钠溶液和90 μL含量为60%的乙醇溶液,混匀,37 ℃水浴45 min,10 000 g离心10 min,取200 μL上清于微量比色皿中测定470 nm处吸光度,以蒸馏水作为空白对照。类黄酮含量表示为 mg·g-1。
以芦丁为标样制作标准曲线。称取芦丁 1 mg,加入含量为60%的乙醇溶液配制成 0.036 mg·mL-1、0.024 mg·mL-1、0.016 mg·mL-1、0.008 mg·mL-1和0.004 mg·mL-1的标准溶液,测定方法同上。
1.2 胡萝卜CHS基因家族成员的鉴定
胡萝卜基因组序列文件(Daucus_carota.ASM162521v1.dna.toplevel.fa)、CDS序列文件(Daucus_carota.ASM162521v1.cds.all.fa)、蛋白质序列文件(Daucus_carota.ASM162521v1.pep.all.fa)及gff3数据格式文件(Daucus_carota.ASM162521v1.42.gff3)等均下载自EnsemblPlants数据库(http://plants.ensembl.org/index.html)。
在Pfam数据库(http://pfam.xfam.org/)中以“chalcone synthase”作为关键词进行检索,获得CHS蛋白保守结构域Chal_sti_synt_N及Chal_sti_synt_C的Pfam号PF00195和PF02797,下载各Pfam号对应的隐马尔科夫模型(Hidden Markov Model,HMM)文件(Chal_sti_synt_N.hmm和Chal_sti_synt_C.hmm)。利用hmmsearch程序将两个HMM文件在胡萝卜蛋白质序列文件中进行检索,并将两个HMM文件的检索结果合并,剔除无完整读码框的序列,同时具有Chal_sti_synt_N和Chal_sti_synt_C两个结构域的蛋白即为胡萝卜CHS蛋白,然后利用NCBI数据库中CD-Search工具对筛选到的胡萝卜CHS蛋白进行进一步确认。利用perl程序从胡萝卜蛋白质序列文件中提取CHS基因家族各成员的蛋白序列,使用在线工具ExPASy ProtParam tool(https://web.expasy.org/protparam/)对胡萝卜CHS蛋白的氨基酸序列进行等电点分析及分子质量预测等。
1.3 胡萝卜CHS基因的结构及染色体定位分析
从gff3文件中获得胡萝卜CHS基因外显子和内含子在染色体上的位置信息,并利用工具GSDS(Gene Structure Display Server)绘制基因结构图[23]。
利用perl程序从胡萝卜gff3文件中获取CHS基因家族在染色体上的位置信息,然后根据相应染色体的长度信息,利用MapChart绘制CHS基因的染色体定位图[24]。
1.4 胡萝卜CHS蛋白性质分析
利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、SignalP 4.1 Server[25](http://www.cbs.dtu.dk/services/SignalP-4.1/)、TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和CELLO v.2.5[26](http://cello.life.nctu.edu.tw/)对胡萝卜CHS蛋白的二级结构、信号肽、跨膜区和亚细胞定位情况进行预测 分析。
1.5 胡萝卜CHS蛋白的结构分析及系统进化树构建
使用DNAMAN对鉴定到的胡萝卜CHS蛋白进行多序列比对,并利用MEGA6软件采用邻接法(Neighbor-Joining)构建胡萝卜CHS蛋白的系统发育进化树,bootstrap设置1 000次重复,其他参数均使用默认设置[27]。使用MEME软件在胡萝卜CHS蛋白序列中搜索保守基序,将参数中的预测数目设置为10,长度设置为 6~100,其他参数均为默认设置,同时利用PfamScan(https://www.ebi.ac.uk/Tools/pfa/pfamscan/)对鉴定到的保守基序进行注释[15]。
2 结果与分析
2.1 胡萝卜不同组织部位的类黄酮含量测定
测定不同浓度芦丁标准样品在470 nm处的吸光度,以芦丁浓度作为横坐标,吸光度作为纵坐标,进行标准曲线的绘制。求得回归方程为y=11.564x-0.008 1,决定系数R2= 0.999 1,表明标准曲线的拟合度较高(图1-A)。
类黄酮含量的测定结果表明,苗期胡萝卜根和叶中的类黄酮含量分别为3.99 和19.69 mg·g-1,收获期根和叶中的类黄酮含量分别为3.50和19.60 mg·g-1。无论在苗期还是收获期,叶中的类黄酮含量均高于根中的含量,且达到极显著水平(P<0.01)。叶中的类黄酮含量在不同发育时期差异不显著,而根中的类黄酮含量在不同发育时期差异显著(P<0.05)(图1-B)。
2.2 胡萝卜CHS基因家族的鉴定
利用生物信息学的方法,从胡萝卜基因组中鉴定到12个CHS基因家族成员,命名为DcCHS1~DcCHS12。分析家族成员的序列发现,氨基酸序列长度为253~398 aa,其中DcCHS4及DcCHS5的氨基酸序列最长,DcCHS10最短;DcCHS蛋白分子质量为26.91~44.00 ku,等电点为5.13~7.13。DcCHS基因的外显子为1~3个,内含子为0~2个(表1,图2)。
从CHS基因在胡萝卜基因组中的分布看,除DcCHS12未被定位到染色体上外,其余11个成员分布于胡萝卜的5条染色体上。5号染色体上的基因数目最多(5个),4和6号染色体上的基因个数最少(1个),7号和9号染色体上均有2个基因。这表明CHS基因家族成员分布并不均匀,DcCHS2~6具有明显的成簇分布现象[28](图3,表1)。
2.3 胡萝卜CHS蛋白的结构分析
胡萝卜CHS蛋白的二级结构主要以α-螺旋和无规卷曲为主,分别占38.34%(DcCHS10)~ 48.34%(DcCHS9)和30.39%(DcCHS8)~ 36.80%(DcCHS2);伸展链和β-转角的占比较低,分别为13.81%(DcCHS9)~19.37%(DcCHS10)和5.63%(DcCHS9)~8.70%(DcCHS10)。经预测,胡萝卜CHS蛋白不含信号肽及跨膜区,且均定位于细胞质中(表2)。对各成员的氨基酸序列进行多序列比对,结果表明DcCHS1、DcCHS8和DcCHS10的N端存在大片段缺失,其他成员间序列长度差异不大(图4,表1);DcCHS7和DcCHS10之间一致性最低为 25.32%,而DcCHS4和DcCHS5的序列完全一致,可能是同一基因的两个拷贝(表3)。此外,各成员均含有CHS蛋白的催化位点、底物特异性残基、丙二酰辅酶A结合位点及CHS特征序列[18](图4)。
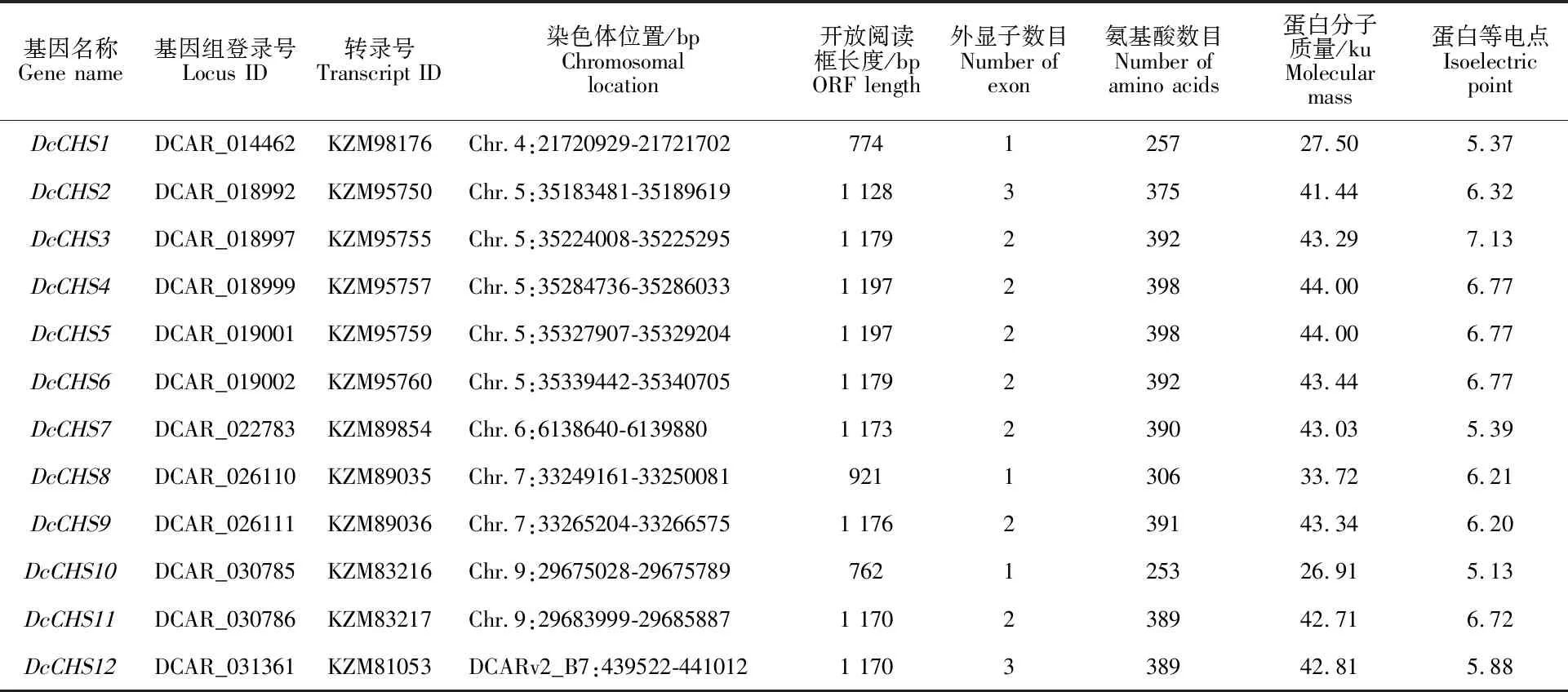
表1 胡萝卜CHS基因家族成员信息Table 1 Information of CHS gene family in carrot
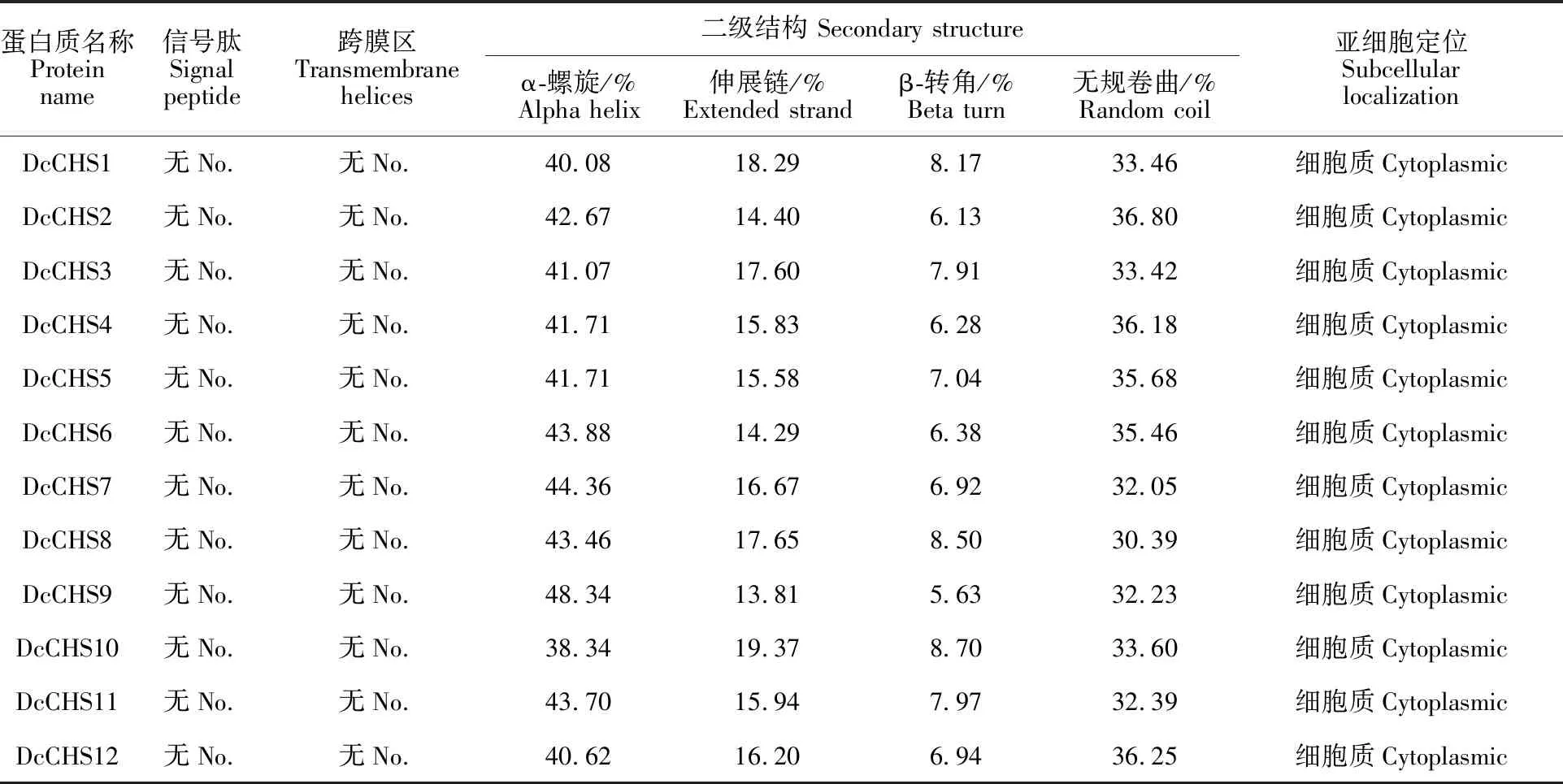
表2 胡萝卜CHS蛋白的结构分析Table 2 Structure analysis of CHS protein in carrot
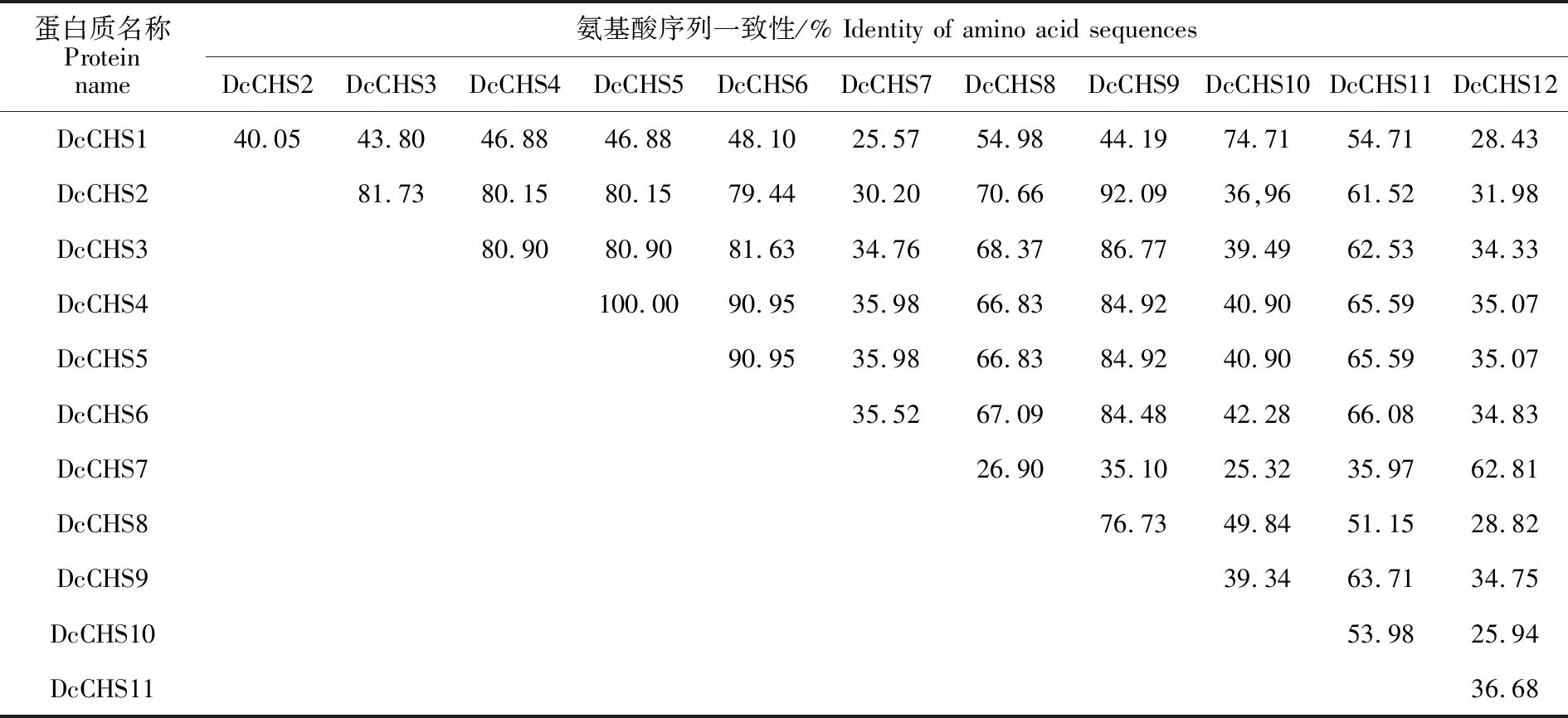
表3 CHS基因家族的氨基酸序列一致性Table 3 Identity of amino acid sequences of CHS gene family in carrot
2.4 胡萝卜CHS蛋白系统发育及蛋白保守基序分析
为明确胡萝卜CHS基因家族成员间的进化关系,利用CHS基因家族的蛋白序列构建系统发育进化树。胡萝卜CHS蛋白被分为两类:ClassⅠ和ClassⅡ,除DcCHS7、DcCHS12属于ClassⅡ外,其余成员均属于ClassⅠ。此外,ClassⅠ还可以被进一步划分为两个亚类:SubclassⅠ和SubclassⅡ(图5-A)。
利用MEME软件对胡萝卜CHS蛋白进行保守基序分析,并对鉴定到的保守基序进行功能注释。在胡萝卜CHS蛋白中共鉴定到10种保守基序,分别命名为motif1~motif10,其中motif1、4、6、7均为CHS蛋白N端结构域,motif2、3、8均为CHS蛋白C端结构域,motif3含有丙二酰辅酶A结合部位及CHS特征序列(图5-B)。DcCHS7和DcCHS12所含motif的种类相同,DcCHS4、DcCHS5、DcCHS6、DcCHS9所含motif的种类相同,尽管不同家族成员的蛋白序列中所包含的保守基序的种类及数量有所差异,但所有成员均含有CHS蛋白的N端和C端结构域(图5-A)。
3 讨 论
胡萝卜是世界上分布广泛的伞形科蔬菜,所含的黄酮类化合物(如山奈酚、槲皮素和木犀草素)使其具有较好的抗氧化、抗癌作用,并能调节免疫反应及减轻炎症损伤[29]。陈建福等[30]利用响应面法对胡萝卜叶中类黄酮的提取工艺进行优化,得到最优提取条件:72%乙醇溶液作为提取剂,料液比为1∶15,超声温度和时间分别为 71 ℃和40 min,并利用NaNO2-Al(NO3)3比色法测得总黄酮含量为42.13 mg·g-1。本研究以60%乙醇作为提取剂,料液比为1∶20,60 ℃超声提取30 min,采用同样的方法测得苗期和收获期叶中类黄酮的含量分别为19.69和19.60 mg·g-1,与前者结果不同,可能与提取条件及植物材料基因型的不同有关[31-32]。此外,本研究测得苗期和收获期胡萝卜根中类黄酮的含量分别为 3.99和3.50 mg·g-1,二者差异显著,表明不同的测定时期也会影响类黄酮的含量[33]。
CHS是植物次生代谢产物类黄酮合成过程中的限速酶,是类黄酮代谢研究的热点,通过调控CHS基因的表达可以有效改良类黄酮含量[34]。CHS主要以基因家族的形式存在于植物基因组中。前人已在小立碗藓、番茄、辣椒、葡萄、玉米和香蕉基因组中分别鉴定到17、8、7、9、14和20个CHS基因家族成员[10-15]。本研究利用生物信息学的方法,从胡萝卜基因组中鉴定到12个CHS基因家族成员。CHS基因通常含有2个外显子和1个内含子[16],但不同物种间CHS基因的外显子、内含子数目会有所不同。胡萝卜CHS基因的外显子数为1~3个,内含子数为0~2个,与番茄[11]、辣椒[12]中的结果类似,而香蕉MaCHS03、MaCHS13基因的内含子4个,MaCHS05的内含子则多达5个[15]。DcCHS蛋白二级结构由α-螺旋、伸展链、β-转角和无规卷曲构成,含量分布为α-螺旋>无规卷曲>伸展链>β-转角,且全部定位于细胞质中,推测DcCHS蛋白主要在细胞质中发挥功能。香蕉中多数MaCHS蛋白的二级结构含量分布及亚细胞定位预测结果与DcCHS蛋白类似[15]。DcCHS蛋白均含有CHS的保守序列,但氨基酸水平上的序列一致性变化幅度较大,为25.32%~100%,表明成员序列之间具有较高的遗传多样性。此外,DcCHS蛋白大都含有CHS蛋白的催化位点、底物特异性残基及丙二酰辅酶A结合部位等与CHS蛋白功能密切相关的位点或序列,有助于后续进一步研究胡萝卜DcCHS蛋白的催化机理和酶活特性[6,18]。进化分析表明,胡萝卜CHS蛋白分为两类,与番茄[11]和辣椒[12]中的研究结果一致。CHS基因的表达及CHS蛋白的积累在转录水平、转录后水平及翻译后水平均会受到调节[35]。CHS基因的表达通常受紫外线、植物病原菌侵染等因素的诱导,从而引起类黄酮含量的增加[6],而参与调控的转录因子主要包括R2R3-MYB转录因子或MYB-bHLH-WD40(MBW)蛋白复合体[36]。不同植物间CHS翻译后调节的分子机理不尽相同。在拟南芥中,含Kelch结构域的F-box蛋白-KFBCHS能够介导CHS的泛素化降解[8],而芍药属(Paeonia)植物则可通过锌指结构蛋白-PhRING-H2使PhCHS泛素化,并介导其降解[35]。
本研究测定了胡萝卜不同发育时期、不同组织部位的类黄酮含量,并在全基因组水平上对类黄酮合成过程中的关键酶基因CHS进行鉴定和分析。在后续的工作中,笔者将对DcCHS基因家族成员进行表达分析,并探明DcCHS基因表达量与胡萝卜类黄酮含量之间的关系,以期为今后进一步研究DcCHS基因的表达调控及其在类黄酮合成过程中的作用奠定基础。

