微生物加固黏土的影响因素与机理分析
张银峰,万晓红,李 娜,赵卫全,陈 筠
(1.贵州大学 资源与环境工程学院,贵州 贵阳 550025;2.中国水利水电科学研究院,北京 100038;3.贵州理工学院,贵州 贵阳 550003)
1 研究背景
随着我国基础建设的快速发展,遇到的不良土体越来越多。通常采用添加水泥、石灰、粉煤灰或有机材料来加固土体,但该类材料环保性差[1]。因此,进一步研究不良土体的加固替代技术,实现资源节约型和环境友好型处理至关重要。1973年Boquet等[2]发现自然中某些微生物菌种可以利用自身生命活动诱导碳酸钙沉积的现象;2004年Whiffin[3]率先提出采用微生物诱导碳酸钙技术胶结松散砂颗粒,以提高砂土的强度和刚度等宏观力学性质;2005年Mitchell等[4]明确指出了微生物改性岩土体的广泛应用价值及潜力。随后在国内外掀起了研究微生物诱导碳酸钙沉淀(MICP)技术及其工程应用的热潮。
尿素水解是一种常用的微生物诱导生成碳酸钙的方式,其机理是微生物通过自身新陈代谢活动产生高活性的脲酶,将尿素水解成铵根离子(NH4+)和碳酸根离子(CO32-),与外界提供的钙源接触后生成具有胶结性能的碳酸钙沉淀,通过充填孔隙、胶结岩土颗粒,进而达到提升岩土体力学性质的目的。在整个生化反应过程中,微生物起到两个核心作用,一是为尿素水解提供脲酶,二是为碳酸钙晶体提供晶核,不产生毒性物质及其他副产物[5-6]。因MICP加固技术具有生态环保、耐久性好等优点,因而近年来国内外研究者逐渐将其应用于工程材料领域。程晓辉等[7]通过中型振动三轴和小型振动台,实测和研究MICP低压灌浆加固的砂样和模型地基的动力性能,结果表明MICP灌浆加固砂样的抗液化性能有大幅提高;Lian等[8]通过生物灌浆方式加固砂柱,其无侧限抗压强度可达1.91 MPa,渗透系数降低了三个数量级;支永艳等[9]将微生物加固技术应用于裂隙岩体灌浆加固,微生物灌浆加固后,不同围压和渗透水压力作用下裂隙岩样的单位时间渗流量减小了80.12%~90.04%,渗透系数达到10-6cm/s数量级;钱春香等[10]提出MICP技术能对混凝土裂缝进行自我修复;刘士雨等[11]应用MICP技术修复和保护三合土遗址,发现裂隙越小其修复能力越显著,恢复率随着裂缝宽度的减小呈现增加的趋势;王子文等[12]利用MICP固化淤泥质土强度,发现固化后的抗剪强度明显提高,内摩擦角可提高3.96~5.52倍;刘璐等[13]将MICP技术应用于堤坝加固,以改善堤坝表层砂土的力学性能;许燕波等[14]基于生物矿化原理,用碳酸钙固结重金属离子,使得土壤中活泼的重金属离子转变为碳酸盐矿物态,降低其危险;Gu等[15]将MICP技术应用在风蚀方面,可抑制砂土扬尘。
目前MICP加固的研究对象主要为砂土,针对黏性土MICP改性的研究较少,原因是与砂土相比,黏性土颗粒粒径和孔隙小,渗透性低,不利于微生物在土体中迁移,如果利用灌浆的方式将菌液和胶结液加入到土体中,会出现注浆过程中发生碳酸钙充填孔隙,浆液扩散受限和扩散不均匀的情况,从而制约了MICP技术对黏土的加固效果[16]。余梦等[17]利用灌浆的方式将菌液和胶结液加入到膨胀土中,发现无侧限抗压强度最大仅200 kPa,远低于压实土的无侧限抗压强度。国内外单纯针对微生物培养因素研究较多,对尿素水解以及碳酸钙沉淀加固过程影响因素的研究较少。本研究采用将菌液和胶结液与土颗粒混合搅拌的方式加固黏土,通过对微生物培养以及尿素水解的影响因素分析,探讨不同因素下碳酸钙生成量和无侧限抗压强度的变化,以及碳酸钙生成量与无侧限抗压强度关系,得到尿素水解以及微生物加固土养护方式的优化方案,并结合微观分析研究微生物加固黏土的加固机理。
2 试样制备
2.1 细菌培养与保存 试验选用的微生物菌种为巴氏芽孢杆菌(Sporosarcina pasteurii),编号为BNCC 337394。根据试验内容选用A、B两组液体培养基进行扩大培养。培养基成分见表1。
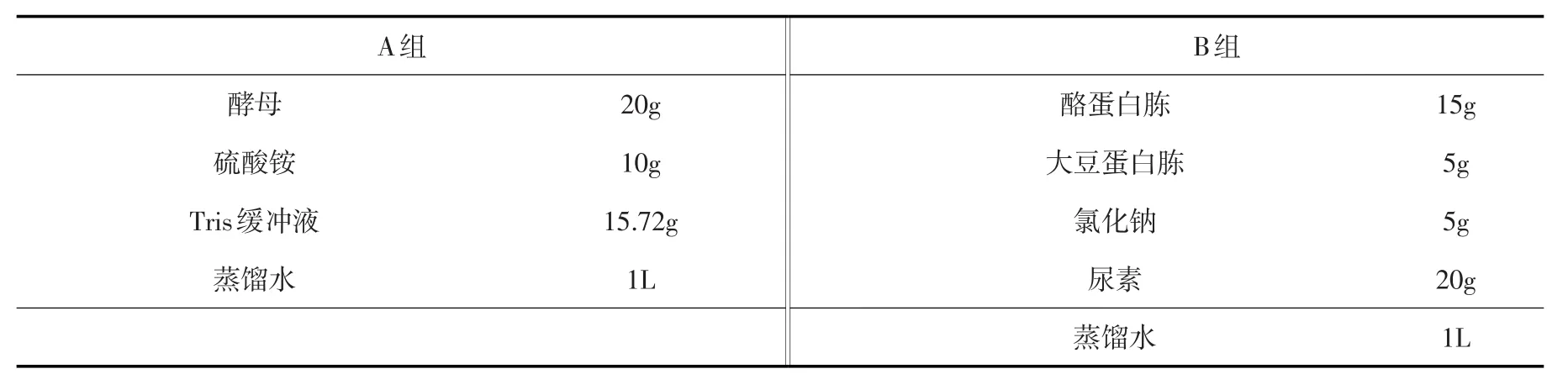
表1 A、B两组培养液成分
2.2 细菌胶结液配制 胶结液主要为微生物诱导生成碳酸钙过程提供尿素以及钙离子。本次试验胶结液由相同摩尔比的尿素和氯化钙组成,试验采用的浓度有0.5 mol/L、1 mol/L、1.5 mol/L和2 mol/L的混合液。
2.3 试样制备 试验所用黏土取自引江济淮工程小合分线某段黏土作为试验土样,颜色呈黄褐色,粒度成分中以黏土颗粒为主,其主要物理性质指标如表2所示。

表2 黏土的物理性质指标
依照《土工试验方法标准》(GB/T 50123-2019)[18]将取来的扰动土放入烘箱,在105℃下烘足10小时后碾压过2 mm筛,取过筛的风干土1~5kg,菌液和胶结液以1∶1的比例混合后加入土中。通过击实试验测得重塑土的最优含水率为18%,微生物加固土的最优含水率为20%。根据最优含水率用喷雾器将菌液和胶结液的混合液喷洒到土上,混合搅拌均匀后保鲜袋密封润湿一昼夜,制取直径为39.1 mm,高为80 mm的标准抗压试样。
3 微生物加固黏土试验
3.1 试验方案 为研究不同因素对微生物培养和微生物加固黏土的影响,了解微生物加固黏土的加固机理,进行了一系列试验分析。具体试验方案见表3,共做试验303次。

表3 试验方案
3.2 试验方法
(1)细菌浓度。细菌数量通过吸光度(比浊法)测试法测量,其原理是菌液中细菌的数量与菌液的浓度成正比,菌液浓度又与吸光值成正比,因此只需要测菌液在一定浓度下的吸光值即可计算出细菌数量。细菌浓度可用分光光度计在600 nm波长下的吸光度来表示,本文直接使用OD600值来表示细菌浓度。
(2)脲酶活性。将10 mL待测细菌溶液与90 mL 1.1 mol/L尿素溶液混合放在磁悬浮搅拌器上搅拌,在25℃下使用电导率仪测试5 min内电导率的变化值,加权平均之后得出5 min之内电导率每分钟的变化值。根据Whiffin[3]得到的经验数值,1 ms/min的电导率变化对应11 mM urea hydrolysed/min的尿素水解量。可以将平均每分钟电导率变化值(ms/min)换算成单位时间脲酶水解的尿素量,并乘以稀释倍数10,得到待测菌液每分钟水解尿素量(mM urea hydrolysed/min),本文用此值来表示脲酶活性。
(3)无侧限抗压强度。将制备好的式样放置在万能试验机上,以1 mm/min匀速加载速度进行加压试验,绘制各种影响条件下微生物加固土的应力—应变曲线,并分析其力学性质的变化特征。
(4)碳酸钙含量。使用盐酸洗涤法来测量微生物加固黏土所生成碳酸钙的量。将5 g样品与25 mL 1 mol/L盐酸混合,用玻璃棒搅拌5 min加速溶解碳酸钙。然后将混合液倒入铺有滤纸的漏斗,用蒸馏水洗涤20 min。该洗涤过程的目的是从土颗粒中除去所有可溶性钙。然后将残留在滤纸上的所有固体颗粒连同滤纸一起放入烘箱干燥并称重。前后的质量差即为碳酸钙的含量[19]。
(5)微观测试。将微生物加固样品在30℃养护7 d,并在室温下风干7 d,选取新鲜面进行喷金后,通过扫描电镜(SEM)和X射线色散能谱(EDS)来分析微生物诱导生成碳酸钙的形态、大小、分布状况以及样品的化学成分。
4 试验结果与分析
4.1 细菌活性和浓度的影响因素 尿素水解是微生物诱导碳酸钙沉淀生物矿化作用中主要方式之一,因其水解机理简单,反应过程容易控制,所以基于尿素水解的MICP一直作为主流的碳酸钙生物矿化技术被人们广泛应用。尿素水解的MICP是基于一种高产脲酶的芽孢杆菌,因此培养出高活性和高浓度的微生物至关重要。
4.1.1 培养温度的影响 图1为微生物在不同培养温度下细菌浓度和脲酶活性随培养时间的变化曲线。由图1可知:随着培养时间的增加,微生物进行生长繁殖,细菌浓度和活性逐渐增加,在相同时间下,30℃培养温度下的菌液活性和浓度最高,25℃次之。这是因为巴氏芽孢杆菌在适宜的培养温度下可以快速生长繁殖,温度过低会影响细菌各种生化反应的协调一致性,从而降低细菌的新陈代谢,抑制其生长繁殖的速度。温度过高可能会改变微生物的形态和代谢等,导致微生物死亡[20]。
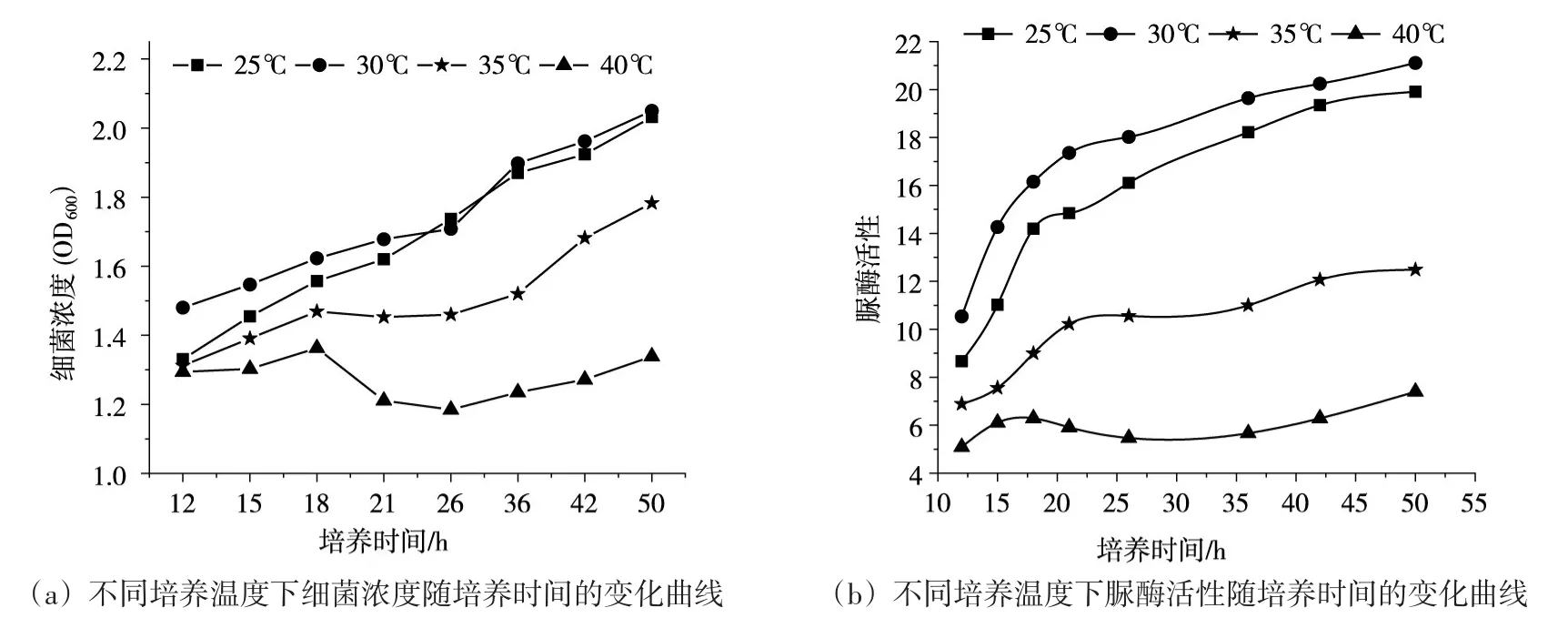
图1 不同培养温度下细菌浓度和脲酶活性随培养时间的变化曲线
4.1.2 培养基pH值的影响 图2为不同pH值下,细菌浓度和脲酶活性随培养时间的变化曲线。由图可知,细菌在不同pH的培养基中,细菌浓度随培养时间增加而增加,pH值为9和11的浓度相对更高一点。脲酶活性在pH为5的培养基中几乎无变化,pH为7的培养基中活性变化小,pH值为9和11活性相比高出很多,说明巴氏芽孢杆菌适宜在弱碱环境中生长繁殖。酸性和强碱环境下微生物活性降低甚至死亡。
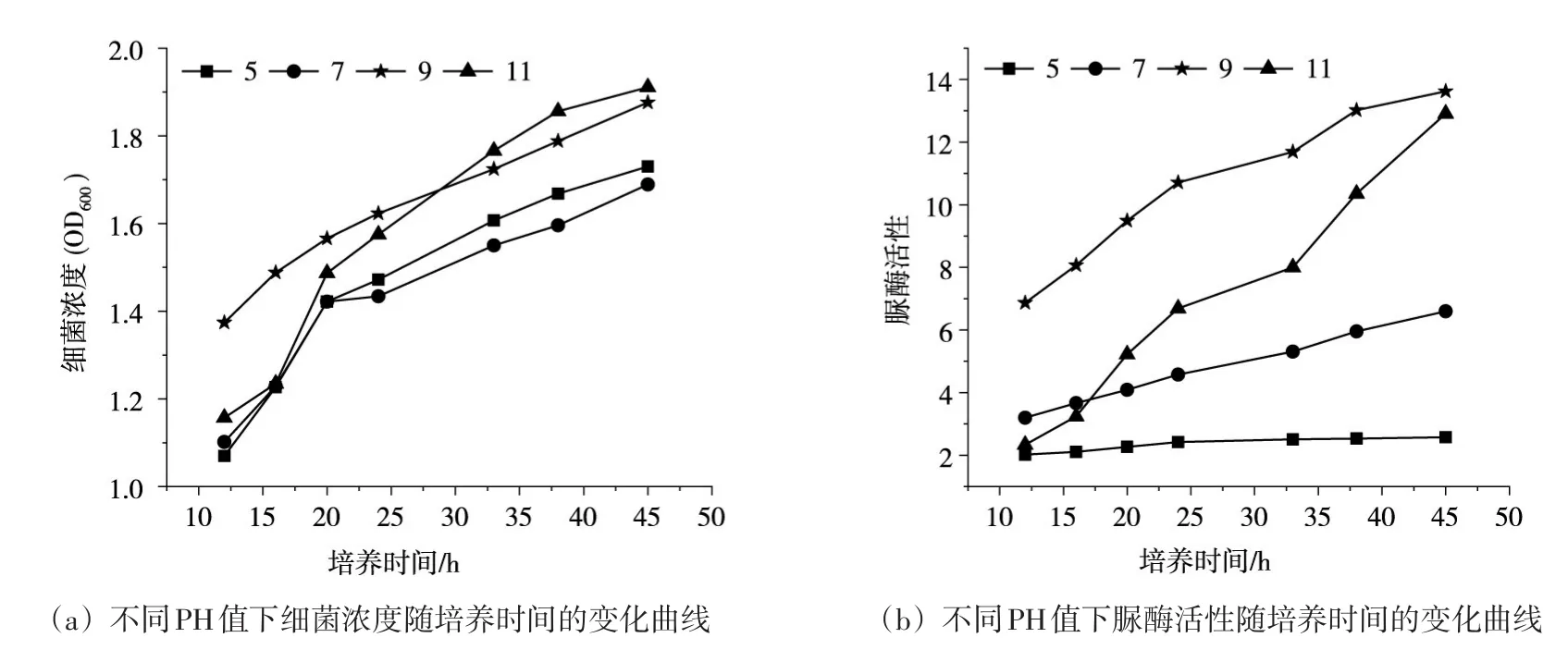
图2 不同PH值下细菌浓度和脲酶活性随培养时间的变化曲线
4.1.3 接种量的影响 微生物活化成功后需进行扩大培养来获得大量的微生物菌液,通常将有一定活性的菌液按照一定比例加入到经过杀菌消毒后的培养基中进行培养。而不同的接种比例也会影响扩大培养微生物的活性和浓度。
图3为不同接种量下,微生物脲酶活性和浓度随培养时间变化曲线。由图3可知,随着培养时间增加,浓度和脲酶活性均增加,接种量为5%的菌液活性和浓度相比其他接种比例高,随着接种量的增加,细菌活性和浓度逐渐减少。这是因为接种量过多,会因细菌增加过快和接种而移入过多的代谢废物,导致菌种容易衰老,不利于菌种高产。接种量太少,细菌增长缓慢,培养时间长,同时会降低菌种活性。接种量适宜,同时会降低菌种活性。接种量适宜,既能保证合理缩短培养周期,又能得到较高活性的菌种[21]。可得到巴氏芽孢杆菌的适宜接种量约为5%。
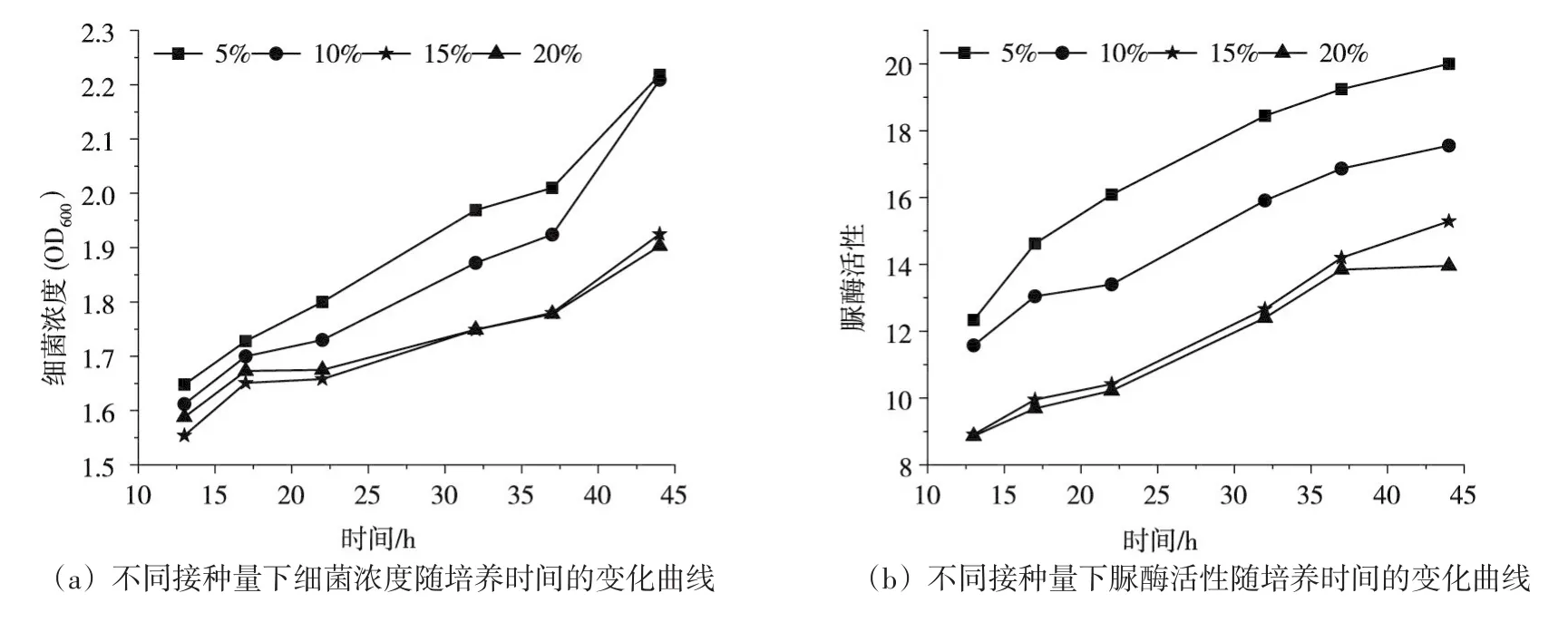
图3 不同接种量下细菌浓度和脲酶活性随培养时间的变化曲线
4.1.4 培养基种类的影响 试验选取ATCC 1376 NH4-YE推荐的培养基(A)和北纳创联生物技术推荐的培养基(B)两种培养基进行扩大培养,对比两种培养基在相同培养环境下,细菌浓度和脲酶活性的变化,获得适合巴氏芽孢杆菌扩大培养的培养基。
图4为A、B两种培养基的细菌浓度和脲酶活性随培养时间的变化曲线。由4图可知,A、B两种培养基的细菌浓度差距不明显,但A类培养基的脲酶活性比B类的高87.7%。同细菌浓度下,脲酶活性越强其尿素水解能力越强,得到A类培养基更适合作为巴氏芽孢杆菌的培养基进行扩大培养。
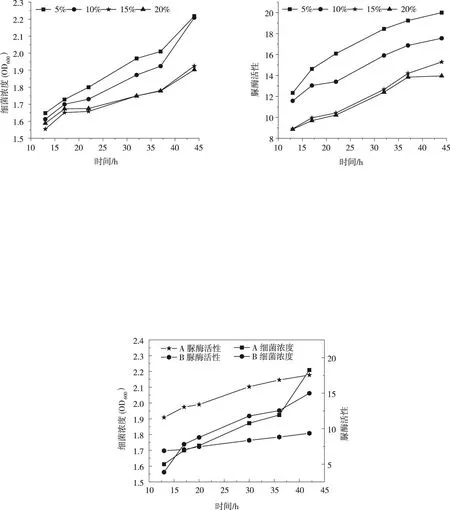
图4 不同培养基下细菌浓度和脲酶活性随培养时间的变化曲线
4.2 微生物诱导碳酸钙生成量的影响因素研究 尿素水解过程中,微生物充当催化剂的作用,主要反应物为(CO(NH2)2)和Ca2+主要产物为CaCO3。微生物菌种数量和脲酶活性在一定程度上影响脲酶水解尿素的能力,但并非起决定性作用。尿素和Ca2+浓度、菌液与胶结液配比、养护天数和养护温度等均会影响脲酶水解生成碳酸钙的量,从而影响微生物加固土体的效果。
图5为不同影响因素下,微生物诱导碳酸钙生成量和无侧限抗压强度的变化曲线。从碳酸钙含量曲线可得前7 d碳酸钙生成量增长较快,基本呈线性增长后逐渐趋于稳定。这是因前期菌液没能充分水解尿素,随着时间的递增,尿素水解逐渐增多,养护7 d后,尿素已基本水解完成,碳酸钙新生成量变化并不明显。在不同温度养护条件下,温度为25℃~30℃的碳酸钙生成量最多,这是因为该微生物适合生长繁殖的温度环境为25℃~30℃,在适宜温度环境下,微生物的脲酶活性强,诱导尿素水解的能力也得到提升,从而提高尿素水解效率,获得更多的(NH4+),结合Ca2+生成更多的碳酸钙。在菌液与不同胶结液浓度等体积混合条件下,可以看出碳酸钙生成量与胶结液浓度成正相关关系,随着胶结液浓度的增加而增强。但是浓度过高可能改变微生物生长环境,影响脲酶活性,抑制尿素水解,胶结液浓度应可根据脲酶活性强弱适当增加或降低。在不同菌液与胶结液配比条件下,由图5可知,随着胶结液体积的减少,碳酸钙生成量逐渐降低。从胶结液浓度和菌液与胶结液配比试验结果可以看出,在保证微生物脲酶活性的条件下,微生物诱导生成碳酸钙的量随(CO(NH2)2)和Ca2+含量的增加而增加。结合无侧限抗压强度曲线可以得到,不同影响因素下,抗压强度与碳酸钙含量均呈正相关,微生物诱导生成的碳酸钙含量越多,土颗粒胶结越好,土体孔隙减小,微生物加固土的强度越高。
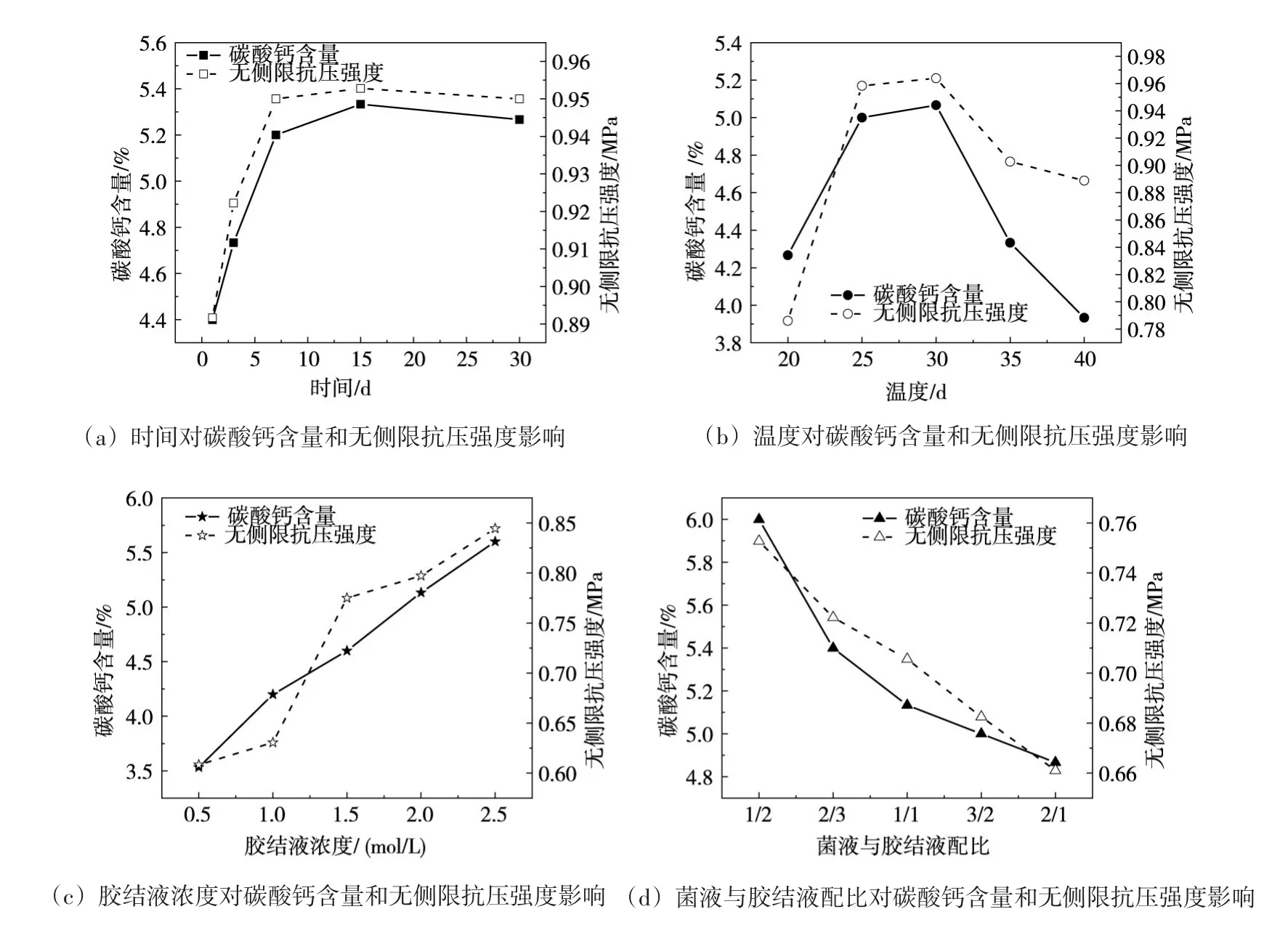
图5 不同影响因素下碳酸钙含量和无侧限抗压强度的变化曲线
4.3 微生物加固黏土无侧限抗压强度的应力-应变曲线 不同影响因素下无侧限抗压强度的应力-应变曲线变化趋势基本一致,现以不同养护时间下,微生物加固黏土无侧限抗压强度的应力应变曲线为例(1 d、3 d…30 d表示养护天数),取应力应变曲线中峰值应力为峰值强度,峰值应力对应的应变为破坏应变进行分析。由图6可知,随着培养时间的增加,峰值强度逐渐增高。与重塑黏土相比,养护3 d后的微生物加固土的无侧限抗压强度可提升约48%,养护7 d可提升约52%,便于施工养护3天即可。随着峰值强度的增加,破坏应变逐渐减小,由重塑土的11%降低到3%左右,破坏应变降低约70%。当土体应力达到峰值破坏后,重塑黏土应力下降缓慢,微生物加固黏土应力下降速迅速,说明微生物加固黏土增强了土的脆性。
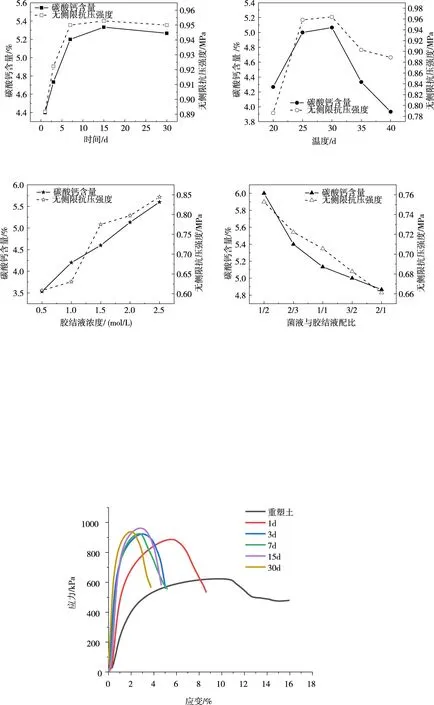
图6 不同养护天数下重塑黏土与微生物加固黏土无侧限抗压强度的应力—应变曲线
4.4 微生物加固土的微观分析 采用扫描电镜和X射线能谱仪相结合的方法,进一步了解微生物诱导碳酸钙的形貌以及加固后化学成分变化。如图7为1000倍数下重塑黏土的SEM图,可以看出土体孔隙较多,通过对该区域进行EDS分析,发现该区域Ca元素的原子含量仅有0.41%,说明重塑土中Ca元素存在极少。图8(a)为菌液和胶结液直接混合后生成碳酸钙放大500倍的SEM图,可以看出微生物诱导生成的碳酸钙为球状的霰石晶体。图8(b)放大到2000倍发现类似“鳞片”状的晶体。图9(a)为微生物加固土局部放大2000倍下的微观图,可以看出土体的密实比较好,孔隙相比重塑黏土少了许多。图9(b)是在图9(a)的基础上放大到5000倍,可以更加清楚的看到土体表面及颗粒间形成大量晶体,大小、形态多不规则,通过对孔隙填充部分(图中标记处)进行EDS分析,发现Ca元素的原子含量为2.59%,推测填充物为碳酸钙。

图7 重塑土的SEM和EDS图

图8 微生物诱导生成碳酸钙的SEM和EDS图

图9 微生物加固土的SEM和EDS图
采用PCAS图像处理软件,对放大2000倍重塑黏土和微生物加固土的SEM图像进行孔隙定量分析[22],如图10所示,获得相关参数见表4。可以发现,阈值越大,孔隙面积越大;相同阈值下,微生物加固黏土的孔隙面积比例、平均长度、平均宽度和平均面积相比重塑黏土均有所减小,孔隙度分布分形维数有所提高,在孔隙度相同的情况下,该分维数越大,样品的抗压强度越高[23]。

图10 经PCAS处理后的二值图和孔隙分布结果图
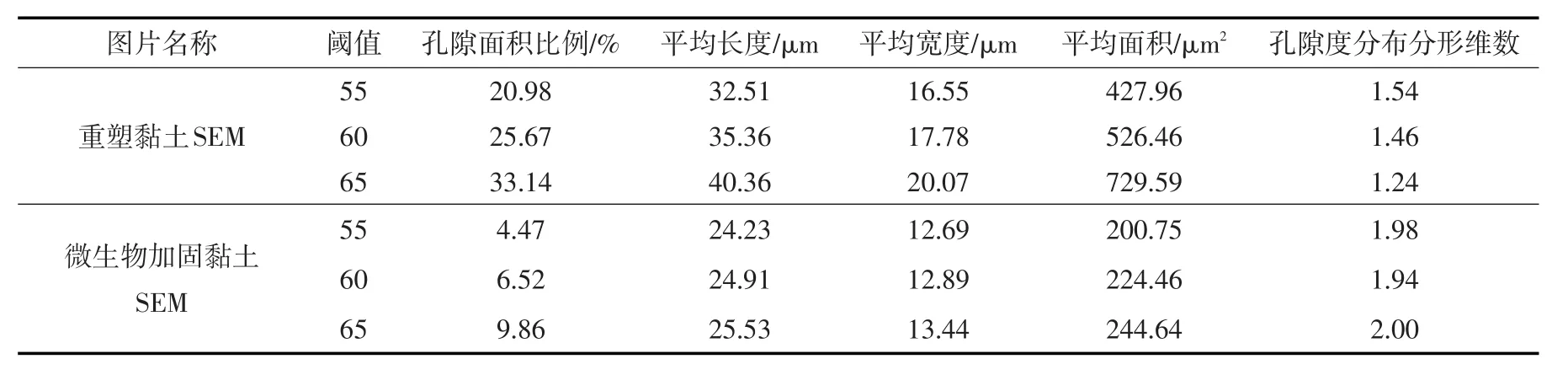
表4 黏土微观结构定量分析结果
微生物新陈代谢产生的高活性脲酶将尿素水解成铵根离子(NH4+)和碳酸根离子(CO32-),结合胶结液提供的Ca2+,便会在土颗粒之间以及表面形成胶结物碳酸钙,从而填充颗粒之间的缝隙,实现了颗粒之间的胶结,增加了土体的密实度以及颗粒之间的摩擦力和黏聚力,提高土体强度。其基本原理与微生物加固砂土类似,而黏土颗粒和孔隙小,渗透性低,通过灌浆的方式将菌液和胶结液加入到土体中很难迁移和分散不均匀,固化后的强度远低于重塑土的强度,采用拌合碾压的方式可以有效提高微生物加固黏土的强度。
5 结论
通过对巴氏芽孢杆菌培养过程中不同影响因素下菌液脲酶活性和浓度以及微生物加固后的黏土试样无侧限抗压强度和碳酸钙生成量的试验,以及对微生物加固黏土的微观分析。得出以下结论:
(1)微生物加固黏土与加固砂土的区别在于黏土颗粒和孔隙小,渗透性低,通过灌浆的方式将菌液和胶结液加入到土体中很难迁移和分散不均匀,固化后的强度远低于重塑土的强度,采用拌合碾压的方式可以有效提高微生物加固黏土的强度。
(2)细菌活性和浓度的主要影响因素包括培养基种类、培养温度、pH值和接种比例。A组培养基更适合巴氏芽孢杆菌的扩大培养;适宜接种比约5%,当接种量越多,细菌浓度和脲酶浓度反而越小;较佳培养温度为25℃~30℃,温度过低会影响细菌各种生化反应的协调一致性,从而降低细菌的新陈代谢,抑制其生长繁殖的速度,温度过高可能会改变细菌的形态和代谢等,导致细菌死亡;pH值8~10为巴氏芽孢杆菌较佳生长环境,巴氏芽孢杆菌适合在弱碱环境中生长繁殖,酸性和强碱环境下微生物活性降低甚至死亡。
(3)碳酸钙生成量的主要影响因素包括养护温度、养护天数、胶结液浓度和胶结液比例。微生物加固土的较佳养护温度为25℃~30℃;碳酸钙生成量随养护时间增加逐渐增多,7 d后因尿素水解达到最大,碳酸钙生成量趋向稳定;影响碳酸钙生成的主要影响因素为胶结液,胶结溶液的浓度和比例影响微生物的生长和代谢以及沉淀碳酸钙的生成。在一定脲酶活性条件下,生成碳酸钙的量与胶结液浓度成正相关。
(4)微生物加固黏土的无侧限抗压强度随碳酸钙生成量增加而增强。相比重塑黏土,微生物加固黏土养护7 d的无侧限抗压强度可以提升52%,破坏应变降低高达70%。

