磁共振成像测量的浸润深度与舌鳞状细胞癌患者颈部淋巴结转移的相关性研究
李明 原振英 南欣荣
山西医科大学第一医院口腔科 太原030001
舌鳞状细胞癌是口腔中最为常见的鳞状细胞癌,国际上认为其是第8位致死性肿瘤[1]。舌鳞状细胞癌具有较强的颈部淋巴结转移倾向,并且常发生隐匿性颈部淋巴结转移,转移率约20%~30%[2]。至今仍缺乏能在术前确诊颈部淋巴结内的微小隐匿性转移的检查方法[3]。因此,当治疗临床颈部淋巴结阴性(cN0)的舌鳞状细胞癌病变时,对是否行同期颈部淋巴结清扫术存在争议,一些学者认为只有术后组织病理检查才能确定有无颈部淋巴结转移,致使一部分未转移的患者接受了过度的颈部淋巴结清扫术,也有学者认为cN0期舌鳞状细胞癌患者可随访观察,不必行同期颈部淋巴结清扫以免破坏阻止癌症扩散的天然屏障,但这样又使一部分发生隐匿性转移的舌鳞状细胞癌患者失去了最佳的治疗时机[4]。因此,寻找术前预测颈部淋巴结转移的因素尤为重要。浸润深度(depth of invasion,DOI)是口腔癌TNM分期中新增加的指标。研究[5-7]表明,舌鳞状细胞癌浸润深度是预测其发生颈部淋巴结转移的重要参考因素。由于磁共振成像(magnetic resonance imaging,MRI)可在术前直观快速的获取舌鳞状细胞癌DOI,且目前已有较多研究发现MRI测量的舌鳞状细胞癌DOI与病理DOI有较好的一致性和相关性[8-9],因此本实验通过分析MRI测量的DOI与cN0期舌鳞状细胞癌患者颈部淋巴结转移之间的关系,探讨MRI测量的DOI是否可作为cN0期舌鳞状细胞癌患者颈部淋巴结转移的独立预测因素。
1 材料和方法
1.1 研究对象
收集2014年4月—2020年4月在山西医科大学第一医院口腔颌面外科就诊的舌鳞状细胞癌患者,经纳入标准和排除标准选择,共纳入61例cN0患者,其中男性33人,女性28人,年龄(58±14)岁。
纳入标准:1)经病理证实的舌鳞状细胞癌患者;2)触诊及影像学检查未发现颈部肿大的淋巴结;3)肿瘤原发于舌体;4)手术均行原发灶切除+功能性颈部淋巴结清扫。
排除标准:1)术前未行MRI检查或图像无法测量的患者;2)口腔内有金属义齿或大面积牙内金属充填材料影响测量者;3)影像检查前行活检及放、化疗的患者;4)既往有其他部位恶性肿瘤史;5)患者影像学检查中体位或头偏斜者。
1.2 方法
1.2.1 MRI技术 使用的Signa HDxt MR设备(GE公司,美国)均为3-Tesla(T)场强和八通道正交头颈部线圈,扫描方案包括T1(TR 900 ms/TE 17 ms)和T2(TR 5 000 ms/TE 99ms)获得横断位、冠状位及矢状位加权图像和T1(TR 700 ms/TE 13.7 ms)冠状位增强后的脂肪抑制图像,以及T2(TR 5 830 ms/TE 99 ms)轴向和冠状脂肪抑制图像。切片厚度3 mm,0.3 mm片隙;视野180×180;矩阵240×174。静脉注射对比剂Gd-DTPA,剂量为0.1 mmol·kg-1,在T1加权成像上获得横断面、矢状面和冠状面图像。
1.2.2 DOI 测量方法 影像图片以DICOM格式导入syngo.via软件后,由两名影像科评估者分别在核磁T1加权像冠状位或横断位中测量肿瘤的最大DOI,必要时结合脂肪抑制,DOI测量方法为:连接肿瘤与其最邻近的正常黏膜的交点的连线,测量该连线至肿瘤浸润最深处的垂直距离,对于外生型舌鳞状细胞癌,忽略超过水平线的部分;对于溃疡型舌鳞状细胞癌,增加低于水平线的部分(图1)。对于有争议的数据经两名影像科医生商讨后得出最终结果。对于MRI上无肿瘤显示的患者最大DOI记为0 mm。
1.3 病理参数的判定
1.3.1 颈部淋巴结结状态的判断 所有患者均行原发灶切除和功能性颈部淋巴结清扫,切取的淋巴组织经10%甲醛溶液固定后送至病理科检查。病理科医生将标本中颈部淋巴结结分离,对于尺寸大于0.5 cm的淋巴结间隔3~5 mm切开,对直径小于0.5 cm淋巴结沿最大横径切开并制备石蜡病理切片,行苏木精-伊红染色后在光学显微镜下检测有无癌转移。
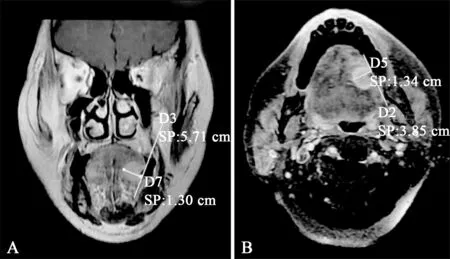
图1 MRI测量舌鳞状细胞癌DOI示意图Fig 1 The schematic diagram of DOI measurement of tongue squa‐mous cell carcinoma
1.3.2 神经侵犯及脉管癌栓的判断 为了准确评估患者的神经侵犯情况,神经侵犯的判定结合了患者的临床表现及病理结果,即患者有舌麻木或舌运动受限症状,或病理中肿瘤细胞接近神经周长的1/3和(或)肿瘤细胞侵犯了神经鞘,则判定为神经侵犯。当淋巴管、静脉或动脉通道内发现明显肿瘤细胞团块时,判定为淋巴管或血管出现脉管癌栓。
1.4 统计学处理
采用统计软件SPSS 22.0分析数据,采用单因素Logistic回归分析MRI测量的DOI及其他临床病理因素与颈部淋巴结转移的相关性,若筛选出有统计学意义的因素则纳入多因素Logistic回归分析。采用独立样本t检验比较颈部淋巴结转移组和未转移组MRI测量的DOI的差异,以双侧P<0.05为差异有统计学意义。采用受试者工作特性(re‐ceiver operating characteristic,ROC)曲线确定预测颈部淋巴结转移的最佳DOI截止值。
2 结果
根据病理报告结果,61例患者中19例患者颈部淋巴结阳性(pN+),42例患者颈部淋巴结阴性(pN0),隐匿性颈部淋巴结转移率为31%。
2.1 cN0 期舌鳞状细胞癌患者颈部淋巴结转移的相关因素分析
根据美国癌症联合委员会提出的DOI分类,61名患者中,MRI测量的DOI≤5 mm的患者有11人,5 mm

表1 cN0 期舌鳞状细胞癌患者颈部淋巴结转移的单因素Logistic回归Tab 1 Univariate logistic regression of neck lymphatic metastasis of cN0 tongue squamous cell carcinoma
2.2 cN0 期舌鳞状细胞癌患者颈部淋巴结转移的多因素分析
将单因素分析中MRI测量的DOI、肿瘤T分期和神经侵犯因素纳入二元Logistic多因素回归分析(表2),结果表明仅MRI测量的DOI与颈部淋巴结转移有相关性(P<0.05),MRI测量的DOI可作为预测cN0期舌鳞状细胞癌患者颈部淋巴结转移的独立因素。

表2 cN0期舌鳞状细胞癌患者颈部淋巴结转移的多因素Logistic回归Tab 2 Multivariate logistic regression of neck lymphatic metastasis of cN0 tongue squamous cell car‐cinoma
2.3 MRI 测量的DOI 与cN0 期舌鳞状细胞癌患者颈部淋巴结转移的相关性
MRI测量的61例舌鳞状细胞癌患者的DOI为(10.4±4.8)mm,其中pN+组患者MRI测量的DOI范围为7.3~16 mm,平均值为(13.2±4.3) mm,pN0患者MRI测量的DOI范围为0~19 mm,平均值为(9.1±4.5)mm,两者差异有统计学意义(T=3.36,P=0.001)。
61例患者中,DOI≤5 mm的11例舌鳞状细胞癌患者只有1人发生颈部淋巴结转移,转移率为9%;5 mm
2.4 预测cN0 期舌鳞状细胞癌患者颈部淋巴结转移的DOI截止值
统计分析MRI测量的DOI与颈部淋巴结转移关系的ROC曲线,ROC的曲线下面积为0.75(95%CI:0.621~0.879,P=0.002),MRI测量的DOI预测颈部淋巴结转移的最佳截止值为5.1 mm。以MRI测量的DOI=5.1 mm为截止值,61例患者的颈部淋巴结转移状况如表3所示,DOI≤5.1 mm的患者有12例,其中11例患者未发生颈部淋巴结转移,真阴性率(特异度)为92%;DOI>5.1 mm的患者有49例,其中18例患者发生颈部淋巴结转移,真阳性率(灵敏度)为37%。
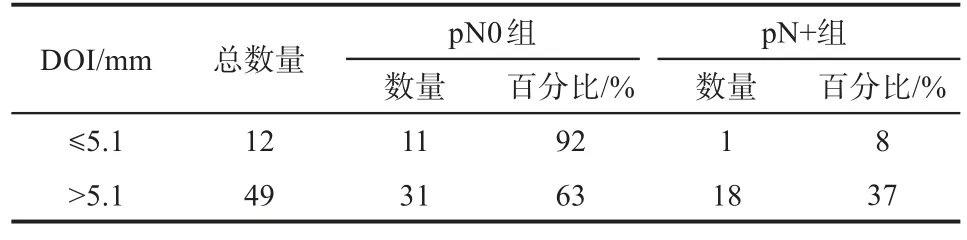
表3 MRI测量的DOI与颈部淋巴结转移的关系Tab 3 The relationship between the MRI invasion depth and cervical lymph node metastasis
3 讨论
舌鳞状细胞癌在MRI中多表现为不规则团块,在T1加权像中多表现为较低的信号影,边界较规则,对舌肌形态和肌纤维间的脂肪显像清晰[10-12]。T2加权像对舌鳞状细胞癌成像特点多为不均匀的较高信号影,对舌肌为低信号影,其中舌黏膜多呈线状的高信号影。因核磁T2加权成像测量的舌鳞状细胞癌DOI易混淆肿瘤与黏膜表面的炎症和水肿[13],本研究均采用T1加权成像测量肿瘤DOI。
本研究将MRI测量的DOI及患者相关的临床病理因素(年龄、肿瘤部位、肿瘤T分期、肿瘤分化、神经侵犯)进行单因素回归分析,发现MRI测量的DOI、T分期和神经侵犯与cN0期舌鳞状细胞癌患者颈部淋巴结转移有相关性。对于舌鳞状细胞癌T分期,已有较多文献表明随着舌鳞状细胞癌T分期增加,颈部淋巴结转移率随之增加[14-15]。此外,在Yang等[16]的研究中,同样得出神经侵犯是预测舌鳞状细胞癌患者颈部淋巴结转移的相关因素之一。对于MRI测量的DOI,Mücke等[17]的前瞻性研究与本结果相同,均证明了MRI测量的DOI与颈部淋巴结转移有相关性。在多因素分析中,仅MRI测量的DOI是预测颈部淋巴结转移的独立因素,这与一些学者[18]的研究结果一致。这些研究的结果均表明了DOI是预测舌鳞状细胞癌患者颈部淋巴结转移的独立参考因素。
MRI测量的pN+患者DOI范围为7.3~16 mm,pN0组DOI范围为0~14 mm,其中1例患者在MRI中未观察到肿瘤存在,DOI记为0 mm,该患者未发生颈部淋巴结转移。MRI测量的pN+组患者DOI均值较pN0组患者均值高4.6 mm,两组患者测量的DOI差异明显。Jung等[19]在对早期舌鳞状细胞癌DOI与颈部淋巴结转移关系的研究中同样发现MRI测量的pN+组与pN0组患者DOI差异有统计学意义,两组差值平均为3.1 mm。此结果与本研究结果相差不多,并且该研究同样表明了MRI测量的DOI与舌鳞状细胞癌患者的颈部淋巴结转移率呈正相关性,即随着肿瘤DOI加深,颈部淋巴结阳性的患者增多,转移率增高。
本研究中,ROC曲线中预测舌鳞状细胞癌患者颈部淋巴结转移的DOI截止值是5.1 mm,对应的特异度和灵敏度分别为92%和37%。统计分析出的ROC曲线下面积为0.75,证明MRI测量的DOI对颈部淋巴结转移的预测效果尚可。已有一些文献报道了MRI测量的DOI或肿瘤厚度预测的舌鳞状细胞癌患者颈部淋巴结转移的截止值。Kwon等[20]采用核磁T2加权像测量了横断位、冠状位和矢状位的舌鳞状细胞癌肿瘤厚度,预测舌鳞状细胞癌患者颈部淋巴结转移的肿瘤厚度最佳截止点分别为6.7、7.2和12.3 mm。Goel等[21]同样采用MRI测量了舌及颊鳞状细胞癌患者的肿瘤厚度,当截止值为3 mm时,真阴性率为88%,同时该研究认为,通过MRI测量的肿瘤厚度较病理测量结果有平均1.62 mm的高估。以上两者的研究中测量的对象均为肿瘤厚度,而DOI不同于肿瘤厚度在于其不包含外生型肿瘤的外生部分,同时也增加了溃疡型肿瘤凹陷的深度,更客观准确地描述出肿瘤靠近血管和淋巴管的距离,预测颈部淋巴结转移更为可靠。此外,Park等[22]研究了49例舌癌患者,采用1.5T场强的MRI确定的DOI截止点为9.5 mm,与本研究确定的DOI截止值5.1 mm相差较大,分析原因为该研究包含了较多T4分期患者以及不同N分期患者,且该研究中舌鳞状细胞癌DOI的MRI测量方法并不标准,测量的是肿瘤最大直径而不是实际DOI。本研究在以上研究的基础上完善了DOI的MRI测量方法,并且所有患者均采用3T场强MRI,高的磁场强度会产生高的信噪比、磁化对比度和光谱分辨率,测量的DOI更为准确[23]。
本研究结果也具有一定的局限性。首先,本研究是回顾性研究,对术后颈部淋巴结的检测方法不够严谨。有研究[24]显示,对可能发生隐匿性转移的淋巴结应采用连续切片和CK染色检测。其次,本研究缺乏患者的远期随访资料,只能认为MRI测量的DOI>5.1 mm时,cN0期舌鳞状细胞癌患者发生颈部淋巴结转移的风险增加,因此在今后的研究中,笔者将收集相关随访资料来进一步研究。
综上所述,MRI测量的DOI是预测cN0期舌鳞状细胞癌患者颈部淋巴结转移的独立参考因素,当MRI测量的DOI>5.1 mm时,cN0期舌鳞状细胞癌患者发生颈部淋巴结转移的风险增加。
利益冲突声明:作者声明本文无利益冲突。

