寡糖链检测对HBV相关性肝细胞癌的诊断价值
李芳芳 翁亚丽 李响 王茜 浦立勇 刘凌翔 杨芬 孙阿雷
亚洲尤其是在我国,70%~90%的肝癌是因乙型肝炎病毒(HBV)感染引起的[1]。而甲胎蛋白(alpha -fetoprotein,AFP)、α-L-岩藻糖苷酶、异常凝血酶原等基于血清的分子标志物检测,其效能尚不能满足临床需求。在健康状态下血液中的糖蛋白上连接的寡糖结构是相当稳定的,各寡糖的相对含量也基本固定。肝癌发生时,肝脏的糖蛋白合成代谢将会有所改变,表现在寡糖结构和含量上的变化[2]。本研究通过检测肝癌组和非肝癌对照组中血清糖蛋白的寡糖链组分的相对浓度,研究其与肝癌的相关性,评价寡糖链检测(Glycan-Test,G-Test)用于诊断HBV相关性肝细胞癌(HCC)的临床价值。
资料与方法
一、研究对象
收集2017年2月至2018年8月就诊于南京医科大学第一附属医院435名受试者的血清及相关资料,共分为五组,其中健康对照组(healthy controls ,HC)80例、慢性乙型肝炎(chronic hepatitis B,CHB)组105 例、乙型肝炎肝硬化(liver cirrhosis ,LC)组60例、其他器官恶性肿瘤组70例,HCC组120例。HCC组的病理诊断基于《原发性肝癌诊疗规范(2011年版)》,临床诊断主要依据血清AFP水平、肝脏超声(ultrasonography,US)、肝脏增强计算机断层成像(computed tomography,CT)、肝脏增强磁共振成像(magnetic resonance imaging,MRI)等。慢性乙型肝炎组及肝硬化组的诊断依据《慢性乙型肝炎防治指南(2015版)》。其他脏器恶性肿瘤组的入选标准根据各肿瘤临床诊断指南或标准。健康对照组选取体检中心80名排除已知的良性或恶性疾病、外表正常、无任何可见疾病症状的人。排除标准包括:①合并丙型肝炎病毒(hepatitis,HCV)、人类免疫缺陷病毒(human immunodeficiency virus,HIV)、Epstein-Barr(EB)病毒及巨细胞病毒(cytomegalovirus)感染、酒精性肝病、自身免疫性肝炎的患者的血清样本;②样本收集时间或病例信息不明确;③试验操作中因失误导致样本量不足检测的样本。本研究经南京医科大学第一附属医院伦理委员会批准。
二、标本采集及检测
使用寡糖链检测试剂盒,参照说明书,测定血清样本中寡糖链的含量即指纹图谱(G-Test 图谱),通过计算分析出寡糖组分的相对含量关系(G值)与肝癌的相关性:G≥5 时, 判定结果为阳性;G<5时, 判定结果为阴性。AFP的检测使用Roche Cobas e602电化学发光分析仪(德国罗氏公司),检测血清样本中AFP含量,参考值范围:<20 ng/mL。
三、统计学分析
计量资料以中位数(四分位间距)表示,多组间比较采用Kruskal-WallisH检验;计数资料用百分比(%)表示,用卡方检验进行比较;用受试者操作特征(receiver operating characteristic,ROC)曲线评价G值和AFP的诊断价值,建立联合检测G值和AFP的Logistic回归模型;ROC曲线下面积(area under curve,AUC)的比较采用Z检验;P<0.05为差异具有统计学意义。采用SPSS 25.0软件进行统计分析。
结 果
一、纳入人群的人口学特征
慢性乙型肝炎、肝硬化和肝癌患者血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)水平明显高于健康对照组及其他恶性肿瘤(P均<0.001),血小板(platelets,PLT)水平明显低于其他两组 (P均<0.001);而白蛋白(albumin,ALB)在肝癌组、其他肿瘤组及肝硬化患者中显著下降(P<0.001);肝硬化组的总胆红素(total bilirubin,TBIL)水平明显高于其他四组(P均<0.001)。血清甲胎蛋白水平≥2 0 ng/L及G≥5的阳性率均以肝癌最高(P<0.0 01)(表1)。
二、不同组别患者血清中寡糖链组分相对含量的比较
HCC组的G值[6.56(5.70~7.38)]显著高于其他恶性肿瘤组[3.57(2.76~4.16)]、肝硬化组[3.38(2.87~4.35)]、肝炎组[3.30(2.57~3.99)]及正常健康组[2.82(2.28~3.65)](P均<0.001)。此外,肝硬化组与正常健康组的G值差异也具有统计学意义(P<0.05)(图1)。
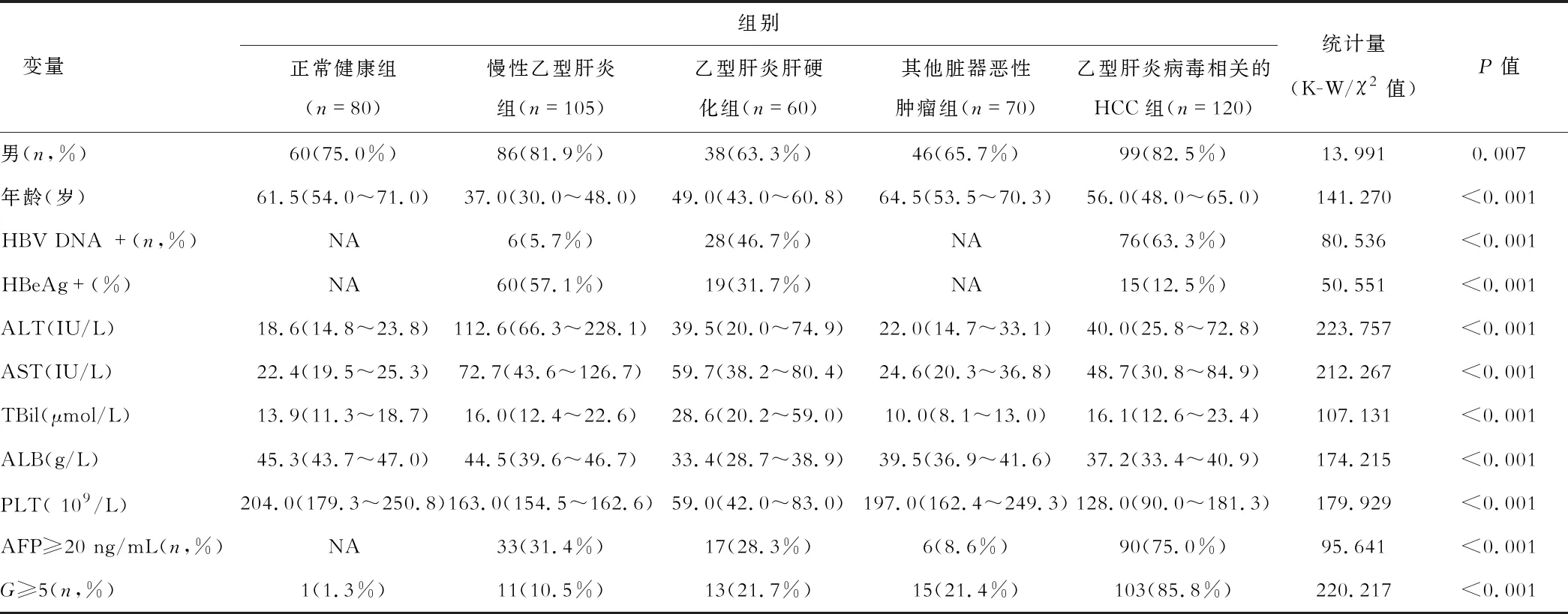
表1 研究人群的临床基线资料
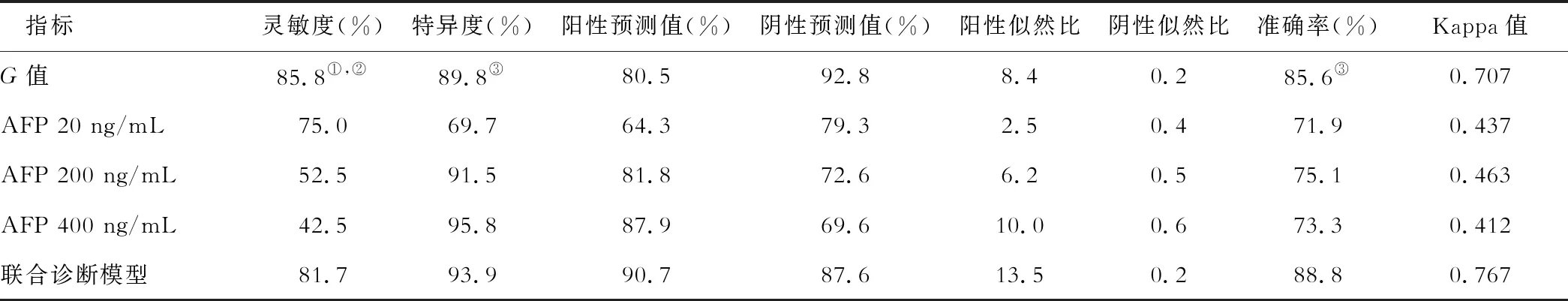
表2 G-Test、血清AFP水平、及联合检测鉴别诊断HBV相关性HCC与良性肝病的诊断价值
①表示G值与AFP 200 ng/mL相比,P<0.001;②表示G值与AFP 400 ng/mL相比,P<0.001;③表示G值与AFP 20 ng/mL相比,P<0.05

注:*为P<0.001
三、血清中寡糖链组分含量相对关系诊断肝癌的价值及其与甲胎蛋白的相关性比较
将CHB组与LC组合并为良性肝病组(benign liver diseases,BLD),分析得出BLD组与HCC组血清寡糖链组分含量相对关系(G值)与甲胎蛋白呈正相关(斯皮尔曼相关系数0.327,P<0.001)。采用Logistic回归分析建立联合诊断模型,模型的预测概率保存在Logistic回归分析中,并作为新的变量进入ROC曲线分析;构建出G值、AFP单独检测及两者联合检测在鉴别诊断良性肝病与HBV相关性HCC的ROC曲线 (图2)。血清中寡糖链组分含量的相对关系单独检测在鉴别HBV相关性肝癌和慢性乙型肝炎的AUC值(0.882,95%CI0.839~0.917 )高于甲胎蛋白单独检测(0.801,95%CI0.750 ~ 0.846,P<0.05),差异具有统计学意义。联合检测与甲胎蛋白单独检测相比,AUC值显著升高(0.928[95%CI0.891~0.845] VS 0.801[95%CI0.750~0.846];P<0.001)。
四、诊断指标评估
评估指标包括敏感度、特异度、阳性预测值、阴性预测值、阳性似然比、阴性似然比、准确率与Kappa值(表2)。与AFP单独检测常用界值20、200、400 ng/mL相比,G值的诊断敏感性分别从75.00%、52.50%、42.50%提高到85.83%,并且其差异均有统计学意义(P<0.05)。准确率分别从71.93%、73.33%和75.09%提高到85.61%(其中,85.61%与71.93相比,P<0.05)。联合诊断的Kappa值为0.767,G值的Kappa值0.707。
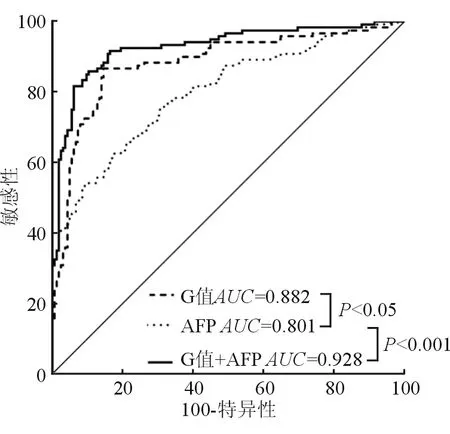
图2 G值、AFP以及基于Logistic回归分析的联检测模型受试者操作特征(ROC)曲线在鉴别HBV相关性肝癌组和良性肝病组(慢性乙型肝炎组+乙型肝炎肝硬化组)中的诊断价值。
五、通过ROC曲线分析G-Test在鉴别不同组别人群的诊断价值
G-Test在鉴别诊断乙型肝炎病毒相关性HCC组与非HCC组的AUC值为0.886 (95%CI0.847~0.925),在鉴别肝癌组与正常健康组、肝癌组与慢性乙型肝炎组、肝癌组与乙型肝炎肝硬化组及肝癌组与其恶性肿瘤组的AUC值分别是0.938(95%CI0.896~0.968)、0.897(95%CI0.849~0.933)、0.857(95%CI0.798~0.905)及0.834(95%CI0.771~0.896)。
六、G-Test及不同界值的AFP对不同分期HCC患者的检测灵敏度的比较
根据中国肝癌的分期方案(China liver cancer staging,CNLC)对肝癌组患者进一步分层[3-4],其中早期(Ⅰ-Ⅱa期)患者有90例,中晚期(Ⅱb-Ⅳ期)患者有30例。在早期患者的诊断中,G-Test的灵敏度与AFP界值为20 ng/mL相比,差异具有统计学意义(P<0.05);此外,G-test的灵敏度显著高于AFP界值200 ng/mL及400 ng/mL(P<0.001)(如表3)。在晚期肝癌的诊断中,G-Test与AFP值常用的界值检测灵敏度无明显差异(P=0.111)。
七、G-Test在AFP阴性肝癌患者的检测敏感度
分别以常用AFP水平20、200、400 ng/mL为界值,AFP阴性患者分别有30例、57例及69例,G-Test在AFP阴性患者中的检测灵敏度分别为90.00%、87.72%、86.96%。
讨 论
对慢性HBV感染者定期监测,有利于尽早发现肝癌,然而迄今为止尚无通过血液快速准确诊断肝癌的检测技术。研究发现,多种癌症与异常的糖基化相关,临床上一些常用于癌症诊断、监测及评估预后的生物学标志物即为糖蛋白[4-7]。
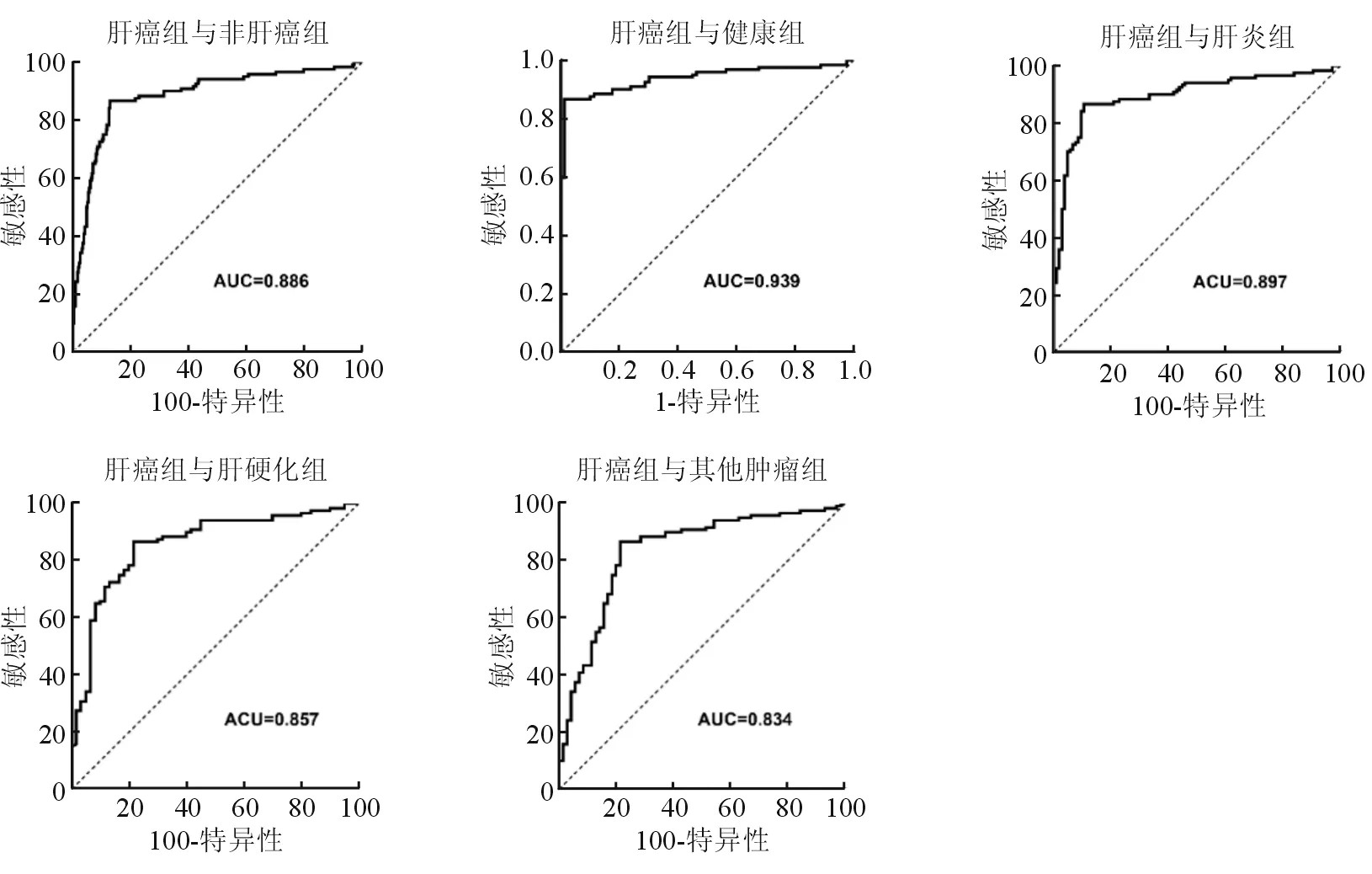
图3 G-Test在鉴别不同组时的ROC曲线

表3 G-Test及AFP对不同分期的肝癌检测敏感度
在本研究中,使用荧光毛细管电泳法测定五组不同人群血清中寡糖链相对含量并绘制图谱,继而计算分析出血清中寡糖链组分的相对含量关系,即G值;当G≥5时结果为阳性。检测仅需2μL血清,进行微观分子结构层面的、高通量的血液糖蛋白寡糖链指纹图谱分析,快速得出诊断结果。笔者发现肝癌组G值阳性率显著高于其他四组。此外,肝硬化组与正常健康组的G值也存在显著差异,可能是与肝硬化患者血清中异常的糖基化相关[2, 8]。 既往已有研究证实肝癌及其他肝病患者体内存在寡糖链组分及含量的变化,并且依据寡糖链图谱建立了诊断模型(如Glyco Cirrho Test及Glyco HCC Test等),具有良好的诊断效能[9-13]。
目前,临床上应用的传统肝癌血清学标志物主要是AFP,然而其敏感性较低,限制了其临床实用性。值得关注的是,本研究中,G-Test的灵敏度从400ng/ml的AFP临界值的42.50%显著提高到85.83%,并且与AFP临界值20、200ng/ml相比,差异均具有统计学意义。说明G-Test在提高肝癌诊断的灵敏度方面具有一定的优势,但仍需要进一步地扩大样本量来验证。血清中AFP在鉴别诊断肝癌与慢性肝病患者(CHB及LC组患者)的ROC曲线下面积为0.801。为进一步评价G-Test及其与甲胎蛋白的联合诊断价值,采用Logistic回归分析建立联合检测模型。以上结果表明,G-Test的AUC显著高于AFP(P<0.05),而联合检测也显著提高了AUC(P<0.001)。这提示G值可作为肝癌无创性诊断指标,与AFP联合诊断时,诊断效能更佳。此外,与AFP单独检测(20、200、400 ng/mL)相比,联合检测的Kappa值分别由0.437、0.463、0.412提高到0.767。说明联合诊断与临床诊断有较好的一致性。
我国AFP阴性的HCC患者高达30%~40%[3],与本研究基本一致,本研究中AFP阴性的HCC患者约占25.00%。G-Test对AFP阴性的HCC患者有较好的灵敏度。提示G-Test可能成为AFP阴性HCC患者的有效血清学检测方法。将肝癌组按CNLC标准分期后,进一步发现G-Test对早期患者的检测灵敏度显著高于AFP,表明G-Test可提高早期肝癌的诊断率。
在针对不同组别患者的诊断时,血清中寡糖链组分的相对含量值也表现较高的诊断效能,这与相关报道研究结果一致[9, 13]。且在本组数据中,G-Test与AFP呈正相关,在肝癌诊断方面可相互补充,提高HCC的诊断率。
本研究尚且存在一些局限性:一是样本量比较小,所得结论有待于继续扩大样本量进行验证;二是G-Test能否进一步提高早期肝癌的诊断率,肝癌患者血清中寡糖链组分的相对含量水平变化与肝癌患者预后其复发风险之间是否存在关联等问题,需要进一步研究阐明。

