基于有效基准特征图谱质量表征的甜叶菊饮片质量评价研究
高园园 范圆圆 刘路路 陈思玉 李思潼 潘锋 李林福 舒一崧 孙仁弟 黄广伟 姜艳艳 石任兵
甜叶菊SteviarebaudianaBertoni别名甜菊、糖草,为菊科Composite斯台比亚属Stevia多年生草本植物,原产于南美巴拉圭和巴西交界的高山草地,1977年在中国引进栽培成功[1]。文献表明,甜叶菊中含有ent-贝壳杉烯型二萜类、半日花烷型二萜及半日花烷型双降二萜类、黄酮类、挥发油类及其他三萜及甾体类,常用来作为甜味剂、药品辅料、矫味剂,用于食品保鲜与药品防霉,用来治疗高血压、糖尿病、肥胖及胃酸多伴有溃疡,用来预防龋齿等[2]。有文献对甜叶菊中萜类成分甜菊糖苷、莱鲍迪苷A等成分进行含量测定[3-4],对酚酸类成分绿原酸、异绿原酸A、异绿原酸B、异绿原酸C等成分进行含量测定[5-6],但尚未见有关特征图谱对甜叶菊饮片进行质量表征与质量评价的研究报道。
本文研究基于本课题组对甜叶菊降糖降脂药物体系及其有效部位制备工艺、质量表征研究积淀,发现苯乙醇苷类组分及其新成分TYJ-10:2-(4-羟基苯基)乙基-β-D-巢菜糖苷[2-(4-hydroxyphenyl)ethyl-β-vicianoside],并揭示了其药学架构主要化学类型,即在自然药学观理论指导下[7-10],发现了甜叶菊酚类有效部位(甜菊酚)的苯乙醇苷类,酚酸类和黄酮类成分为其主要的降血糖类药组分,阐明了甜叶菊降糖降脂有效部位及作用机制[11-14]。并基于本课题组创建的有效基准特征图谱质量表征与中药质量评价模式[15-16],以确定具有降血糖药效作用的甜叶菊饮片作为有效饮片基准,以具有降血糖活性[17]的特征代表性成分绿原酸及其含量作为质量表征基准点,采用课题组建立的甜叶菊饮片多指标性成分含量测定方法建立甜叶菊有效基准特征图谱[18-20],基于绿原酸对照品模拟基准点的有效基准特征图谱质量表征信息建立评价甜叶菊饮片的质量标尺,对其准确性进行佐证,并以14批待评价饮片的实测信息与换算信息比较,进一步对基准质量表征信息的准确性与应用可行性进行佐证。最终建立了基于甜叶菊有效基准特征图谱的质量表征模式,方法与质量评价应用,整体准确地表征甜叶菊饮片质量,为甜叶菊饮片的精准质量评价提供科学依据。
1 材料
1.1 仪器
Watersalliance型高效液相色谱仪,Waters2998PDA检测器,Empower软件系统,自动进样器;SartoriousBT25S型1/100000电子分析天平(北京赛多利斯仪器有限公司);SartoriusBT124S型1/10000电子分析天平(北京赛多利斯仪器有限公司);KQ-500DE超声波清洗器(昆山超声仪器有限公司);SHB-Ⅲ型循环水式多用真空泵(上海振捷实验设备);BuchiRotavaporR-220旋转蒸发仪(瑞士步琦有限公司)。
1.2 试剂与试药
甜叶菊饮片为菊科植物甜叶菊SteviarebaudianaBertoni的干燥叶,具体信息见表1,饮片标本现存于北京中医药大学中药化学系,其中实验样品编号T2为课题组药效试验中确定有降血糖活性的甜叶菊饮片S14(有效饮片基准),实验样品编号(Ti)与饮片信息编号(Si)不相对应。
TYJ-10(批号:201601-10-1),实验室自制,纯度98%(归一化法);TYJ-14(批号:201601-14-3),实验室自制,纯度98%(归一化法);红景天苷(批号:130815)、异绿原酸A(批号:130815)、异绿原酸C(批号:120920)均购自成都普菲徳生物科技有限公司(纯度≥98%);异绿原酸B(批号:P15M10L88488)、绿原酸(批号:Y24J7K16726)、槲皮苷(批号:P19D10F106420)、木犀草苷(批号:Y13J10H93050)均购自上海源叶生物科技有限公司(纯度≥98%);乙腈(色谱纯)购自Fisher Scientific公司;甲醇(分析纯)购自北京化工厂;磷酸(分析纯)购自北京化学试剂公司;娃哈哈纯净水购自杭州娃哈哈集团有限公司。
2 方法与结果
2.1 有效基准特征图谱质量表征方法的建立
2.1.1 混合对照品溶液Ⅰ的制备 分别精密称取TYJ-10、TYJ-14、红景天苷、绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮苷、木犀草苷对照品适量,用50%甲醇超声溶解,定容,摇匀,配制成浓度为0.029 mg/mL的TYJ-10、0.0206 mg/mL的TYJ-14、0.0202 mg/mL的红景天苷、0.0978 mg/mL的绿原酸、0.1568 mg/mL的异绿原酸A、0.0402 mg/mL的异绿原酸B、0.1138 mg/mL的异绿原酸C、0.0182 mg/mL的槲皮苷、0.0228 mg/mL的木犀草苷混合对照品溶液Ⅰ,0.45 μm微孔滤膜滤过,取续滤液,备用。
2.1.2 甜叶菊饮片供试品溶液的制备 精密称取干燥的甜叶菊基准饮片与待评价饮片粉末1 g(过二号筛),置于250 mL具塞锥形瓶中,加入50%甲醇溶液200 mL,超声提取1次(功率500 W,频率40 KHz),20分钟,过滤,减压浓缩,转移至100 mL容量瓶中,定容,摇匀,用0.45 μm微孔滤膜滤过,备用。
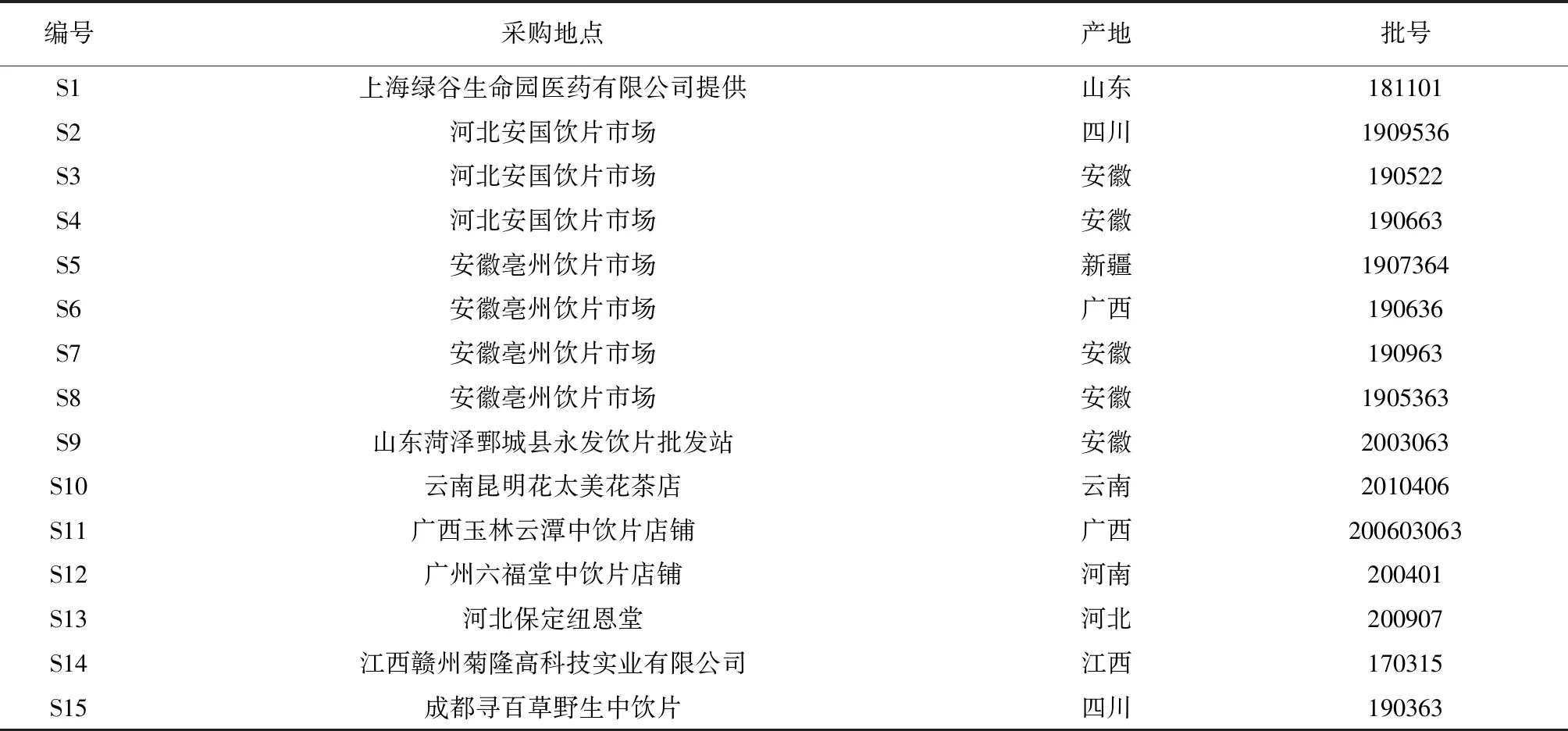
表1 甜叶菊饮片信息表
2.1.3 色谱条件 色谱柱:Waters XbridgeTMshield C18(4.6×250 mm,5 μm);检测波长:270 nm(红景天苷、TYJ-10、TYJ-14),330 nm(绿原酸、异绿原酸B、异绿原酸A、异绿原酸C),254 nm(木犀草苷、槲皮苷);流速:1.0 mL/min;柱温:35℃;进样量:20 μL。流动相:乙腈(A)-0.2%磷酸水(B)梯度洗脱,梯度洗脱条件见表2。
依据上述色谱条件,混合对照品及供试品溶液中9个有效指标性成分在各自检测波长处与其他色谱峰分离度良好。按照以上色谱条件进样得到的甜叶菊饮片基准、混合对照品的HPLC色谱图见图1。
图1图谱显示:21个色谱峰在HPLC图谱中显示分离度良好,通过与TYJ-10、TYJ-14、红景天苷、绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮苷、木犀草苷对照品紫外吸收光谱对比,判断9个特征峰对应的化学成分类型,涵盖了苯乙醇类、酚酸类、黄酮类三种主要有效化学成分类型。

表2 梯度洗脱条件
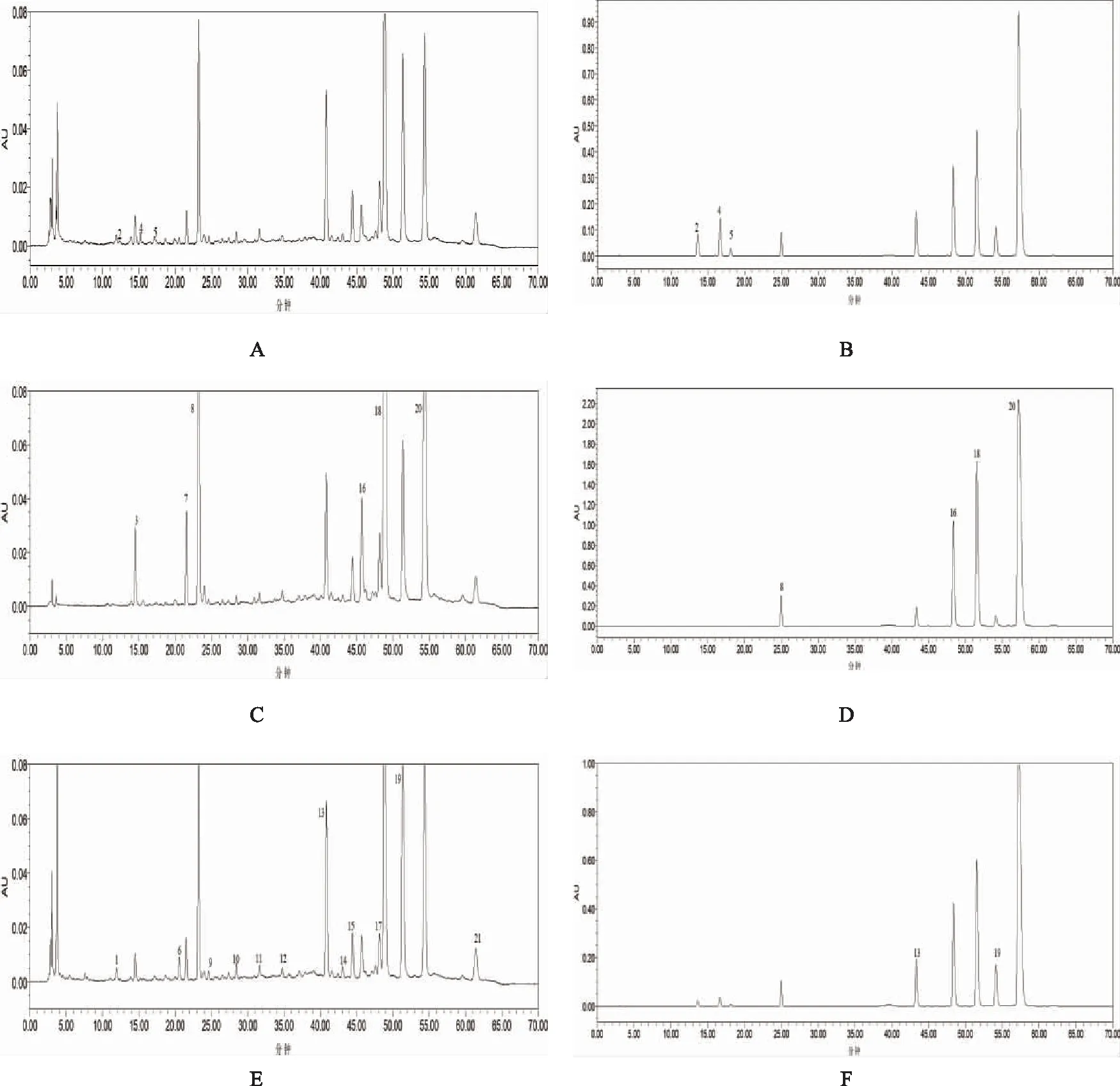
注:A饮片基准(270 nm);B对照品(270 nm);C饮片基准(330 nm);D对照品(330 nm);E饮片基准(254 nm);F对照品(254 nm);3,7咖啡酰奎宁酸类;8绿原酸;16异绿原酸A;18异绿原酸B;20异绿原酸C;9,10,11,12,14,15,17,21黄酮类;13木犀草苷;19槲皮苷;2红景天苷;4 TYJ-10;5 TYJ-14;1,6其他类。
2.1.4 有效基准特征图谱方法学考察 (1)精密度考察:按2.1.2项下制备甜叶菊饮片有效基准供试品溶液,按2.1.3项下色谱条件连续进样6次,以绿原酸为参照,计算各色谱峰与参比峰的相对峰面积和相对保留时间,结果显示:相对峰面积RSD均小于等于2.07%,相对保留时间RSD均小于等于0.70%,表明仪器精密度良好,符合特征图谱测定要求(RSD≤3%)[15-16];(2)稳定性考察:按2.1.2项下制备甜叶菊饮片有效基准供试品溶液,室温放置,于制备后0、2、4、6、8、12、24小时按2.1.3项下色谱条件分别进样测定,以绿原酸为参照,计算各色谱峰与参比峰的相对峰面积和相对保留时间,结果显示:相对峰面积的RSD均小于等于2.20%,相对保留时间的RSD均小于等于1.39%,表明供试品溶液在24小时内基本稳定(RSD≤3%)[15-16];(3)重复性考察:按2.1.2项下制备甜叶菊饮片有效基准供试品溶液6份,按2.1.3项下色谱条件分别进样测定,以绿原酸为参照,计算各色谱峰与参比峰的相对峰面积和相对保留时间,结果显示:相对峰面积的RSD均小于2.17%,相对保留时间的RSD均小于1.59%,表明此方法重复性良好(RSD≤3%)[15-16]。
2.1.5 特征指标性成分含量测定方法学考察 (1)线性关系考察:精密吸取2.1.1项下制备的混合对照品溶液Ⅰ,按2.1.3项下色谱条件分别进样1 μL、5 μL、10 μL、20 μL、30 μL、40 μL、50 μL,测定9个代表性成分峰面积,以对照品进样量(μg)为横坐标,色谱峰峰面积为纵坐标,绘制标准曲线,并计算回归方程及相关系数。结果表明:TYJ-10在0.0290~1.4500 μg、TYJ-14在0.0206~1.0300 μg、红景天苷在0.0202~1.0100 μg、绿原酸在0.0978~4.8900 μg、异绿原酸A在0.1568~7.8400 μg、异绿原酸B在0.0402~2.0100 μg、异绿原酸C在0.1138~5.6900 μg、木犀草苷在0.0228~1.1400 μg、槲皮苷在0.0182~0.9100 μg范围内进样量与峰面积呈良好的线性关系(R≥0.99)[15-16]。见表3。(2)精密度考察:按2.1.2项下制备甜叶菊饮片有效基准供试品溶液,按2.1.3项下色谱条件连续进样6次测定,计算得到红景天苷、TYJ-10、TYJ-14、绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮苷、木犀草苷峰面积RSD均≤2.16%,表明仪器精密度良好,符合含量测定要求(RSD≤3%)[15-16];(3)稳定性考察:按2.1.2项下制备甜叶菊饮片有效基准供试品溶液,室温放置,于制备后0、2、4、6、8、12、24小时按2.1.3项下色谱条件分别进样测定,计算得到红景天苷、TYJ-10、TYJ-14、绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、槲皮苷、木犀草苷峰面积RSD均小于等于2.01%。表明供试品溶液在24小时内稳定性良好(RSD≤3%)[15-16];(4)重复性考察:按2.1.2项下制备甜叶菊饮片有效基准供试品溶液6份,按2.1.3项下色谱条件分别进样测定,计算得到红景天苷、TYJ-10、TYJ-14、绿原酸、木犀草苷、异绿原酸B、异绿原酸A、槲皮苷、异绿原酸C平均含量分别为0.0555%、0.1499%、0.1153%、0.4377%、0.1653%、0.1195%、1.0230%、0.1557%、0.3511%,RSD分别为0.74%、1.07%、2.05%、0.83%、1.79%、0.87%、1.81%、1.80%、2.44%,表明本方法重复性良好(RSD≤3%)[15-16];(5)加样回收率:精密称取已知含量的甜叶菊饮片有效基准样品6份,各约0.5 g,置于250 mL具塞锥形瓶中,按2.1.2项下方法制备有效基准供试品溶液;精密称取红景天苷对照品2.78 mg、TYJ-10对照品7.64 mg、TYJ-14对照品5.80 mg、绿原酸对照品21.80 mg、异绿原酸B对照品5.90 mg、异绿原酸A对照品52.50 mg、异绿原酸C对照品17.60 mg、木犀草苷对照品8.42 mg、槲皮苷对照品7.60 mg置于同一10 mL容量瓶中,加50%甲醇溶解并稀释到刻度摇匀,得到混合对照品溶液Ⅱ;精密量取1 mL混合对照品溶液Ⅱ分别置于以上6个100 mL供试品溶液中摇匀即得,按2.1.3项下色谱条件进样,测定9个特征成分色谱峰峰面积,并计算红景天苷、TYJ-10、TYJ-14、绿原酸、槲皮苷、异绿原酸B、异绿原酸A、槲皮苷、异绿原酸C加样回收率分别为100.59%、98.64%、100.75%、100.21%、100.22%、100.41%、98.40%、101.35%、101.58%,RSD分别为1.23%、1.79%、1.63%、1.52%、1.50%、0.76%、1.42%、1.51%、1.50%,表明此方法准确可靠(回收率在95%~102%之间,RSD≤3%)[15-16]。见表4。
2.1.6 模拟基准点质量表征考察 以与检测基准供试品溶液浓度(0.0438 mg/mL)等同的绿原酸对照品模拟饮片基准中质量表征基准点,即精密称取2.19 mg绿原酸对照品加50%甲醇稀释50倍,制得浓度为0.0438 mg/mL的绿原酸对照品溶液作为模拟基准点,按照2.1.3项下色谱条件进样,测定对照品溶液和基准供试品溶液的出峰时间及色谱峰面积,结果见图2。由图2可知,基准供试品溶液中绿原酸即实测质量表征基准点保留时间23.027分钟,峰面积为314637 μV·s/100 mg;绿原酸对照品溶液即模拟质量标准基准点的保留时间23.312分钟,峰面积314844 μV·s/100 mg。二者保留时间、峰面积相对偏差绝对值均小于2%,二者相吻合,佐证了检测方法的可行性与检测结果的准确性,表明以0.0438 mg/mL的绿原酸对照品模拟质量表征基准点,对基准质量信息进行表征的方法准确可行。

表3 线性关系考察结果
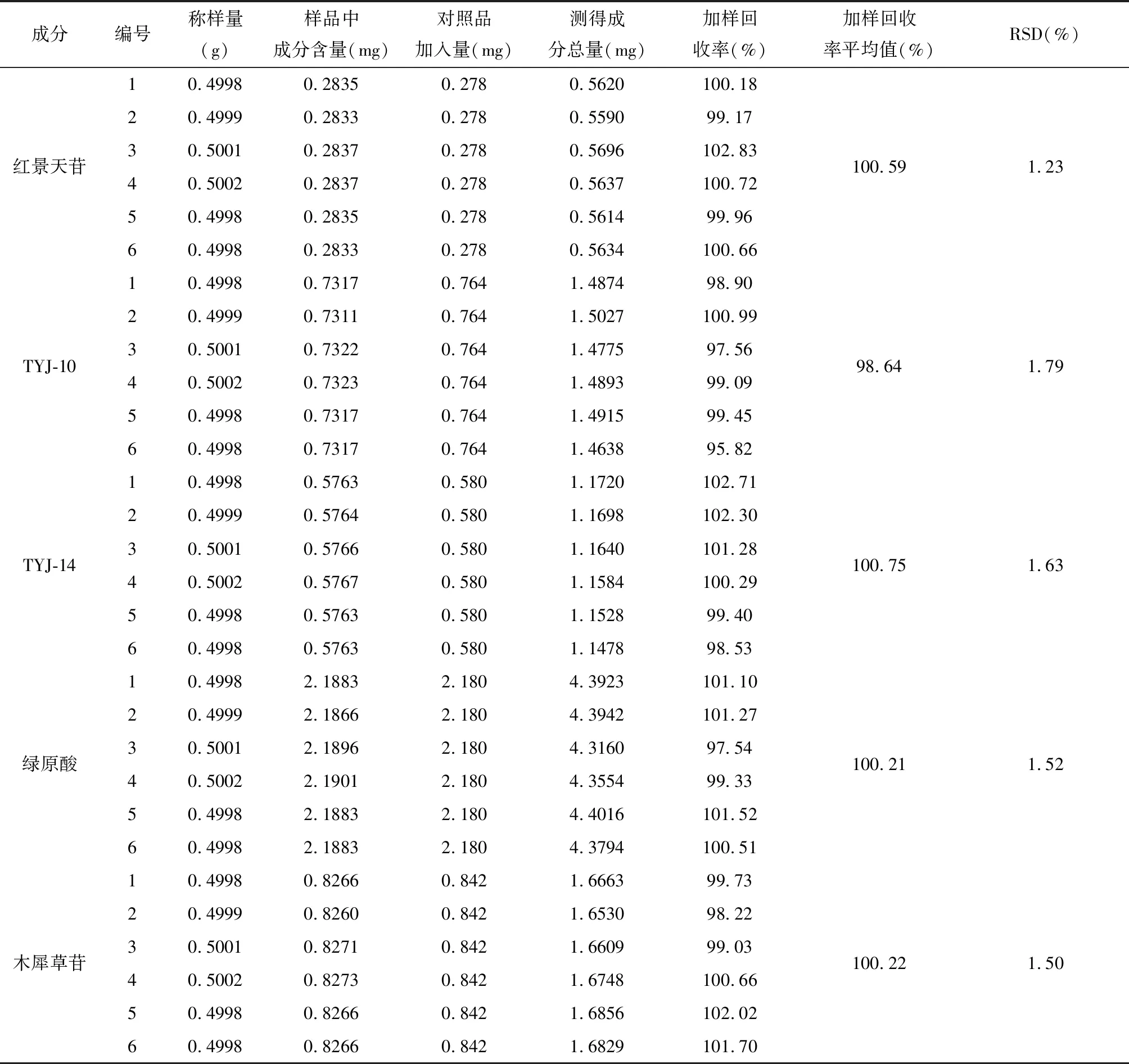
表4 加样回收率实验结果
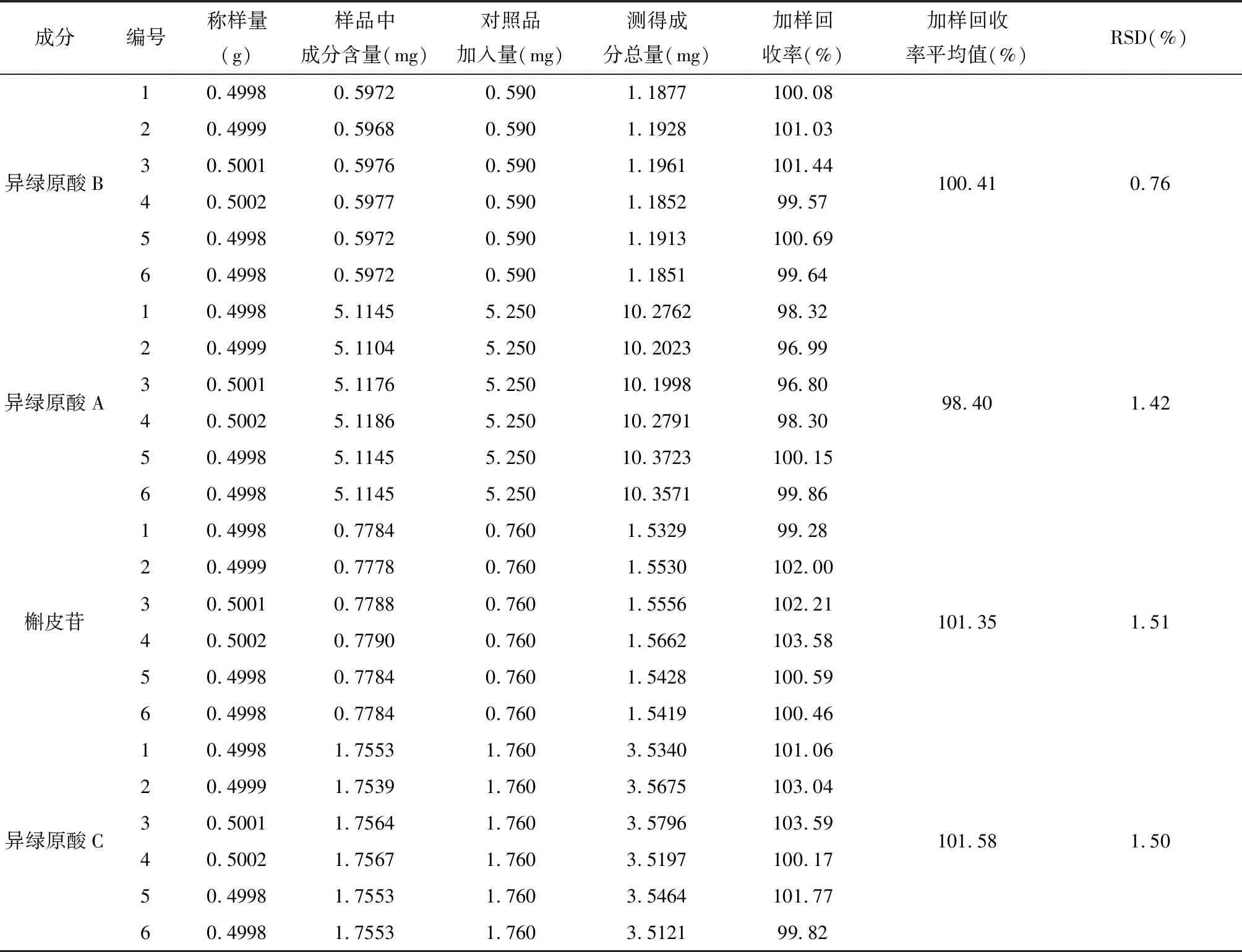
续表
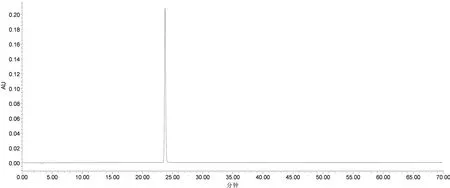
图2 模拟基准点HPLC色谱图(330 nm)
2.2 有效基准特征图谱质量表征信息
特征性成分质的表征及关联分析,通过有效基准特征图谱中特征峰的吸收光谱信息与对照品吸收光谱信息比对,推测其对应的化学成分类型,共指认出21个代表性成分,其中苯乙醇苷类成分3个,分别为红景天苷、TYJ-10、TYJ-14;酚酸类成分6个,特征指标性成分为绿原酸、异绿原酸A、异绿原酸B、异绿原酸C;黄酮类成分10个,特征指标性成分为木犀草苷、槲皮苷;其他类型成分2个。21个色谱峰的保留时间、峰面积(以100 mg甜叶菊饮片计)、以模拟基准点为基准得到相对保留时间和相对峰面积以及9个特征性成分的含量、模拟相对含量、换算系数(代表性成分的相对含量/代表性成分的相对峰面积)。结果见表5。由表5可得,基于模拟基准点得到的21个特征峰及其模拟相对保留时间,模拟相对峰面积,9个代表性成分的模拟相对含量,即为甜叶菊饮片有效质量基准标尺。
2.3 评价与验证
精密称取14批待评价甜叶菊饮片,按2.1.2项下方法制备供试品溶液,平行制备3份,按2.1.3项下色谱条件进样检测,得到的14批待评价甜叶菊质量表征信息,同时实测甜叶菊有效基准饮片各代表性成分含量,以检验基于有效质量基准标尺进行甜叶菊质量评价的准确性,结果见图3~6。
由图3~6可知,14批甜叶菊饮片特征图谱皆含有21个相同的色谱峰,且14批甜叶菊饮片的21个特征峰相对保留时间均与基准标尺基本一致,同时也与实测值相吻合,结果表明14批饮片均为甜叶菊饮片,且验证了应用有效基准标尺辨别甜叶菊饮片真伪的准确性。由图7~8可得14批甜叶菊饮片质量表征信息,根据其特征峰相对峰面积及其相对含量高于其有效基准标尺对应点的数目、幅度和所涵盖的三种主要化学类型及其绿原酸同类成分,综合考量评价得出饮片T3,T6,T5,T1,T7,T15,T12质量较优。
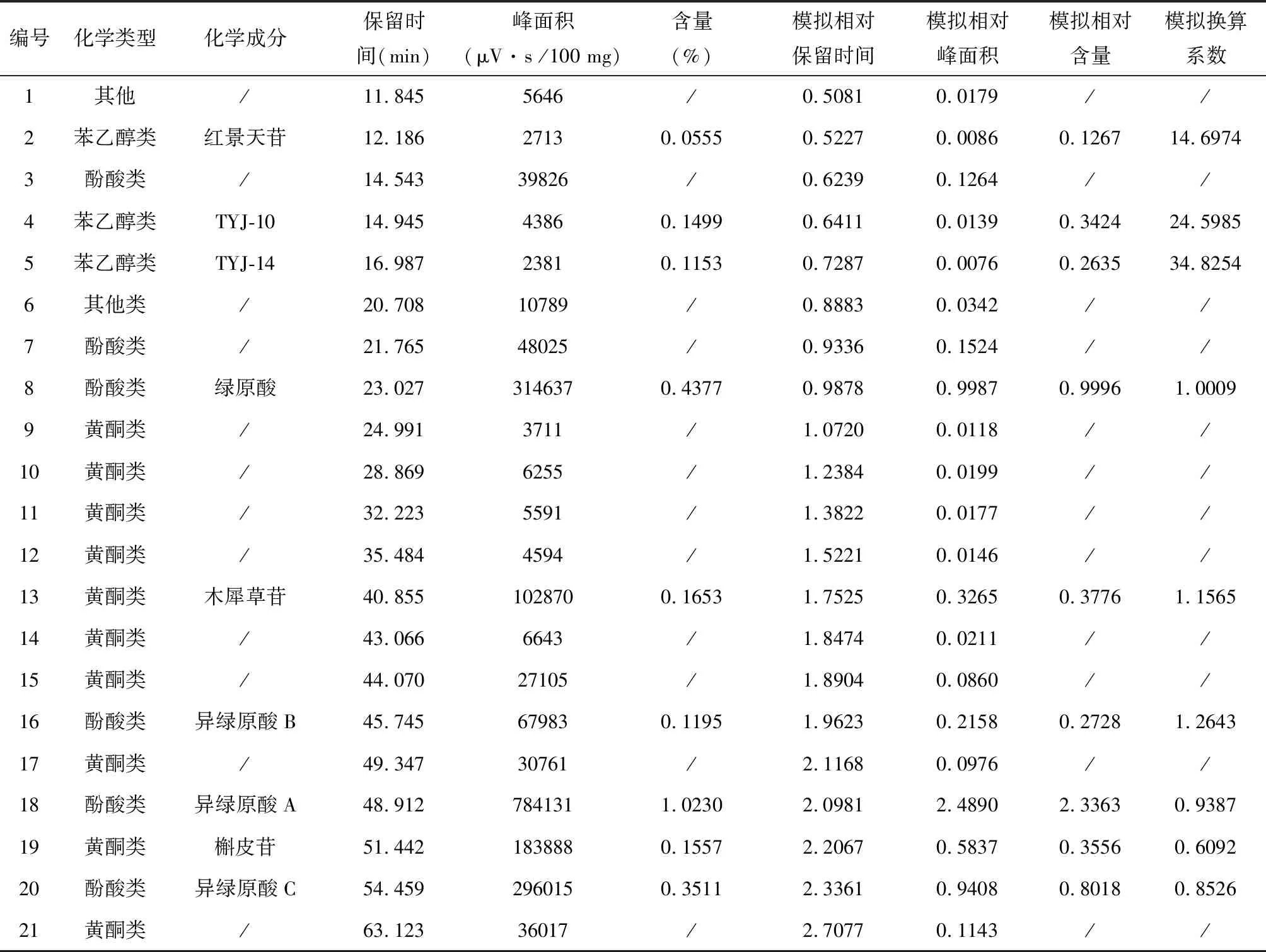
表5 21个特征峰的质量表征信息

图3 14批甜叶菊饮片与基准饮片(T2)的HPLC特征图谱(270 nm)
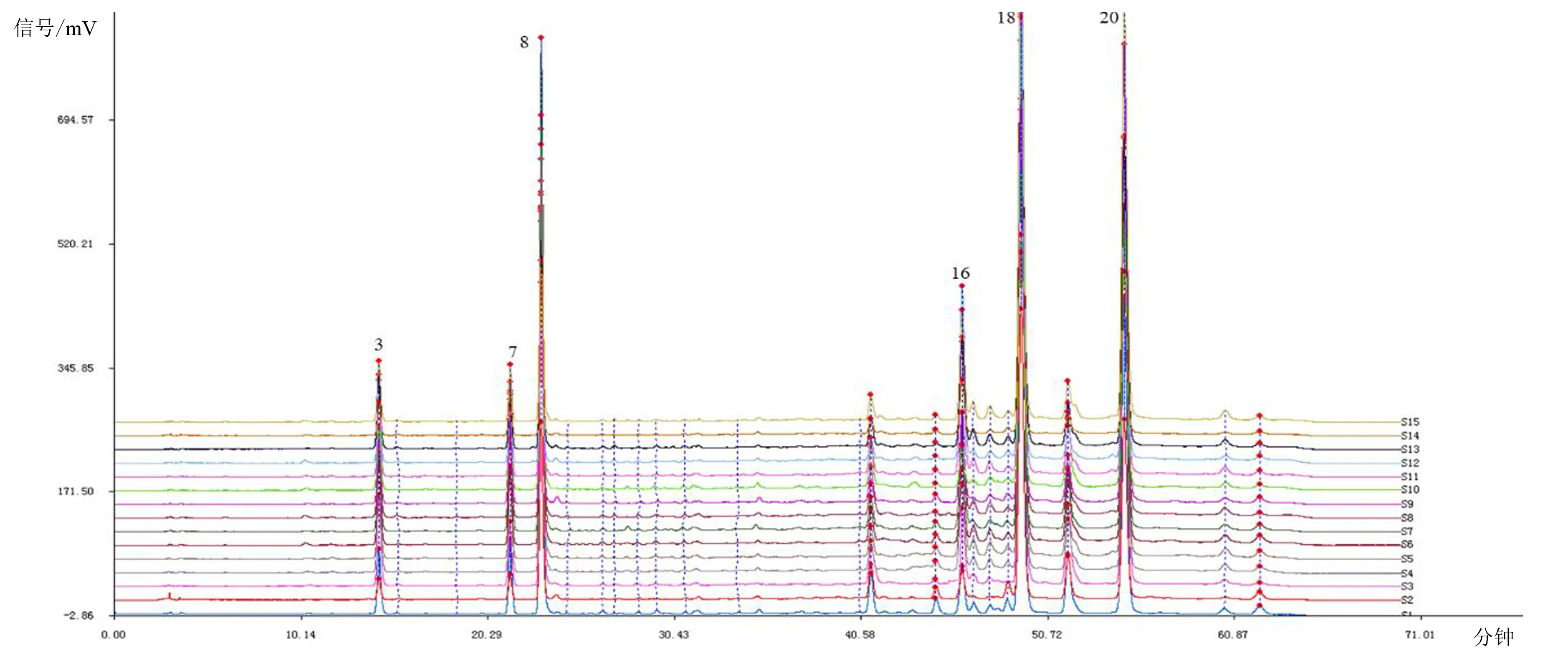
图4 14批甜叶菊饮片与基准饮片(T2)的HPLC特征图谱(330 nm)

图5 14批甜叶菊饮片与基准饮片(T2)的HPLC特征图谱(254 nm)

图6 14批甜叶菊饮片与基准饮片(T2)的相对保留时间
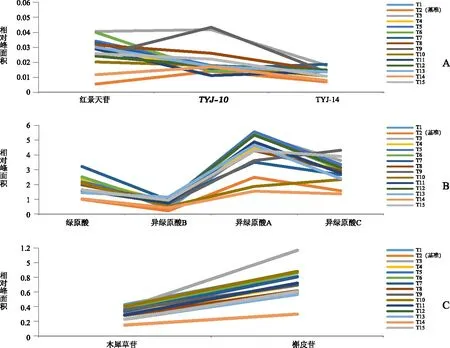
注:A苯乙醇苷类成分;B酚酸类成分;C黄酮类成分。
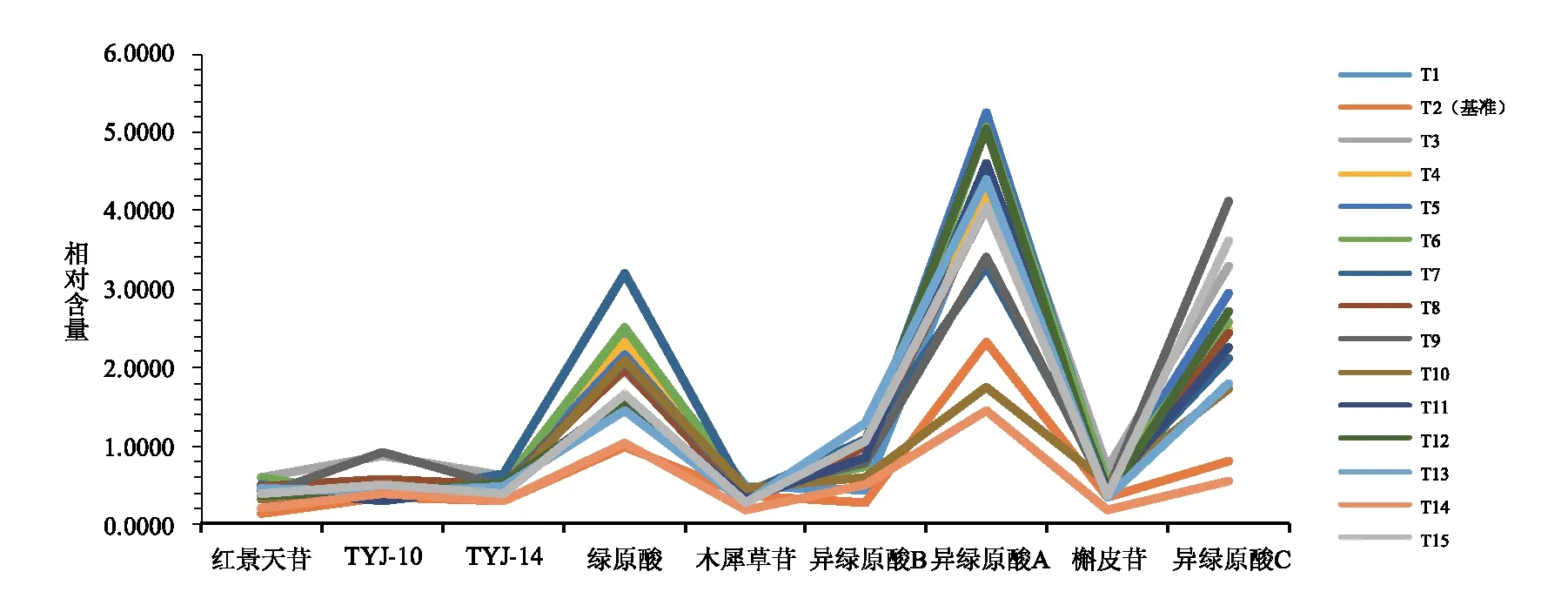
图8 14批甜叶菊饮片与基准饮片的相对含量

表6 14批甜叶菊饮片与基准饮片中9个特征代表性成分的含量(%,n=3)
由表6可得,换算含量与实测含量基本一致,即验证了各代表性成分换算含量结果的准确性及其相对含量结果的准确性。
3 讨论
本研究基于课题组前期建立的有效基准特征图谱质量表征与中药质量评价模式,建立了甜叶菊有效基准特征图谱质量表征方法,甜叶菊饮片中21个特征峰涵盖了苯乙醇类、黄酮类及酚酸类这三种主要化学类型成分,有研究证明绿原酸具有降血糖作用[17],综合考虑降血糖功效、保留时间、分离度及经济性,选用绿原酸作为质量表征基准点对特征性成分进行质量表征,采用所构建的甜叶菊质量评价模式及质量标尺对14批甜叶菊饮片的质量进行评价得出:T3、T6、T5、T1、T7、T15、T12质量较优,且基于换算系数得到的9个代表性成分的含量皆与实测含量基本一致,验证了本研究建立的基于甜叶菊有效基准特征图谱的质量表征模式、方法能整体、准确地对甜叶菊饮片进行质量表征,且可以有效、精准、经济地评价甜叶菊饮片质量,从而为甜叶菊饮片的质量评价提供科学依据。

