基于TCGA数据库的EGFR突变型与野生型肺腺癌患者免疫微环境的差异性分析
朱光胜 李永文 施睿峰 徐松林 张子禾 曹培俊 陈琛 刘红雨 陈军
肺癌是世界上最常见的恶性肿瘤之一,也是全球癌症相关死亡的最常见原因,每年有超过一百万人死于肺癌[1]。根据组织学类型不同,肺癌分为两个主要亚型:非小细胞肺癌(non‐small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)分别占所有病例的85%和15%[2]。肺腺癌是最常见的NSCLC,近年来,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR‐TKIs),显著改善EGFR阳性突变的肺腺癌患者的无进展生存期(progression‐free survival, PFS)和总生存期(overall survival, OS)[3]。
免疫检查点抑制剂(immune checkpoint inhibitor, ICI)的使用是近年来肺癌治疗的又一项重大突破。已有的数据表明,在程序性死亡配体1(programmed cell death ligand 1, PD‐L1)表达阳性的肺癌患者中,ICI单药或联合化疗的疗效,超过了化疗药。因此,依据PD‐L1表达水平的不同,ICI单药或ICI联合化疗已经成为肺癌患者的一线治疗选择方案。另一方面,在具有EGFR突变的肺腺癌患者中,ICIs的治疗效果普遍不佳。比如最近的一项临床研究探索了EGFR突变的肺癌患者一线使用ICIs的效果。这项II期单臂试验对PD‐L1表达≥1%的EGFR突变NSCLC患者进行每3周静脉注射200 mg派姆单抗(Pembrolizumab)治疗,在11例患者接受治疗后,由于缺乏疗效而该研究提前结束,客观缓解率(objective response rate, ORR)为0%,结果令人十分失望[4],而产生如此结果的机制尚不明确,推测与两类患者不同的免疫微环境有关。因此,最新的美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)临床指南及中国抗癌协会临床肿瘤学协作中心(Chinese Society of Clinical Oncology, CSCO)临床指南均指出,EGFR突变阳性肺腺癌患者首选的治疗方案是EGFR‐TKI;对驱动基因突变阴性、PD‐1表达阳性患者,ICI单药或ICI联合化疗可以成为一线治疗方案。
癌症基因组图谱(The Cancer Genome Atlas, TCGA)作为目前最大的癌症基因信息数据库,包含了临床样本数据以及多组学的数据,其中包含了包括基因表达数据、拷贝数变异、DNA甲基化、单核苷酸多态性(single nucleotide polymorphism, SNP)的数据。
本研究拟通过TCGA公共数据集,在分析研究EGFR突变肺腺癌患者与野生型肺腺癌患者的临床特征差异的基础上,进一步分析其免疫微环境水平的差异,初步探讨EGFR突变肺腺癌患者与野生型肺腺癌患者在接受ICIs治疗时产生的不同治疗效果的可能的发生机制,为未来可能的治疗方案提供线索和思路。
1 材料与方法
1.1 数据资料收集 从TCGA数据库官网(https://portal.gdc.cancer.gov/)下载566例肺腺癌患者的临床资料、单核苷酸改变的数据以及RNA‐seq的信息。通过Cbioportal在线数据库(http://www.cbioportal.org/)获得了肺腺癌肿瘤突变分布图(图1)。
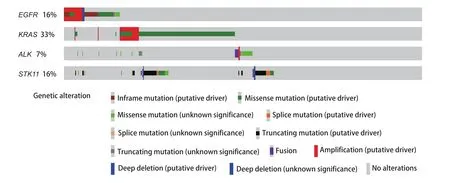
图1 肺腺癌患者基因突变分布图Fig 1 Oncoplot of lung adenocarcinoma
1.2 数据集筛选 根据单核苷酸改变的数据,利用样本中是否出现EGFR突变的信息进行筛选,仅保留501例TCGA数据集中包含EGFR突变的信息和对应的RNA‐seq的病例。并将其通过EGFR是否突变分为EGFR突变组与野生型组。
1.3 免疫相关淋巴细胞浸润计算 通过TIMER 2.0(http://timer.comp‐genomics.org/)获得通过四种方法(CIBERSORT, CIBERSORT ABS, QUANTISEQ, XCELL)[5]计算得出的TCGA数据库中免疫相关淋巴细胞浸润结果。
1.4 功能富集分析 利用R语言“cluster Profiler”程序包对野生型组和EGFR突变组进行基因集富集分析(Gene Set Enrichment Analysis, GSEA)。
1.5 统计学分析 使用SPSS 21.0软件进行统计学分析。临床信息相关性分析,组间比较采用卡方检验及Fisher确切概率法,采用乘积极限法(Kaplan-Meier)绘制生存曲线、对数秩检验(Log-rank)比较不同样本的生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 EGFR野生型和突变型肺腺癌患者的相关临床资料分析 本研究从TCGA数据集下载、整理、分析了501例肺腺癌患者的临床数据和其对应的信息,其中,男性232例(46%),女性269例(54%),中位年龄65岁;存在吸烟史的407例(81%),无吸烟史的67例(13%),27例患者的吸烟史未被提及;EGFR突变型67例(13%),EGFR野生型434例(87%)。如表1所示,EGFR突变型和野生型肺腺癌患者在年龄、肿瘤大小、有无淋巴结转移、有无远处转移、临床分期方面均无统计学差异,而EGFR突变型较野生型肺腺癌更频繁发生于女性患者(突变型女性:n=48,72%;野生型女性:n=221,51%)(P=0.003);EGFR突变型较野生型肺腺癌更频繁发生于从未吸烟患者(突变型从未吸烟患者:n=24,36%;野生型从未吸烟患者:n=43,10%)(P<0.001)。进一步采用Kaplan-MeierPlotter方法分析EGFR突变型与野生型肺腺癌患者的生存差异,如图2所示,二者在生存时间上未见显著的统计学差异(Log-rank检验,P=0.22,图2)。
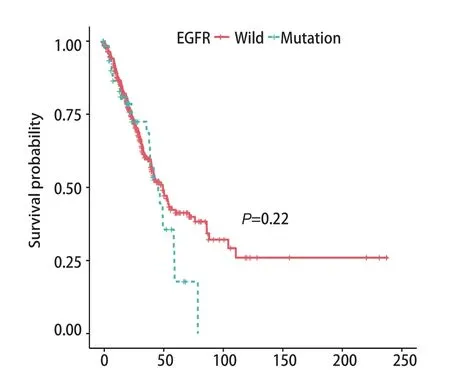
图2 EGFR是否突变与肺腺癌患者预后的关系Fig 2 The relationship between EGFR mutation and prognosis of patients with lung adenocarcinoma

表1 EGFR野生型和突变型肺腺癌患者的相关临床资料分析Tab 1 Analysis of clinical data of patients with EGFR-mutation and EGFR-wild lung adenocarcinoma
2.2 EGFR野生型组和EGFR突变组患者肺癌组织免疫相关细胞浸润水平分析 本研究通过XCELL法计算获得样本的免疫相关淋巴浸润情况,使用R语言的“ggplot2”程序包分析了在EGFR突变型与野生型肺腺癌患者之中,免疫相关淋巴浸润情况的差异。我们发现EGFR突变患者趋于具有更高的肿瘤相关成纤维细胞、普通髓系祖细胞、造血干细胞、效应CD4+T细胞、自然杀伤T细胞浸润;更低的记忆B细胞、初始B细胞、浆细胞、浆细胞样树突状细胞、记忆CD4+T细胞、CD4+辅助性T细胞2、CD8+T细胞、中心记忆CD8+T细胞、初始CD8+T细胞浸润(图3A)。我们对67例EGFR突变患者的样本中细胞浸润情况做了相关性分析,发现除造血干细胞(P<0.05)、肿瘤相关成纤维细胞(P<0.05)、内皮细胞之间互相具有较强的相关性(P<0.05),各免疫细胞浸润之间相关性不大(图3B)。另外,已经有研究证明较低的CD8+T细胞与较差的免疫治疗的疗效是相关的[6]。同时,CD8+T细胞是ICIs治疗的直接效应细胞,CD8+T细胞浸润高低将直接影响ICIs治疗对肿瘤细胞所带来的细胞毒性效应的高低。因此,本研究采用其他三种计算免疫浸润的方法验证了CD8+T细胞浸润在EGFR突变型与野生型之间的差异,证实了EGFR突变型患者具有较低的CD8+T细胞浸润(图4)。结果显示,这可能是EGFR突变患者免疫治疗疗效差的因素之一。与此同时通过肿瘤突变分布图,我们发现EGFR野生型患者中KRAS基因突变比例较高(图1)。

图3 EGFR突变肺腺癌患者免疫微环境改变。A: 野生型组和EGFR突变组免疫相关细胞浸润水平的差异;B:对67例EGFR突变型肺腺癌患者免疫相关细胞浸润程度的相关性分析。Fig 3 Changes of immune microenvironment in lung adenocarcinoma patients with EGFR mutation. A: differences in the infiltration levels of immune related cells between the wild-type group and the EGFR mutation group; B: Correlation analysis of the degree of immune related cell infiltration in 67 patients with EGFR mutant lung adenocarcinoma.

图4 使用四种方法评估野生型组和EGFR突变组CD8+ T细胞浸润程度Fig 4 Four methods were used to assess the degree of CD8+ T-cell infiltration in the wild-type group and the EGFR mutant group
2.3 免疫细胞浸润程度与生存预后分析 为了探索免疫细胞浸润程度与肺腺癌患者预后的关系,我们采用Kaplan-MeierPlotter方法分析各种在EGFR突变型与野生型浸润存在差异的免疫相关细胞浸润高低与生存预后的关系。我们发现在肺腺癌患者中,CD8+T细胞、自然杀伤T细胞、记忆B细胞和造血干细胞在肿瘤中浸润的程度越高则患者预后越好(Log-rank检验,P=0.017、0.009,3、0.018和0.016) (图5A、5B、5D、5E)。而CD4+辅助性T细胞2在肿瘤中浸润的程度越高则患者预后越差(Log-rank检验,P=0.016)(图5C)。这与往期的研究结果是类似的[7],CD8+T细胞、自然杀伤T细胞等有助于肿瘤免疫反应的细胞浸润增多与患者较好的预后密切相关,而CD4+辅助性T细胞2这种免疫抑制细胞对患者预后不利。

图5 EGFR突变型与野生型浸润程度存在差异的免疫相关细胞与肺腺癌患者预后的关系Fig 5 Immune related cells differentially infiltrating EGFR mutant versus wild type correlate with prognosis in lung adenocarcinoma patients
2.4EGFR突变型和野生型肺腺癌患者基因集富集通路分析 为了分析EGFR突变型和野生型肺腺癌患者在免疫相关通路上的改变,本研究采用R语言“clusterProfiler”程序包对野生型组和EGFR突变组进行基因集富集分析。结果显示,EGFR突变组相对于野生型组,在免疫相关的通路上除了参与免疫应答的细胞因子分泌的正调节(positive regulation of cytokine secretion involved in immune response)通路中的关键基因为上调外,在自然杀伤细胞介导的对肿瘤细胞的免疫应答的正调控(positive regulation of natural killer cell mediated immune response to tumor cell)、自然杀伤细胞激活参与免疫反应(natural killer cell activation involved in immune response)、在自然杀伤细胞介导的对肿瘤细胞的免疫应答(natural killer cell mediated immune response to tumor cell)这三条与自然杀伤细胞有关的通路上的关键基因均处于下调状态(图6)。
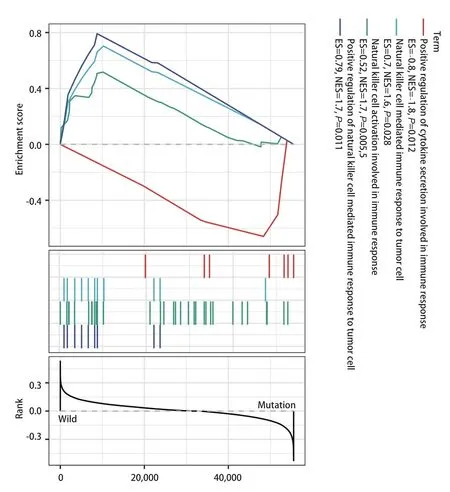
图6 EGFR突变型和野生型肺腺癌患者基因集富集通路分析Fig 6 Gene set enrichment pathway analysis of EGFR mutant and wild type lung adenocarcinoma patients
3 讨论
肺癌是中国发病率和死亡率最高的恶性肿瘤[8],其中NSCLC占85%[2]。在NSCLC中,肺腺癌占据了很大的比重。对于存在EGFR敏感突变的晚期肺腺癌患者来说,临床指南建议EGFR‐TKIs作为一线用药[9‐11]。而ICIs已经展现出能使NSCLC患者长期获益的能力,并具有较轻的副作用的特点。临床前研究表明,EGFR激活可上调肿瘤细胞PD‐L1的表达,从而诱导T细胞凋亡,促进EGFR突变NSCLC的免疫逃逸。然而,一些临床研究已经证明PD‐1抑制剂治疗EGFR突变的NSCLC患者的疗效可能很差[12,13]。本研究主要探讨了EGFR突变型与野生型患者肿瘤免疫浸润的改变,以探讨EGFR突变型患者接受ICIs时效果差的潜在机制。
本研究发现,与野生型肺腺癌患者相比,EGFR突变型患者的肿瘤的CD8+T细胞浸润程度较低。这可能与EGFR野生型患者中KRAS基因突变比例较高有关(图3)。而较低的CD8+T细胞与较差的免疫治疗的疗效是相关的[6]。同时我们也发现较低的CD8+T细胞浸润与肿瘤患者更差的预后是存在联系的(图5A)。并且,我们使用了四种方法计算CD8+T细胞浸润程度,其最后结果都提示EGFR突变型患者肿瘤浸润的CD8+T细胞程度较低。这证明了该结论的可靠性。CD8+T细胞的数量与多种肿瘤患者的预后密切相关,并且,如果这些细胞在肿瘤里的浸润水平低于2.2%,那么患者在手术后出现疾病进展的风险要高出4倍[7]。因此较低的CD8+T细胞浸润也可能是EGFR突变型肺腺癌患者接受ICIs治疗时疗效差的潜在原因。
同时我们发现EGFR突变型患者肿瘤的自然杀伤T细胞浸润程度较高(图2A),并且较高的自然杀伤T细胞与较好的临床预后存在联系(图5B)。然后在基因集富集分析的结果中,我们发现了三条与自然杀伤细胞相关的通路在EGFR突变患者出现了下调现象。包括自然杀伤细胞介导的对肿瘤细胞的免疫应答的正调控、自然杀伤细胞激活参与免疫反应、在自然杀伤细胞介导的对肿瘤细胞的免疫应答这三条在自然杀伤细胞发挥作用时起到关键作用的通路都下调。同时EGFR突变患者记忆B细胞、造血干细胞在肿瘤中浸润的程度较低(图2A),而较低的记忆B细胞、造血干细胞浸润意味着较差的预后(图5)。EGFR突变患者还具有较高的CD4+辅助T细胞2 (Th2 T细胞浸润) (图2A),然而高浸润的Th2 T细胞往往意味着较差的预后(图5C)。Th2细胞主要分泌白介素4(interleukin‐4, IL‐4)、IL‐5、IL‐10、IL‐13等,它主导体液免疫应答,辅助抗体生成[14]。近来研究[15,16]发现肿瘤组织多分泌Th2类细胞因子,并认为机体处于Th2细胞因子优势状态是肿瘤免疫逃逸的机理之一。而记忆B细胞与造血干细胞浸润在肿瘤免疫反应中的作用还不明确。但这些细胞的浸润程度与肺腺癌患者预后较好存在相关性,因此这两种细胞的缺乏也可能是EGFR突变患者对ICIs治疗不敏感的潜在原因。
综上所述,本研究利用TCGA公共数据库,对EGFR突变型以及野生型患者的免疫微环境的差异进行了分析,初步探索EGFR突变型患者对ICIs治疗获益较差的机制。我们发现EGFR突变型患者肿瘤中CD8+T细胞浸润较低,CD8+T细胞作为ICIs的直接效应细胞,其浸润过低可能是导致EGFR突变型患者免疫治疗疗效差的直接原因。同时EGFR突变型患者肿瘤中还存在记忆B细胞与造血干细胞低浸润,Th2 T细胞高浸润。同时在EGFR突变型患者肿瘤中高浸润的自然杀伤细胞出现了功能失调。
Author contributions
Zhu GS, Shi RF and Xu SL conceived and designed the study. Shi RF, Zhang ZH and Cao PJ collected the data. Zhu GS, Xu SL and Chen C analyzed the data. Shi RF contributed analysis tools. Liu HY, Chen J and Li YW provided critical inputs on design, analysis, and interpretation of the study.All the authors had access to the data. All authors read and approved the final manuscript as submitted.

