单核细胞/高密度脂蛋白胆固醇与非酒精性脂肪性肝病的相关性分析
王 娟,王迎春,王春宇
大连大学附属中山医院 消化二科,辽宁 大连 116001
在过去的二十年中,非酒精性脂肪性肝病(NAFLD)已经从一种相对无人问津的疾病迅速演变成全球最常见的慢性肝病[1],可能会进展为肝纤维化、肝硬化,甚至肝癌,还会增加罹患心血管疾病、糖尿病等慢性病的风险。近年发现,单核细胞/高密度脂蛋白胆固醇(MHR)可作为一种新型炎性指标[2],因与其他炎症因子相比,获取方便,重复性好,价格低廉,备受学者喜爱。有研究[3-6]证实,MHR与糖尿病、高血压、多囊卵巢综合征、代谢综合征等密切相关,并与C反应蛋白呈正相关。NAFLD作为代谢综合征在肝脏的表现,目前尚未报道相关研究。本课题旨在探讨血清MHR水平与NAFLD的关系,以为临床诊断及评估NAFLD进展提供一定的理论参考。
1 资料与方法
1.1 研究对象 收集2018年1月—2020年10月入住本院消化内科且经腹部CT诊断为NAFLD的患者的临床资料,诊断标准均符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[7]。排除药物性及病毒性肝病、恶性肿瘤及心肾功能不全者;患有血液性及感染性疾病等。另选取同期健康体检人群作为对照组。
1.2 一般资料采集 受试者均进行人体测量及个人嗜好采集,记录身高、体质量、年龄、吸烟等信息,并计算BMI。
1.3 生化指标检测 留取所有患者晨起或空腹12 h以上的肘静脉血3~5 ml,予离心机(TDZ5-WS)以3500 r/min离心5 min,于全自动生化分析仪检测实验性参数,包括WBC、单核细胞计数、TG、CHO、HDL、LDL、空腹血糖(FBG)、ALT、AST。计算MHR=单核细胞/HDL-C。
1.4 NAFLD及严重程度的诊断 受试者均行全腹CT检查,由同一名具有丰富经验的技师行影像学解读。CT诊断脂肪肝的依据为肝脏密度普遍降低,肝/脾CT值之比<1.0。其中,肝/脾 CT比值<1.0但>0.7者为轻度,≤0.7但>0.5者为中度,≤0.5者为重度脂肪肝[8]。
1.5 伦理学审查 本研究通过大连大学附属中山医院伦理委员会批准,批号:2020038,均获得受试者同意。

2 结果
2.1 一般情况 共纳入NAFLD患者208例,健康体检者210例为对照组。与对照组相比,NAFLD组中的吸烟史比例、体质量、BMI、WBC、单核细胞、LDL-C、TG、CHO、FBG、ALT、AST水平均升高,HDL-C水平降低,差异均有统计学意义(P值均<0.05),两组间性别、年龄及身高相比,差异均无统计学意义(P值均>0.05)。NAFLD组中血清MHR水平显著高于对照组(P<0.001)(表1,图1)。
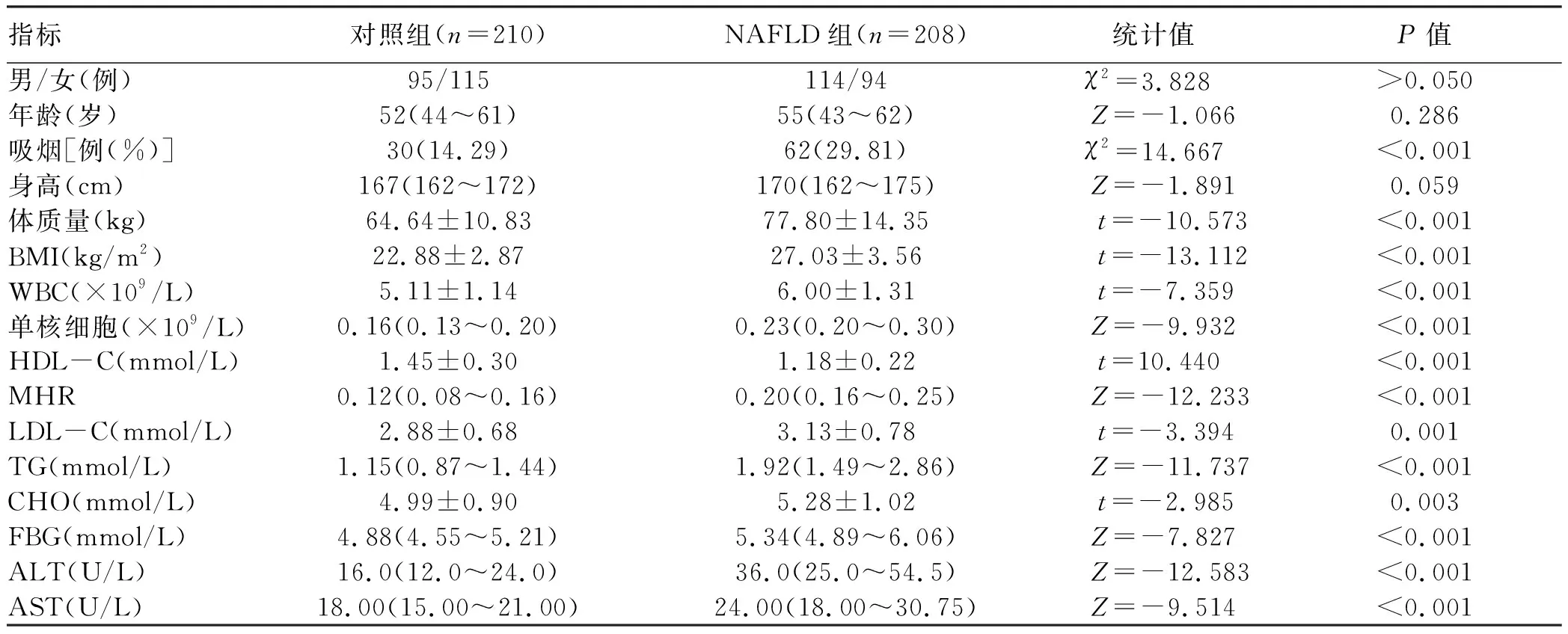
表1 对照组与NAFLD组患者一般情况的比较
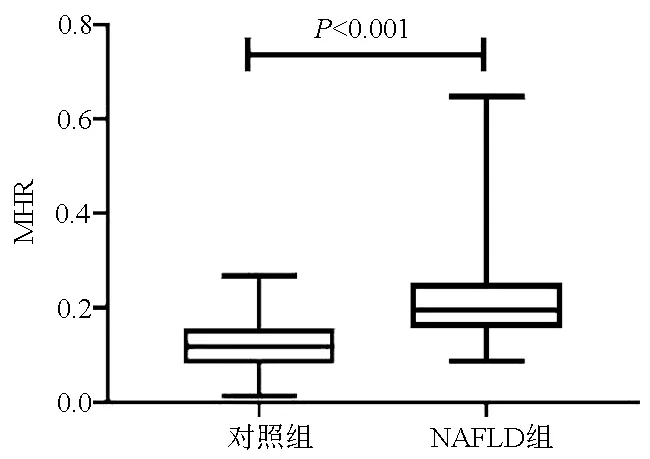
图1 对照组与NAFLD组患者血清MHR的比较
2.2 对照组与不同程度NAFLD患者一般情况的比较 不同程度NAFLD患者与对照组比较,性别、吸烟史、体质量、BMI、WBC、单核细胞、HDL-C、MHR、LDL-C、TG、CHO、FBG、ALT、AST等指标均有差异(P值均<0.05)。其中中重度NAFLD组血清MHR水平高于轻度NAFLD组及对照组,差异均有统计学意义(P值均<0.001)(表2,图2)。
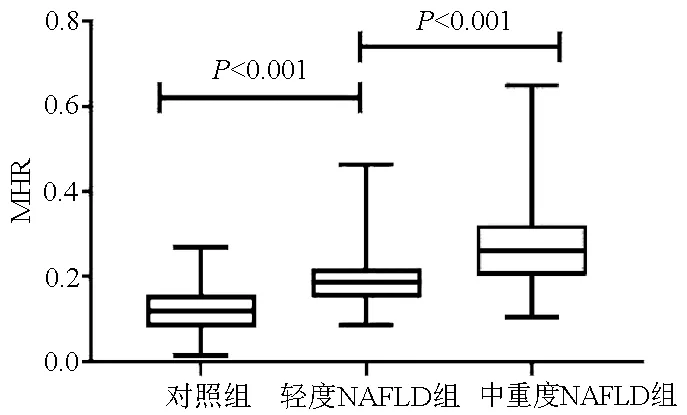
图2 对照组与不同程度NAFLD组MHR水平的比较
2.3 血清MHR水平在性别之间的比较 按性别分组,结果表明男性的血清MHR水平[0.186(0.143~0.239)]较女性[0.131(0.094~0.180)]明显增加(P<0.001)(图3)。血清MHR在正常女性、正常男性、NAFLD女性、NAFLD男性的水平分别为[0.10(0.07~0.13)、0.14(0.10~0.18)、0.17(0.13~0.21)、0.22(0.18~0.28)],差异有统计学意义(H=192.35,P<0.001)(图4)。
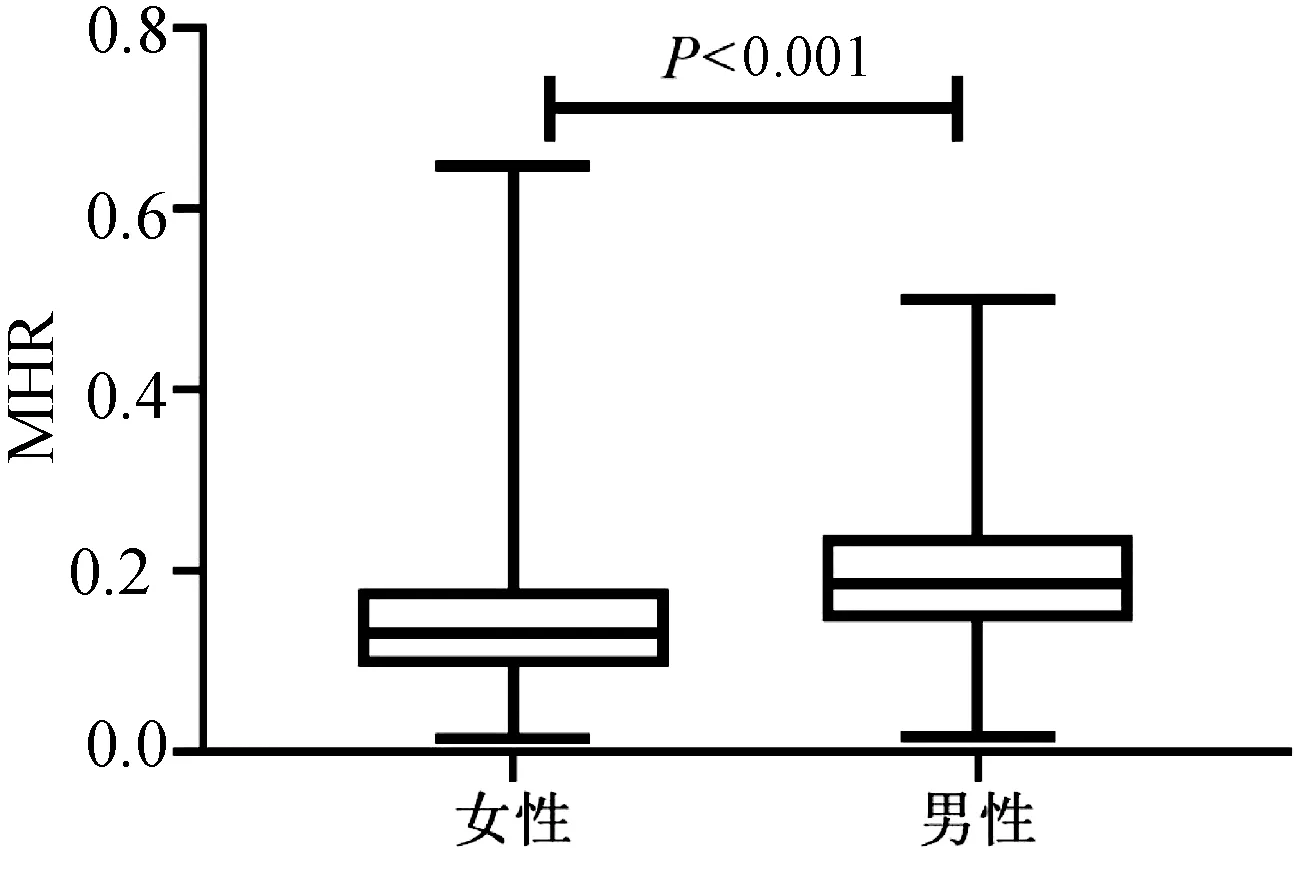
图3 MHR水平在不同性别间比较

图4 MHR水平在不同亚组性别内比较
2.4 血清MHR水平与各变量的相关性分析 相关分析结果显示:MHR与HDL-C呈负相关,与吸烟史、体质量、BMI、WBC、单核细胞、TG、FBG、ALT、AST呈正相关,同时MHR水平与NAFLD的严重程度亦呈正相关(P值均<0.05)(表3)。
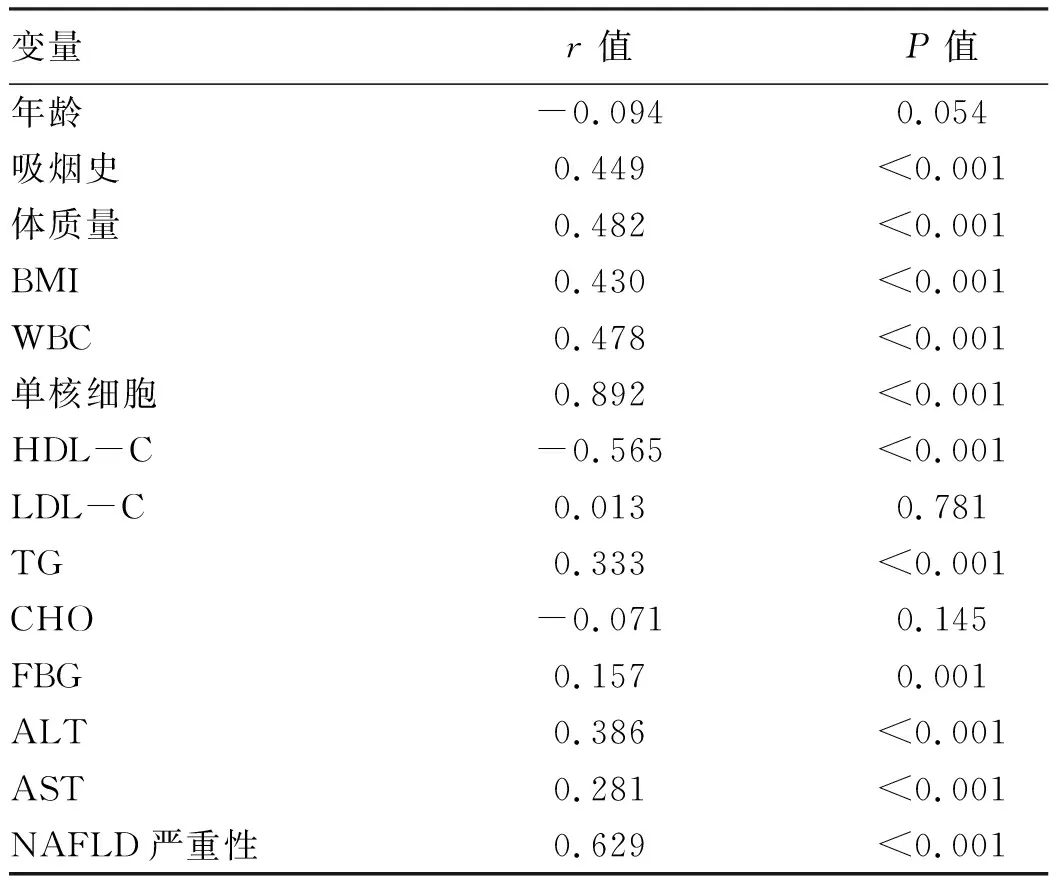
表3 血清MHR水平与各变量的相关性
2.5 MHR诊断NAFLD的ROC曲线 探索MHR对NAFLD的潜在诊断价值,结果示MHR的ROC曲线下面积为0.846(95%CI:0.810~0.882,P<0.001)。当MHR的最佳截断值为0.522时,诊断NAFLD的敏感度为77.9%,特异度为74.3%(图5)。
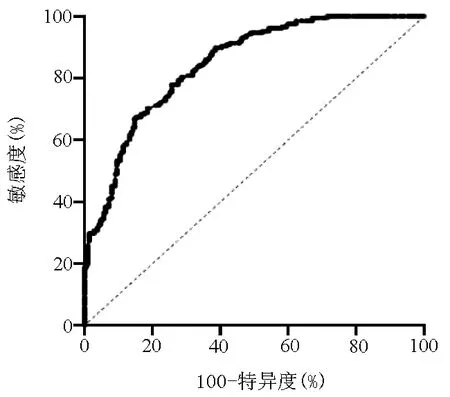
图5 MHR诊断NAFLD的ROC曲线
3 讨论
NAFLD已成为西方国家肝移植的第二大原因,预计未来3~5年位居首位[9],其病因错综复杂,至今尚未定论,但慢性炎症[10]在NAFLD的机制中已得到充分认同。我国王树康等[11]学者在一项大型纵向队列研究中发现,排除多种混杂变量后,外周血WBC水平越高,发生NAFLD的风险随之增加。单核细胞肩负机体防御和调节组织稳态的职责,被Zhang等[12]发现在NAFLD患者中显著增加,且中间单核细胞(CD14++CD16+)可作为NAFLD的独立危险因素。本研究也发现NAFLD患者中的WBC及单核细胞显著高于对照组,在不同程度的NAFLD患者中也显示较大差异,与既往研究结论一致,再次证实炎症与NAFLD密不可分。
MHR作为两项常规生化指标的比值,被当代视为新生炎症标志物,大量研究[3-5]证实,MHR可安全、有效预测疾病的进展及预后。我国一项心血管健康数据[13]显示,MHR水平与缺血性卒中概率之间存在线性关系,且MHR最高四分位数的患者与最低组相比发生缺血性卒中的风险高出1.6倍,同时Li等[14]发现在阻塞性睡眠呼吸暂停中MHR较健康人群增加明显,并与呼吸暂停低通气指数呈正相关。
在本研究中,与对照组相比,NAFLD患者的血清MHR水平显著增加,并随着NAFLD病情的恶化而随之上升。据笔者所知,这是首次开展MHR与NAFLD的相关研究。其次,相关分析显示,血清MHR水平与HDL-C呈负相关,与吸烟史、WBC、TG、FBG、ALT、AST及NAFLD严重程度呈正相关,表明MHR涉及炎症、糖脂代谢等多个方面,是一个综合性指标,与Jialal等[15]、YIlmaz等[2]结论无明显差异。再次,以性别分组,血清MHR水平存在性别差异,即男性高于女性,在对照组及NAFLD组内比较也提示显著差异,可能是由于男性多合并吸烟等不良嗜好,承担的社会压力较大,性激素对体脂分布的差异等造成的。最后,绘制ROC曲线分析MHR对NAFLD的诊断效能,结果表明MHR的ROC曲线下面积为0.846,敏感度为77.9%,特异度为74.3%,故一定程度上可用来区分对照组及NAFLD组。但MHR与NAFLD具体的机制仍未知晓,可能有以下可能:首先是慢性炎症,众所周知,全身循环系统的大多数促炎和氧化细胞因子来源于单核细胞[16],而脂质蓄积是NAFLD的基本特征,可导致肝细胞损伤,随之促炎细胞因子大量释放,包括外周的单核细胞及其衍生的浸润型巨噬细胞,加速NAFLD向非酒精性脂肪性肝炎的演变进程[17]。同时,胆汁酸双受体激活剂(INT-767)可通过介导单核细胞免疫表型的转变,提高Ly6clow单核细胞的含量,从而减轻NAFLD的炎症反应[18]。其次是胰岛素抵抗,它是NAFLD作用机制的首发环节。Glass等[19]研究发现机体脂肪组织胰岛素抵抗主要起源于单核细胞分化的M1促炎性巨噬细胞,慢性炎症与胰岛素抵抗密切相关。
本研究的局限性:(1)回顾性研究,未能证实NAFLD患者中MHR与其他炎性指标的相关性;(2)无法确定MHR与其他有统计学意义变量之间的因果关系。
总而言之,本研究首次发现,MHR水平在NAFLD患者中呈现异常,并与NAFLD的进展密切相关。在今后NAFLD的实践工作中,MHR有望作为一种价格低廉、易于测量及处理的指标用来预测NAFLD,未来还需要更多大样本研究验证。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王娟负责课题设计,资料分析,论文撰写;王春宇参与数据收集;王迎春修改论文及最后定稿。

