AU结合因子1对肝细胞癌患者磷脂酰肌醇蛋白聚糖3水平的影响
张 婷,关贵文,张 婧,鲁凤民,陈香梅
北京大学基础医学院 病原生物学系,北京大学感染病研究中心,北京 100191
肝细胞癌(HCC)是全球常见的恶性肿瘤之一, 位列癌症相关死亡率的第四位[1-2]。尽管最近在HCC临床治疗方面取得了很多进展,但其治疗效果仍然欠佳,HCC术后5年生存率只有15%[3]。
磷脂酰肌醇蛋白聚糖3(GPC3)是一种硫酸肝素蛋白聚糖,位于细胞膜表面,在细胞增殖和分化中发挥重要作用[4-5]。研究[6-7]表明,GPC3在HCC中呈异常高表达,且具有很强的肿瘤特异性,被认为是HCC关键驱动分子。此外,GPC3表达水平与HCC的发生发展及预后密切相关,可作为HCC的诊断标志物和治疗靶点[4,8-9]。但GPC3在HCC中异常表达的机制尚未完全阐明。
腺苷酸-尿嘧啶富集元件(AU-rich elements,AREs)位于mRNA的3′UTR区,是最具特征的mRNA降解顺式作用因子。AREs可被ARE结合蛋白识别并结合,进而调控mRNA的稳定性及翻译[10-11]。AU结合因子1(AU-rich element RNA-binding factor 1,AUF1)也称异质核糖核蛋白D(hnRNPD),是第一个被鉴定出的ARE结合蛋白[12-13]。大量研究[14-15]表明,AUF1高亲和力结合富含AREs元件的mRNA并调控其稳定性。本研究中,首次发现GPC3 mRNA的3′UTR区含有AREs序列,AUF1可结合GPC3 mRNA,增强其稳定性,从而上调HCC中GPC3的表达。
1 材料与方法
1.1 TCGA、LCI数据库 TCGA-HCC基因表达数据下载自美国Bead研究所基因数据分析中心(http://gdac.broadinstitute.org)。采用FPKM (fragments per kilobase million) 法对TCGA转录组测序数据进行标准化,最终纳入371例不同病因的HCC组织及50例癌旁组织。
LCI-HCC基因表达数据下载自GSE14520(http://www.ncbi.nlm.nih.gov/geo), 最终纳入214例有随访信息的乙型肝炎相关HCC患者。
1.2 临床标本 35例HCC及配对癌旁样本选取自2009年—2013年在河南省肿瘤医院接受常规根治性手术的HCC患者。所有患者均经病理诊断确诊,且均未在手术前接受任何化学疗法或放射疗法。
1.3 肝癌细胞系 HepG2细胞购自美国ATCC细胞库,Huh-7细胞购自中国科学院上海细胞库。使用含有10%胎牛血清、100 U/ml青霉素、链霉素的DMEM培养基于37 ℃、5%CO2培养箱中培养,待细胞融合度达约80%时,用0.25%胰蛋白酶进行消化传代,取生长至对数期的细胞用于实验研究。
1.4 主要材料与试剂 siRNA购自广州锐博生物;pcdh-AUF1质粒为本实验室构建保存;细胞DMEM培养基、胎牛血清和胰蛋白酶购自美国Gibco公司;转染试剂LipofectamineTMRNAiMAX Transfection Reagent、LipofectamineTM2000、Trizol、Protein A磁珠及蛋白定量试剂购自美国Invitrogen公司;逆转录试剂盒、实时荧光定量PCR(qRT-PCR)试剂购自美国Roche公司;RNA合成抑制剂Actinomycin D和兔抗AUF1抗体购自Abcam公司;鼠抗人GPC3抗体和鼠抗人Tubulin抗体购自美国SantaCruz公司。
1.5 免疫组化实验 将石蜡块切成5 mm的切片,并用苏木精和曙红染色。使用AUF1和GPC3抗体染色并通过DAKO EnVision显色系统检测,采用Aperio Scan Scope GL虚拟扫描成像系统,并用Visio pharm软件进行分析。根据染色强度和对应的阳性细胞百分比对染色切片进行评分[15]:0分,阴性,0%;1分,弱阳性,<25%;2分,适中,25%~50%;3~4分,强阳性,> 50%。
1.6 细胞转染实验 转染前1天进行细胞传代并细胞计数,按照4×105个/孔将细胞接种于6孔板中。按照LipofectamineTMRNAiMAX的说明书,将siAUF1与对照siNC转染至HepG2与Huh-7细胞中。AUF1外源表达质粒和空载对照按照LipofectamineTM2000说明书进行转染。转染6 h后,更换新鲜培养基继续培养,并于转染48 h后收集细胞,用于后续实验研究。
1.7 Western-Blot实验 收集细胞沉淀,加入RIPA裂解液进行细胞裂解,BCA试剂测定蛋白浓度。SDS-PAGE电泳分离蛋白,转移至PVDF膜,5%脱脂奶粉室温封闭,一抗4 ℃孵育过夜。二抗室温孵育1 h。用美国LI-COR公司 Odyssey双色红外激光成像系统采集图像,使用Tubulin作为内参。
1.8 细胞RNA提取和qRT-PCR 按照Trizol试剂说明书提取细胞总RNA,用Nano-Drop2000测定RNA浓度。以1 μg总RNA为模板,用随机引物逆转录合成cDNA链。取1 μl逆转录产物,用SYBRGREEN法进行qRT-PCR。以管家基因C-TBP1作为内参,采用2-△△CT方法对目的基因的相对表达进行分析,实验所用引物序列如下。GPC3:F5′-GCGGTTACTGCAATGTGGTC-3′,R5′-TCTCAGTTTCAGTGGTGGTC-3′;AUF1:F5′-GATCAAGGGGTTTTGGCTTT-3′,R5′-GTTGTCCATGGGGACCTCTA-3′;C-TBP1:F5′-TTCACCGTCAAGCAGATGAGAC-3′,R5′-CTGGCTAAAGCTGAAGGGTTCC-3′。
1.9 RNA结合蛋白免疫沉淀实验 取1×107细胞加入350 μl RIP裂解液进行细胞裂解。将AUF1抗体或同型IgG对照与Protein A磁珠孵育2 h,洗去未结合的抗体后加入细胞裂解液上清,4 ℃孵育过夜。依次加入蛋白酶K和DNase I,消化蛋白和DNA。使用苯酚氯仿提取和乙醇沉淀分离出共沉淀的RNA,用qRT-PCR法定量检测GPC3表达。
1.10 RNA半衰期检测 将siAUF1与对照siNC转染HepG2与Huh-7细胞,48 h后,向细胞培养基中加入放线菌素D(5 mg/ml)抑制新的RNA合成。在加药处理后0、2、4、6 h,收集细胞并提取RNA,qRT-PCR法检测GPC3表达。
1.11 伦理学审查 本研究经北京大学医学部伦理委员会的批准,批号:IRB00001052-12088,并已获得所有患者的知情同意。
1.12 统计学方法 采用SPSS 24.0和GraphPad Prism5软件进行统计学分析。计量资料两组间比较采用t检验,计数资料两组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析,并使用log-rank检验进行生存率的比较。以P<0.05为差异有统计学意义。
2 结果
2.1 GPC3和AUF1 mRNA在开放数据库HCC中的表达及相关性 GPC3 mRNA在HCC组织中的表达水平显著高于癌旁组织(P值均<0.05)(图1)。在TCGA-HCC数据库中,GPC3 mRNA高表达的HCC患者5年总体生存率显著低于GPC3 mRNA低表达患者(P<0.05);在LCI数据库中,GPC3 mRNA表达对与乙型肝炎相关HCC患者的预后无关(图2)。AUF1 mRNA在HCC组织中的表达水平明显高于癌旁组织(P值均<0.05)(图3)。
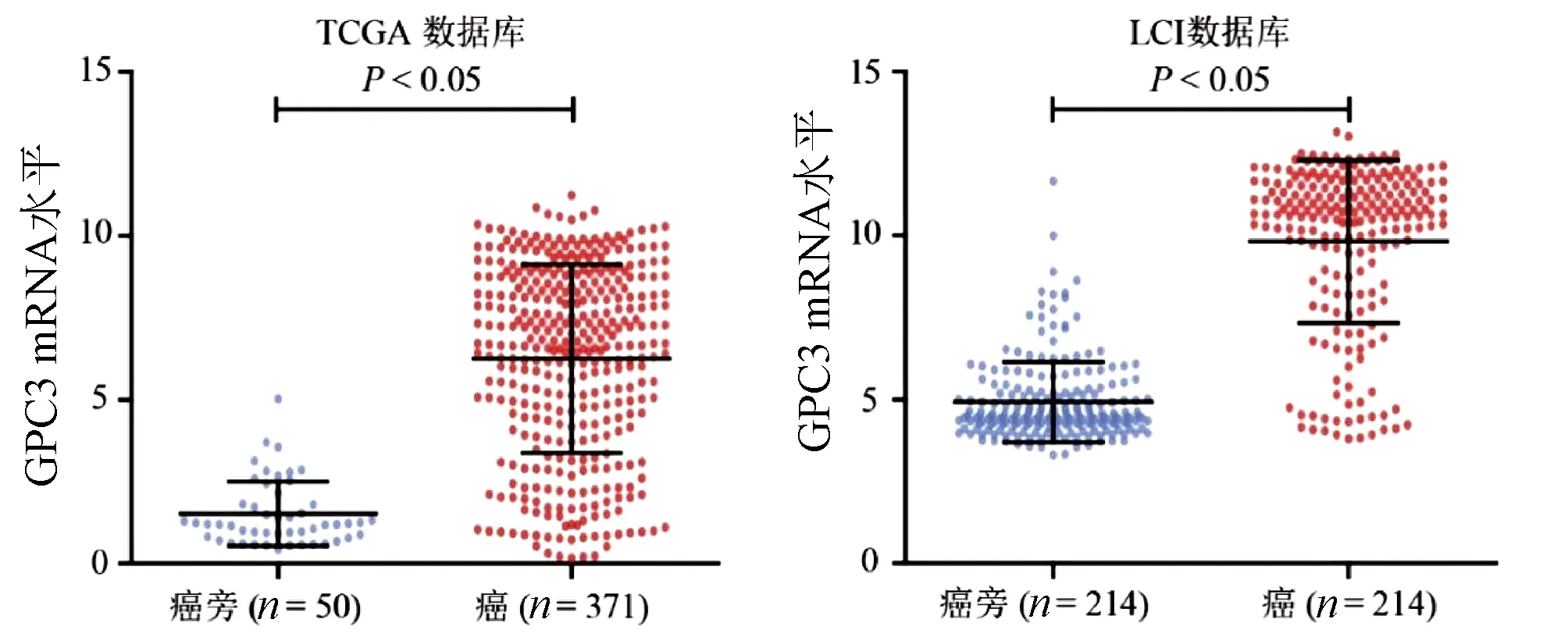
图1 TCGA、LCA数据库中GPC3 mRNA的表达水平

图2 TCGA、LCI数据库中GPC3表达水平与HCC患者预后的关系
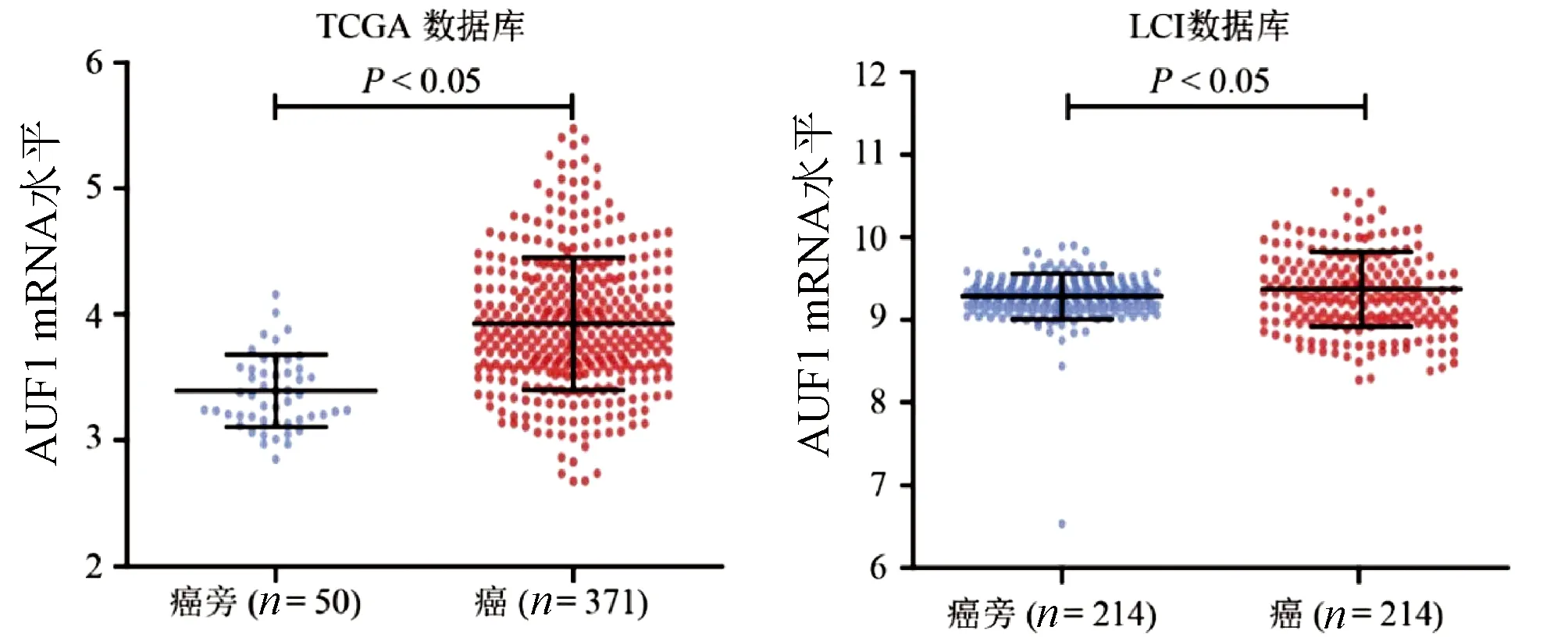
图3 TCGA、LCI数据库中AUF1 mRNA的表达水平
2.2 GPC3与AUF1蛋白在HCC组织中呈高表达 采用免疫组化方法检测了35例HCC样本中GPC3和AUF1蛋白的表达水平。结果显示,GPC3在HCC组织中高表达,大部分HCC细胞的胞膜和胞质中均可检测到GPC3,其中20例为强阳性染色(≥3分)、7例为中度阳性染色(2分)、8例染色较弱或呈阴性(<2分)。而在非肿瘤肝组织中几乎检测不到GPC3表达(图4)。AUF1也在HCC组织中呈高表达,显示出较强的胞核着色,其中16例为强阳性染色(≥3分)、10例为中度阳性染色(2分)、9例染色较弱或呈阴性(<2分)(图4)。

图4 GPC3与AUF1在HCC及癌旁组织中免疫组化染色结果
进一步分析显示,GPC3和AUF1蛋白均在HCC组织中呈高表达,阳性表达率分别为77.1%(27/35)和74.3%(26/35)。65.7%(23/35)的HCC组织中GPC3和AUF1均呈高表达。在27例GPC3阳性组中,23例(23/27,85.2%,)AUF1染色呈阳性,显著高于GPC3阴性组中AUF1阳性表达率(3/8,37.5%)(χ2=7.35,P<0.05),提示HCC中AUF1可能调控GPC3的表达。
2.3 AUF1上调GPC3的表达 为了明确GPC3的表达是否受AUF1蛋白调控,在HCC细胞系中检测了AUF1敲减及过表达对GPC3表达的影响。结果表明,敲减AUF1显著下调了HepG2和Huh-7中的GPC3蛋白和mRNA水平(图5a)。相反,在Huh-7细胞中过表达AUF1则上调了GPC3蛋白和mRNA水平(图5b)。

注:a,敲减AUF1后,GPC3蛋白和mRNA水平;b,过表达AUF1后,GPC3蛋白和mRNA水平。
2.4 AUF1结合并稳定GPC3 mRNA 通过分析GPC3 mRNA的3′UTR区发现,该区域富含尿嘧啶,具有典型的AREs序列(图6a)。RNA结合蛋白免疫沉淀实验结果表明,HepG2和Huh-7细胞中的AUF1蛋白可结合GPC3 mRNA(图6b)。在HepG2和Huh-7细胞中敲减AUF1后,GPC3 mRNA的降解速度明显加快(图6c、d),提示AUF1蛋白可以稳定GPC3 mRNA。

注:a,GPC3 3′UTR区潜在的AUF1结合位点示意图;b,RNA结合蛋白免疫沉淀实验检测AUF1与GPC3 mRNA结合;c、d,RNA半衰期实验检测AUF1敲减对GPC3 mRNA降解速度的影响。
3 讨论
GPC3在HCC中呈异常高表达,已成为HCC的免疫治疗靶标[16]。既往研究表明,GPC3在HCC中异常表达可能与Myc的转录激活[17]和GPC3拷贝数增加[18]有关,但其具体机制尚未完全阐明。本研究探索了RNA结合蛋白AUF1对GPC3表达的调控作用,发现HCC细胞中AUF1蛋白可以结合并稳定GPC3 mRNA,进而上调GPC3表达。本研究首次揭示了HCC中GPC3异常表达的转录后调控机制,将为研发HCC新的治疗靶点提供依据。
GPC3是肝脏中的关键肿瘤驱动分子,与HCC的发生、发展和预后密切相关。与文献报道结果一致,本研究发现GPC3 mRNA水平在TCGA和LCI数据库所纳入的HCC组织中均显著高于癌旁组织,且在TCGA数据库中GPC3高表达的HCC患者5年总体生存率更低,提示GPC3高表达与HCC患者的不良预后有关。但在LCI数据库纳入的乙型肝炎相关HCC患者中,未见GPC3高表达与HCC患者不良预后有关。近年来基于高通量测序的研究[19]表明,与非乙型肝炎HCC不同,乙型肝炎相关HCC的分子分型以增殖型为主,且其组织学具有更高的侵袭性特征,包括细胞分化程度更低、更多的染色体不稳定及TP53突变等,提示乙型肝炎相关HCC发生发展中还有其特定的驱动因素。GPC3高表达在不同感染背景相关HCC中的预后作用不同,可能与乙型肝炎相关HCC更复杂的致病机制有关,但需要更深入的研究来确证。
AREs序列广泛存在于基因的3′UTR区,包括编码多种炎症因子、原癌基因、生长因子、细胞周期蛋白的基因。AREs序列可以被RNA结合蛋白识别,包括AUF1、HUR、TTP等[10-11]。AUF1是最早被发现的ARE结合蛋白,在包括HCC、乳腺癌、甲状腺癌等多种肿瘤中表达上调[14-15]。通过数据库分析发现,HCC组织中的AUF1呈异常高表达,与文献报道一致。采用免疫组化方法进一步证实GPC3和AUF1蛋白在HCC组织中也呈高表达,且二者的表达水平呈正相关。以往研究[14-15]多认为AUF1与ARE结合后,发挥降解靶基因mRNA的作用,并进而抑制基因的表达。但近年有研究[14]发现,AUF1也可以稳定mRNA,并上调基因的表达,如食管癌中AUF1通过稳定mRNA上调GCH1蛋白表达。本研究发现,GPC3 mRNA的3′UTR区含有AREs序列,在HCC细胞中敲减AUF1能显著下调GPC3的表达水平,而过表达AUF1则上调GPC3表达。更为重要的是,HCC细胞中AUF1蛋白能与GPC3 mRNA结合,敲减AUF1后GPC3 mRNA的半衰期明显缩短。鉴于AUF1蛋白可以结合并稳定GPC3 mRNA,推测GPC3是AUF1调控的靶基因之一,HCC中AUF1的高表达是导致GPC3上调的一个重要机制。
由于AUF1是通过蛋白质结合GPC3 mRNA从而上调其表达水平,是转录后水平调控,因此在HCC数据库分析中并没有发现AUF1 mRNA与GPC3 mRNA水平间存在显著相关性。此外,已有文献[17]报道Myc可转录激活GPC3基因的表达,且HCC中还存在GPC3基因拷贝数增加,提示HCC组织中GPC3的表达上调包括基因组水平和转录水平的调控。
综上,本研究结果表明RNA结合蛋白AUF1是GPC3基因的新调控因子,可在转录后水平上调GPC3的表达,AUF1和GPC3蛋白的异常高表达可能参与了HCC的发生和发展。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张婷负责课题的实施与论文撰写;关贵文、张婧负责数据库分析与图表整理;鲁凤民参与修改完善论文;陈香梅负责课题设计,指导撰写文章并最后定稿。

