3 种不同益生菌对肉鸡生长性能、肠道消化吸收功能的影响
张利环,张若男,贾 浩,杨俊鹏,李慧锋,朱芷葳,石 雄
(1.山西农业大学生命科学学院,山西太谷 030801;2.山西省晋中市太谷区小白乡人民政府,山西太谷 030801)
在家禽生产中,抗生素的大量使用引起消费者担忧,而益生菌具有安全、环保、无残留等优点,在动物生产中可作为抗生素替代品[1]。乳酸菌属是最常见的益生菌,由多种不同的菌种组成[2]。有研究表明,乳酸菌可提高消化酶活性、促进肠道代谢、改善饲料摄取和吸收[3]。乳酸菌还可黏附于肠道,改善肉鸡肠道形态,如肠道通透性、黏膜免疫和黏液层,并通过改善肠道酶活性和营养有效性促进肠道健康[4]。因此,益生菌被认为是一种能维持肠道菌群平衡、对宿主动物产生积极影响的活性微生物[5]。
不同微生物添加剂的组成不同,不同菌株的饲喂效果存在差异。饮水中添加益生菌可阻止病原微生物增殖,调节有益的肠道菌群,从而改善肉鸡健康、免疫状态和生产性能[6]。但饮水中添加益生菌对肉鸡肠道营养转运蛋白影响的相关研究还缺乏资料。因此,本研究将探讨在饮水中添加3 种不同的益生菌添加对肉鸡生长性能、消化吸收及营养转运蛋白的影响机制,为提高肉鸡养殖的生产效率提供理论基础。
1 材料与方法
1.1 试验材料 将试验冻干纯菌菌粉(Danlsco,China)各取1 g,其中乳双歧杆菌菌粉置于无菌牛乳中厌氧活化,干酪乳杆菌与嗜酸乳杆菌菌粉于MRS 肉汤(Hopebio,HB0384-1)中活化,经37℃恒温培养14 h 后接种到改良MRS 固体培养基(Hopebio,HB0397)上,37℃下培养36 h 后,挑取大小均等、圆润光滑的单菌落于200 mL 的30%无菌脱脂牛乳中扩大培养14 h。
1.2 试验设计与饲养管理 1 日龄雄性麻花肉鸡200 只随机分为4 组,每组5 个重复,每个重复10 只。对照组正常饮水;益生菌组全天饮水中加入1%益生菌,分别为干酪乳杆菌组、嗜酸乳杆菌组、乳双歧杆菌组,益生菌的活菌密度分别为3×109、4.4×109、4.15×109CFU/mL。肉鸡基础日粮的配制参照NRC(1994)和《鸡饲养标准》(NY/T 33-2004)。为确保试验菌种活性,4℃保存益生菌并每6 h 更换饮水,益生菌每日重新配制。试验期共42 d,分为2 个阶段(1~21、22~42 d)。试验期间,肉鸡于立式笼内饲养,按正常程序接种疫苗。试验过程中光照连续,保证肉鸡正常活动,自由摄食和取水,温度从育雏第1 周的33℃每天降低1℃,直至降到23℃结束。每天早晚定时饲喂与观察,记录摄食量。
1.3 样品采集与分析
1.3.1 生长性能测定 在21、42 d 时,称量各组肉鸡,肉鸡称重前禁食但自由饮水10 h,计算各组肉鸡的平均日增重(ADG)、平均日采食量(ADFI)与耗料增重比(F/G)。
1.3.2 取样与小肠形态学测量 于21、42 d 分别抽取100 只(每个重复组5 只),屠宰后摘取的小肠各段样本冲洗净后,取样1 cm2在4%甲醛固定液中过夜,经脱水等一系列处理后嵌入石蜡,6 μm 横切肠段后HE染色,测量小肠绒毛高度(VH)、隐窝深度(CD)、绒毛高度与隐窝深度的比值(V/C);摘取部分含内容物的空肠组织,切口两端棉线捆绑,与冲洗净的空肠样本一起冷冻在液氮中,便于随后分子实验。
1.4 消化酶活性测定 样本在冰上解冻后,将内容物与PBS按1:9(m:v)比例匀浆,低温下3 000×g 离心20 min,使用鸡用ELISA 试剂盒(mlbio,China)按说明书测定上清中淀粉酶(AMY)、脂肪酶(LPS)和胰蛋白酶(TPS)的活性。
1.5 空肠总RNA 提取与qRT-PCR 根据试剂盒(TaKaRa)指示提取总RNA 并进行逆转录。qRT-PCR 使用SYBR green(TaKaRa,SYBR Premix Ex TaqTMIIKit)检测空肠GLUT2的表达水平。PCR 循环:95℃ 5 min 变性;95℃ 5 s 扩增,40 次;60℃ 35 s 退火,72℃ 20 s 延伸循环。使用的引物由Primer 3.0 获得,目标扩增后进行熔解曲线分析确定反应的特异性。每个样本均进行重复测量,以β-actin为参考基因,按照公式P=2-ΔΔCT计算GLUT2mRNA 的相对表达量。

表1 实时荧光定量PCR 引物
1.6 统计分析 使用SPSS 24.0 软件进行统计,数据进行ANOVA 分析,采用Duncan's 检验各组间性状平均值的显著性差异,运用GraphPad Prism 8 进一步分析并制作柱状图。P>0.05 表示差异不显著,P<0.05 表示差异显著。
2 结果与分析
2.1 不同益生菌对肉鸡生长性能的影响 如表2 所示,在整个试验期间,与对照组相比,益生菌组肉鸡的初体重、ADFI 和F/G 无显著差异,末体重与ADG 增加(P<0.05),且益生菌组间差异不显著,各益生菌组中以乳双歧杆菌组肉鸡的生长性能较好。

表2 不同益生菌对肉鸡生长性能的影响
2.2 不同益生菌对肉鸡空肠消化酶活性的影响 如表3 所示,在21 d 时,与对照组相比,干酪乳杆菌组与乳双歧杆菌组空肠消化酶(AMY、LPS、TPS)的活性显著提高,其中以乳双歧杆菌组的活性最高。嗜酸乳杆菌组AMY 的活性显著提高,LPS 与TPS 的活性无显著差异;在42 d 时,与对照组相比,嗜酸乳杆菌组AMY 与TPS 的活性、乳双歧杆菌组LPS 的活性显著提高,且在益生菌组中最高,干酪乳杆菌组空肠消化酶活性显著提高。
2.3 不同益生菌对肉鸡小肠形态学变化的影响 如表4所示,在整个试验期间,与对照组相比,添加益生菌皆可显著提高肉鸡小肠(十二指肠、空肠和回肠)的VH与V/C 值,降低CD(P<0.05)。在21 d 时,在3 个益生菌组中,干酪乳杆菌组回肠VH 较其他2 个益生菌组显著提高,乳双歧杆菌组小肠前段(十二指肠与空肠)的VH 与V/C 值显著提高。在42 d 时,在3 个益生菌组中,干酪乳杆菌组回肠VH 与V/C 值显著提高,嗜酸乳杆菌组小肠前段的VH 显著提高,乳双歧杆菌组小肠前段的V/C 值显著提高,小肠CD 显著降低。
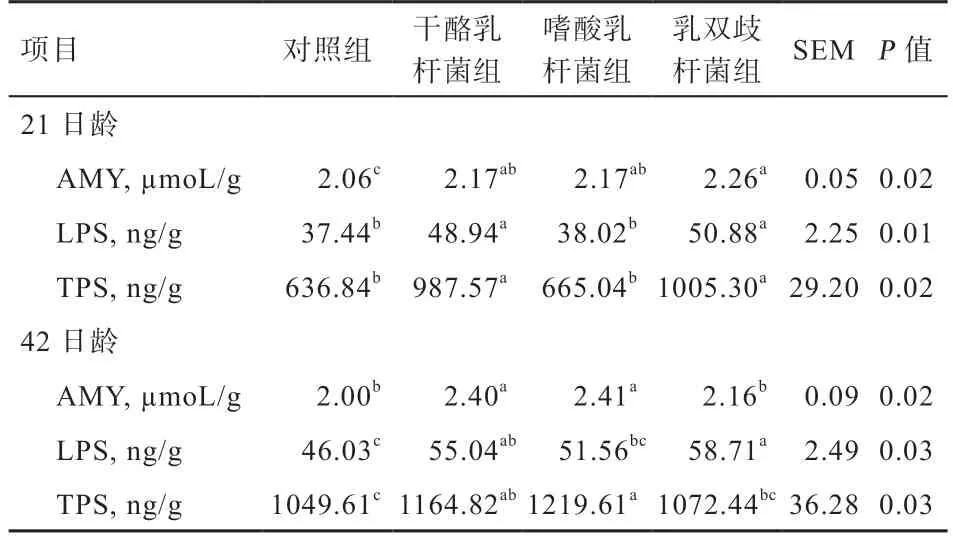
表3 不同益生菌对肉鸡空肠消化酶活性的影响

表4 不同益生菌对肉鸡小肠形态变化的影响
2.4 不同益生菌对肉鸡空肠GLUT2表达的影响 如图1所示,在21 d 时,与对照组相比,空肠GLUT2mRNA 表达量在乳双歧杆菌组中最高(P<0.05),其次是干酪乳杆菌组(P<0.05),嗜酸乳杆菌组GLUT2mRNA 的表达上调,但不显著(P>0.05)。在42 d 时,与对照组相比,3 个益生菌组皆上调了GLUT2表达(P<0.05),且嗜酸乳杆菌组GLUT2mRNA 表达量高于干酪乳杆菌组与乳双歧杆菌组(P<0.05)。
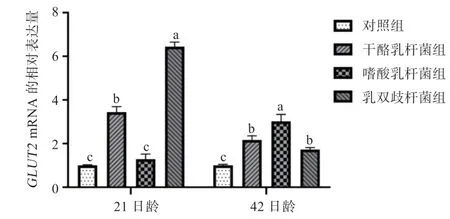
图1 不同益生菌对肉鸡GLUT2 mRNA 表达的影响
3 讨 论
3.1 益生菌对肉鸡生产性能的影响 家禽生产性能可反映其所具有高效生产经济产品的能力。本研究结果显示,益生菌对肉鸡的ADFI 没有影响,但可改善肉鸡ADG 与F/G,表明试验所用菌株可改善肉鸡的生长性能且不会影响鸡的食欲。夏亿等[7]发现,1×109CFU/kg 发酵乳杆菌可抵抗致病菌,使肉鸡ADG 和ADFI 分别提高3.21%和2%,提高生长性能。刑爽等[8]分析发现,饮水或饲料中添加105~1010CFU/g 的乳酸杆菌能显著促进1~42 d肉鸡的生长,且促生长作用在前期效果较好。Ahmed 等[9]研究表明,日粮中添加5 g/kg CJP(含嗜酸乳杆菌等多菌株于香橙发酵的副产品,微生物浓度为2×107CFU/g),对35 d 的肉鸡有相同的积极效应。然而,也有一些研究报道结果与之相反。王雪飞等[10]和Samanya 等[11]研究发现,7.67×107CFU/g 的双歧杆菌和108~1010CFU/g的纳豆枯草杆菌对肉鸡的ADG、ADFI 和耗料增重比均无显著影响。Karaoglu 等[12]研究发现,4×108CFU/g的酿酒酵母对肉鸡的生长和屠宰性能没有影响。有研究表明,益生菌对动物生产的有益作用可能与肠道微生物群的变化有关[13]。1.0×1010CFU/g 的乳杆菌可增加肠道中乳酸菌和双歧杆菌属数量,降低大肠杆菌等致病菌数量,降低死亡率[14]。2.0×1010CFU/g 的芽孢杆菌可增加厚壁菌门与硬毛门的丰度,较高的厚壁菌门与拟杆菌比率、硬毛门与拟杆菌比率可导致肥胖,进而提高肉鸡的生长性能[15]。益生菌的有益作用存在差异,这种差异可能由微生物种类和制备方法、给药浓度和方式以及鸡的品种、饮食组成和卫生条件等许多因素造成。此外,本研究中乳双歧杆菌提高肉鸡生产性能的效应比干酪乳杆菌和嗜酸乳杆菌好,这可能由于乳双歧杆菌在胃肠道中的生存能力较高,胃肠道中有效的菌株可竞争排除致病菌,刺激免疫和增加上皮完整性,更好地利用营养物质,从而在动物体内带来健康益处。
3.2 益生菌对肉鸡空肠消化酶活性的影响 肠道消化酶在营养物质利用过程中至关重要。消化酶特异性活性的增加有助于提高胃肠道营养的可获得性。多年来,关于益生菌影响肠道消化酶活性的相关报道多种多样。李璐琳等[16]研究表明,27 d 起饮水饲喂1.374×107CFU/mL的酵母菌发酵液能显著提高56 d 肉鸡十二指肠AMY 活性。Jin 等[17]对鸡补充1~2×109CFU/g 的嗜酸乳杆菌或其培养物,发现40 d 后小肠AMY 水平显著增加,但未显著增加TPS 水平。刘婷[18]对肉鸡灌胃2.15×108CFU/mL的短乳杆菌M8,发现56 d 后小肠AMY 活性提高18.52%,TPS 活性提高29.17%。郭元晟等[19]研究表明,2×106CFU/mL 的干酪乳杆菌对空肠与回肠中AMY 活性、十二指肠中TPS 刺激作用显著,对小肠LPS 活性无影响。而本试验结果发现,饮水饲喂1%发酵菌能显著增加空肠AMY、LPS、TPS 活性,且益生菌对消化酶影响的差异与喂养周期和菌株类别有关。干酪乳杆菌与乳双歧杆菌对空肠消化酶活性的刺激作用在生长初期最好(1~21 d),而嗜酸乳杆菌的的最佳效应表现在生长后期(22~42 d)。益生菌对消化酶的作用模式可能包括其在肠壁快速定殖并产生能抑制有害细菌生长的物质,保护肠道不被感染,为酶生存提供更好的环境;益生菌代谢活动降低消化液的pH,促进消化酶合成与分泌。消化酶活性增加提高了食物中营养的利用率,进而更好解释益生菌对生长性能与饲料利用率的有益作用。
3.3 益生菌对肉鸡小肠形态变化的影响 肠道上皮的结构和完整性是影响消化能力的重要因素,绒毛是肠上皮结构最明显的特征,它包含一个动态的、自我更新的上皮细胞群。一般来说,高V/C 值表明肠绒毛的细胞充分成熟并且功能活跃,有较大的肠表面积,便于吸收营养,同时伴有较浅的隐窝,细胞不断更新,以促进肉鸡生产。大量研究表明,益生菌对肠结构形态发育有益。史洪涛等[20]发现,在饮水中添加1.0×109CFU/mL 的乳酸菌可提高肉鸡小肠VH 与V/C 值,CD 降低,小肠形态结构改善。Awad 等[21]表示,饲料中添加108CFU/kg 乳杆菌可增加肉鸡十二指肠VH。104CFU/mL 的肠球菌和109CFU/kg 的芽孢杆菌也有此积极效应[22-23]。本研究结果也表明,3 种益生菌均能改善肠道形态,在整个生长阶段(1~42 d)内,乳双歧杆菌对小肠绒毛组织形态发育的影响最显著,其次是干酪乳杆菌,而嗜酸乳杆菌在肠道中的最佳效应主要体现在生长后期(22~42 d)小肠前段的绒毛发育。近年来,研究发现,短链脂肪酸(SCFA)是肠上皮细胞必须的能量来源[24]。肠性能参数的改善可能是由于益生菌发酵降低pH,增加渗透压,促进质子交换产生大量SCFA,SCFA 调节上皮细胞的分化和凋亡,改善肠道微结构,刺激黏膜发育,增加吸收表面积和吸收能力,最终提高饲料利用效率。益生菌提高营养物质消化率及其可用性吸收,反过来可增强消化酶活力。
3.4 益生菌对肉鸡GLUT2表达的影响 营养物质从肠腔的吸收以及随后供肠和其他组织使用的有效性都需要一些营养转运体的作用。在葡萄糖转运体中,GLUT2是一种高容量的促进性转运蛋白,可运输单糖跨越基底外侧膜,并在葡萄糖刺激细胞后转移到刷状缘,确保葡萄糖穿过肠腔被吸收到细胞中,随后进入血液或淋巴系统[25-26]。GLUT2表达量可能是决定肠道消化吸收能力的重要因素,其特殊生理作用涉及葡萄糖、蛋白质和脂质稳态。有研究表明,喂食肉鸡109CFU/g 的乳酸菌可在较低温度下增加糖转运体基因的表达[27]。1010CFU/g的芽胞杆菌可激活空肠中GLUT2的表达[28]。本研究结果也表明,3 种益生菌均能调控GLUT2过表达,且上调效果存在微生物种类以及饲喂时间的差异。益生菌的增强效果可能与其改变肠道pH、发酵产生高水平的总SCFA(包括丙酸和丁酸)等生物学作用有关。研究发现SCFA 可作用于转运蛋白基因的表达,SCFA 可增加回肠GLUT2mRNA 和蛋白质的丰度[29]。丁酸盐是肠道菌群产生的SCFA 之一,体外暴露于丁酸盐培养液中的回肠细胞,其GLUT2启动子被激活,GLUT2mRNA丰度较高,作用方式受丁酸盐剂量和孵育时间的影响[30]。此外,本试验中3 种益生菌在转运蛋白基因表达上作用效果的差异与其在消化酶活性、肠道微结构上的作用效果相似。因此,益生菌刺激肠道消化酶的增殖,引起肠壁结构形态的改变,可能刺激GLUT2过表达参与营养转运过程,营养物质流量的增加进一步促进肉鸡的生长性能。但以目前研究结果来说,益生菌对营养转运蛋白的具体作用机制尚不清楚,还有待进一步研究。
4 结 论
本研究结果表明,益生菌能够增加消化酶的分泌和活性、改善消化道形态,调节细胞膜GLUT2过表达,促进营养物质转运,进而提高肉鸡的生长性能;且3 种益生菌相比,乳双歧杆菌在肠道内具有更高的活性,肉鸡表现出较好的生长性能。

