大熊猫酶标孕酮的制备与检验
赵卫平,李 婵,洪 金,林鹏飞,*,雷颖虎,*
(1.秦岭大熊猫研究中心,陕西 周至 710402;2.西北农林科技大学)
大熊猫是我国特有珍稀动物,冠有国宝美称,尽管被划分为国家一级保护动物,其数量却仍然增长缓慢。除了人为因素的影响,这还与其独特的生理繁殖机制有关,大熊猫是单季节发情动物,发情时间短,仅有1~3 d,如何精准判断大熊猫的发情期是提升大熊猫繁殖率的最关键一步。孕酮(Progesterone,P4)和雌激素(Estrogen)做为雌性动物发情时变化最为剧烈的两种激素,且在动物尿液中就可检测到,因此可作为大熊猫无侵入损害的一个检测指标。
目前ELISA检测技术已大量应用于激素检测,HRP是ELISA试剂盒显色体系的主要成分之一,其与抗原或者抗体结合可以形成酶标抗原或酶标抗体从而应用于ELISA试剂盒中。P4为半抗原,化学结构相对稳定,不能与HRP直接结合,需要用11α-OH-P4进行化学修饰后与HRP结合,因此本试验旨在合成用于孕酮检测的ELISA试剂盒的辣根过氧化物酶酶标的P4-HRP偶联物,为后续开发大熊猫孕酮ELISA检测试剂盒提供所需的酶标抗原。
1 材料与方法

表1 试剂及耗材
1.2 主要仪器

表2 试验用仪器
1.3 方法
1.3.1 孕酮-半琥珀酸酯的合成 ①称取5 g 11α-羟基孕酮(11α-OH-P
4)、5.96 g 琥珀酸酐与2.6 g 4-二甲氨基吡啶(DMAP)于圆底烧瓶中,加入200 mL二氯甲烷,搅拌回流反应5 ~10 h;②薄层色谱反应(Thin layer chromatography,TLC)同时进行跟踪反应进度,展开剂为V乙酸乙酯:V石油醚=10∶1;③待反应完全后,将反应液用60 mL二氯甲烷稀释;④纯化:反应液用10 mL去离子水萃取1次,10 mL 2 M 盐酸萃取2次,最后用去离子水萃取2次;⑤干燥脱色:加入无水硫酸钠干燥,活性炭室温搅拌脱色,过滤得无色澄明液,减压蒸尽二氯甲烷,干燥得到白色结晶产物,即为11α-羟基半琥珀酸酯(11α-OH-P4-HS)。
1.3.2 11α-OH-P4-HS的鉴定 (1)11α-OH-P4-HS的TLC鉴定反应至终点时,取少量反应液,进行TLC鉴定;(2)11α-OH-P4-HS的产率鉴定产率即合成反应中实际产物的量与理论值的比值。在此合成反应中,反应物 11α-OH-P4的物质的量与合成11α-OH-P4-HS的物质的量的比值根据公式①计算:
产率= n(11α-OH-P4)/ n(11α-OH-P4-HS)× 100%
(公式①)
1.3.3 孕酮酶标抗原的制备 ①取11α-OH-P4-HS 2.6 mg,N-羟基琥珀酰亚胺(NHS)0.9 mg和二环己基碳二亚胺(DCC)1.3 mg置于5 mL三角烧杯中,滴加0.15 mL二甲基甲酰胺(DMF),混匀后4 ℃过夜;②次日发现有尿素衍生物结晶析出,说明已有孕酮衍生物的NHS活化酯形成;③取HRP 2 mg,用2 mL 0.1 M NaHCO3溶解,室温下加活化酯2 μL搅拌,每10秒加2 μL,共10 μL。继续搅拌8 h,用0.04 M pH 7.2的PBS 1 000 mL搅拌透析24 h,期间换液三次。
1.3.4 酶标抗原的鉴定 (1)免疫学鉴定①包被:5 ng/mL 的P4单克隆抗体加入酶标板,每孔100 μL,4 ℃过夜,倒出孔内液体,洗涤液洗3次,拍干;②封闭:每孔加封闭液200 μL,37 ℃ 2 h,弃封闭液,洗涤液洗3次,拍干;③抗原反应:11α-OH-P4、HRP以及产物,倍比稀释为1∶100、1∶200、1∶400、1∶800和1∶1 600,每孔100 μL,37 ℃ 60 min,弃反应液,洗涤液洗3次,拍干;④显色:每孔加新鲜配制的底物溶液100 μL,显色10~15 min;⑤终止:每孔加终止液50 μL;⑥读数:在450 nm处测定光密度(OD)值。(2)紫外扫描鉴定将一定浓度的半抗原、载体蛋白以及偶联产物利用紫外分光光度计在200 nm-400 nm处进行扫描,通过扫描波长的变化,判断偶联是否成功。(3)酶标记率采用超微量紫外分光光度计,读取酶标复合物的 OD260 nm 值、OD280 nm值以及 OD403 nm值,根据公式分别计算酶标复合物中的酶结合量与抗原含量,计算其酶标记率。
酶结合量=OD403nm×0.42 (公式②)
抗原含量=(OD280nm-OD403nm×0.42) ×0.94×0.62 (公式③)酶标记率=P4-HRP中的酶量(mg) /加入的HRP酶量(mg)×100%(公式④)
2 结果
2.1 孕酮-半琥伯酸酯的鉴定
2.1.1 孕酮-半琥珀酸酯的 TLC 鉴定 由于11α-OH-P4和11α-OH-P4-HS分子结构的差异,二者极性也存在差异。本研究中,11α-OH-P4-HS在展开剂中的吸附性较强,而11α-OH-P4的吸附性较弱,因此,移动距离大的点为11α-OH-P4与副反应产物,移动距离小的点为11α-OH-P4-HS,鉴定结果如图1所示,该反应已完全。

图1 薄层色谱鉴定
2.1.2 孕酮-半琥珀酸酯的合成产率 根据公式①计算可得,11α-OH-P4-HS的产率为78.64%。
2.2 酶标抗原的鉴定
2.2.1 酶标抗原紫外扫描鉴定 紫外扫描鉴定见图2,P4-HS、HRP以及产物三者的紫外扫描图差异较大,产物紫外扫描于HRP、P4-HS均有不同。反应中小分子物质经透析已去除,因此推测产物为HRP偶联物。
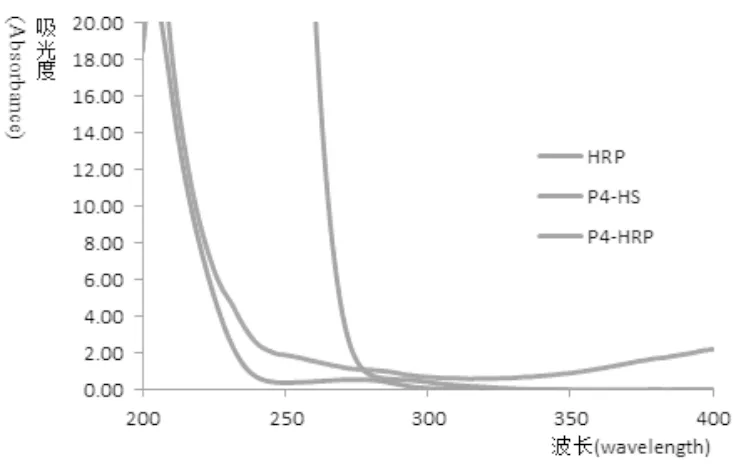
图2 紫外扫描鉴定结果
2.2.2 免疫学鉴定 免疫学鉴定如图3所示,产物随稀释倍数增大,其OD值减小,HRP和P4-HS的OD值基本不随浓度变化而改变。结果表明,产物与P4单克隆抗体发生特异性反应,而HRP、P4-HS不会与之发生反应,即产物对P4单克隆抗体具有免疫学特性,HRP、P4-HS对P4单克隆抗体不具有免疫学特性。结合图3结果,产物为HRP的偶联物,HRP的偶联物与P4单克隆抗体具有免疫学特性,则推测该偶联物为P4-HRP。
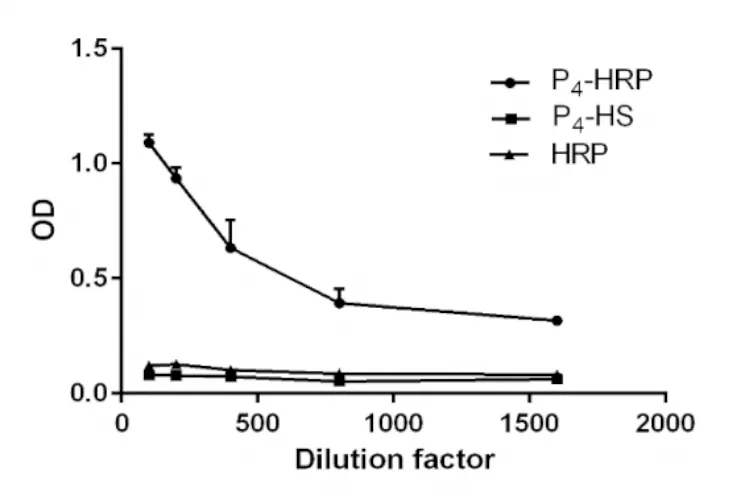
图3 免疫学鉴定结果
2.2.3 酶标记率 经过超微量紫外分光光度计检测酶标复合物的 OD280nm 与 OD403nm 值,吸光度值分别为1.325、2.726,酶结合量1.145,其中抗原含量0.105,酶标记率22.9%。
3 讨论
11α-OH-P4官能团为稳定的羟基,不能直接与HRP结合,需要先将羟基通过DMAP催化,变为较为活泼的酯基,即11α-OH-P4-HS,再用偶联了琥珀酸酐的11α-OH-P4-HS进行试验偶联。羧基可以通过碳二亚胺与HRP中赖氨酸的氨基偶联,形成酶标抗原。
碳二亚胺法合成完全抗原时,HRP中赖氨酸数量对酶标记率起决定作用。运用碳二亚胺法合成偶联物,碳二亚胺(DCC、EDC)为中间物,活化11α-OH-P4-HS的羧基,在NHS的催化下,与HRP上的赖氨酸中氨基形成酰胺键偶联,因此一个HRP上可以偶联多个11α-OH-P4-HS,综上,在碳化二亚胺反应中,11α-OH-P4-HS加入量应略微过量。
在反应中,过量的11α-OH-P4-HS以及碳二亚胺DCC、EDC和催化物NHS,均可能以不同的化学形态存在于终产物中,因此终产物中的很多副产物须进行纯化去除。常用的纯化方法有透析和凝胶层析两种,由于透析法较凝胶层析法简单、易操作、可行性强,因此本研究选择透析纯化法。为取得较高保留率,本试验选用8 000-14 000分子密度的透析袋,截留分子量值约为保留的大分子值的一半,且实验中小分子值远小于最小保留量8 000;试验中除偶联物与载体蛋白外,其它都是小分子物质,因此终产物仅有蛋白以及蛋白偶联物。
本试验目的是制备用于ELISA试剂盒的P4-HRP,因此在鉴定制备是否成功时,首先选择免疫学检验,通过倍比稀释P4-HRP,使其与相应抗体反应,同时用11α-OH-P4和HRP做对照,检测P4-HRP与P4抗体反应灵敏度。理论上11α-OH-P4与对应应一抗也存在特异性反应,但本试验中不明显或不存在,可能因为11α-OH-P4是小分子物质,在封闭过程中,其抗原表位可能被封闭液掩埋,因此特异性反应不明显。通过11α-OH-P4、HRP以及P4-HRP三者不同的紫外扫描曲线与峰值,鉴定抗原制备成功与否是本试验的关键。碳二亚胺法合成P4-HRP的过程缓慢而复杂,存在很多终产物,即使经过透析纯化,也可能存在载体蛋白及载体蛋白复合物,这些复合物的紫外扫描曲线与反应物的也不同。因此紫外扫描法不能完全判定偶联是否成功,还需结合免疫学检验进行鉴定。

