草甘膦对微生物影响的研究进展
梁鑫 张宝善 刘继瑞 余偲 陈思雨
(1. 陕西师范大学食品工程与营养科学学院,西安 710119;2. 安康市农业综合执法支队,安康 725000)
草甘膦(Glyphosate)在1959年被化学合成,1971年开始用作农业除草剂,因其高效、广谱、廉价等特点而广泛应用于去除农作物中的杂草[1]。现已发现它可清除超过100种一年生杂草和60种多年生杂草,成为世界上应用最广、产量最大的农药品种,其年销售量一直居农药之首。2019年仅中国就生产草甘膦5.5×105t,占全球生产量的60%,也是全球第四大应用市场。几十年来,草甘膦一直被认为是一种安全、高效的除草剂,容易经过电化学氧化、光催化降解、微生物和植物的降解与吸附,还容易被生物作为营养重新利用和吸收,对保障全球粮食产量的贡献等同于百年来青霉素对抗击疾病的作用。为了更好地使用草甘膦,扩大应用领域,抗草甘膦的转基因大豆、烟草、棉花相继被培育成功并在全球大面积种植[2]。
随着草甘膦在全球的推广和使用,一些负面作用日趋明显。国际癌症研究机构(IARC)对草甘膦安全性提出严重质疑,并在2015年将草甘膦归类为“可能的人类致癌物”(第2A组),引起了全球轰动[3]。虽然美国、欧洲化学品管理局(ECHA)、联合国粮农组织(FAO)和欧盟以外的许多组织(如加拿大、日本、澳大利亚和新西兰)都对IARC的说法提出反对意见,但不少国家和学者对草甘膦及其代谢产物的生物安全、暴露值及危害因子等愈发重视,主要争论点集中于:(1)在环境中的残留量;(2)对生态的影响;(3)对动植物和人体的安全性。诸多报道表明,在海水、淡水、土壤、大气等环境中,都不同程度地检测到草甘膦及其中间代谢产物氨甲基膦酸(AMPA)。疏松土壤中的蚯蚓在使用除草剂后生命活性下降;使用草甘膦种植的小麦被加工成面粉后,在面粉中检测到了草甘膦;草甘膦被用于茶园除草后,在茶园和茶叶上均检测到了一定含量的草甘膦及其代谢物AMPA。Ledoux等[4]研究发现,蜜蜂占主要作物授粉昆虫总数的80%,它在觅食过程中,可通过花粉、花蜜、水和灰尘接触草甘膦,并将污染物转移到蜂巢[5]。从蜂箱直接采集的蜂蜜样品和从商店购买的蜂蜜样品中,分别有27%和33%的样品可检测到草甘膦残留。草甘膦可能会损害蜜蜂的健康,包括扰乱其肠道菌群、减轻幼虫体重、减少短期记忆、损害觅食者的联想记忆[5],还可能会降低幼体存活率。在美国夏威夷,从“有机”农产品上也检测到草甘膦残留物[6]。加拿大食品检验机构(CFIA)在2015年至2016年期间对3 188份食品样品进行了测试,发现29.7%的样品含有草甘膦[6]。欧盟对水果、蔬菜和其他食品进行了检测,发现45%的样品可检测到的农药残留,其中大约8%的样品含有草甘膦。Cuhra等[7]用含草甘膦的饲料养鸡,在其肝、脾、肺、肠、心和肾等不同器官中均检测到了草甘膦[8-9]。从德国和丹麦奶牛的尿液中检测到草甘膦的含量分别为20 μg/L和40 μg/L,但在不使用草甘膦的地区,奶牛尿液中的草甘膦含量低于2 μg/L。其它研究结果显示,草甘膦对脊椎动物具有遗传毒性[10]、致畸性、细胞毒性并会导致细胞凋亡[11]。
草甘膦会影响动物中枢神经系统中的神经递质,还会抑制细胞色素P450酶系的作用与合成,并会促进人体内雌激素依赖性乳腺癌细胞增殖[12]。其他证据还显示,草甘膦还能使人类乳腺上皮细胞、胎盘细胞、脐带细胞中的DNA以及细胞水平上的内分泌系统受损[13],并对精子具有毒性。草甘膦在人体内的作用方式主要是抑制乙酰胆碱酯酶(AChE)的活性,AChE又影响雄激素和雌激素的合成,因而草甘膦会导致人体内雌雄激素失衡[14]。因此,近年来许多国家对草甘膦在农产品的最大残留量(MRLs)进行了规定(表1),欧盟的部分国家、印度、越南和斯里兰卡等国提出限制和逐步禁用草甘膦的政策,中国贵州省在2014年也禁止在茶园中使用草甘膦。
微生物是地球生态系统中的重要组成部分,它的存在维持了自然生态系统的平衡。从草甘膦用于除草剂开始,人们认识到其抑制杂草生长的机理与抑制微生物的机理基本相同,由此推断,草甘膦对微生物的危害程度可能更甚于对植物的影响。但分析诸多的研究报道后发现,多数学者更关注将微生物作为基因的载体和工具用于寻找微生物的抗(耐)草甘膦基因和发现可降解除草剂的微生物等方面,而对草甘膦等除草剂影响微生物尤其是有益微生物的生长代谢、遗传变异和生物群落演变的深入研究却较少。
1 草甘膦对植物和微生物的作用机制比较
生化研究表明,原核微生物的细菌、放线菌,真核微生物的酵母、霉菌与植物的芳香族化合物代谢途径是一致的,均经过莽草酸途径进行生物代谢[16]。基于莽草酸途径,在植物学研究方面开发了以草甘膦为基础的除草剂和大量的转基因农作物;在微生物学方面,利用大肠杆菌(Escherichia coli)、谷氨酸棒杆菌(Corynebacterium glutamicum)、酿酒酵母(Saccharomyces cerevisiae)等微生物进行生物合成天然和非天然芳香族化合物及其衍生物,如“达菲”药物合成前体莽草酸、大宗化学品己二酸前体顺,顺-黏康酸、化妆品活性成分熊果苷等化合物。江晶洁等[17]利用阻断草甘膦莽草酸途径,通过合成芳香族氨基酸达到控制植物生长的目的,其机理见图 1[2]。
有关草甘膦除草的作用机理已认识清楚,许多学者都认为草甘膦对微生物作用的生理生化机制和对植物的作用机制基本相同[18]。莽草酸-3-磷酸合酶(EC 2.5.1.19)是植物、真菌、藻类和细菌莽草酸途径的关键酶,催化磷酸烯醇丙酮酸(PEP)到莽草酸3-磷酸(S3P)的5-羟基位置的烯醇丙酮酸部分的转移,从而促进分支酸和芳香氨基酸的生物合成[19]。草甘膦通过抑制5-烯醇丙酮莽草酸-3-磷酸合成酶(EPSPS)来阻止某些细菌和真菌中苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸的合成,EPSPS也会导致敏感微生物中莽草酸-3-磷酸和羟基苯甲酸的积累和排泄。动力学特征证明,草甘膦是一种可逆的EPSPS抑制剂,通过与PEP竞争结合到活性位点。细菌EPSPS对草甘膦的敏感性差异很大,Pollegioni等[19]将植物和微生物EPSPS分为两类:敏感类(I类)和相对不敏感类(II类)。细菌,如鼠伤寒沙门氏菌(Salmonella typhimurium)、大肠杆菌和假单胞菌(Pseudomonas putida)属于I类,在低浓度除草
剂下EPSP合成酶被抑制,如E. coli的 EPSPS对草甘膦具有高度敏感性(IC50 1.6 μmol/L);Ⅱ类指草甘膦耐受微生物,包括农杆菌CP4(Agrobacterium sp. CP4)、无色杆菌(Achromo bacter sp.)和假单胞菌PG2982(Pseudomonas sp. PG2982),后来又发现了其它的Ⅱ类EPSPS,通常是G+细菌,包括肺炎链球菌(Streptococcus pneumoniae)和金黄色葡萄球菌(Staphyloccocus aureus),其对草甘膦的抗性是由EPSPS氨基酸序列的变异引起的[20]。
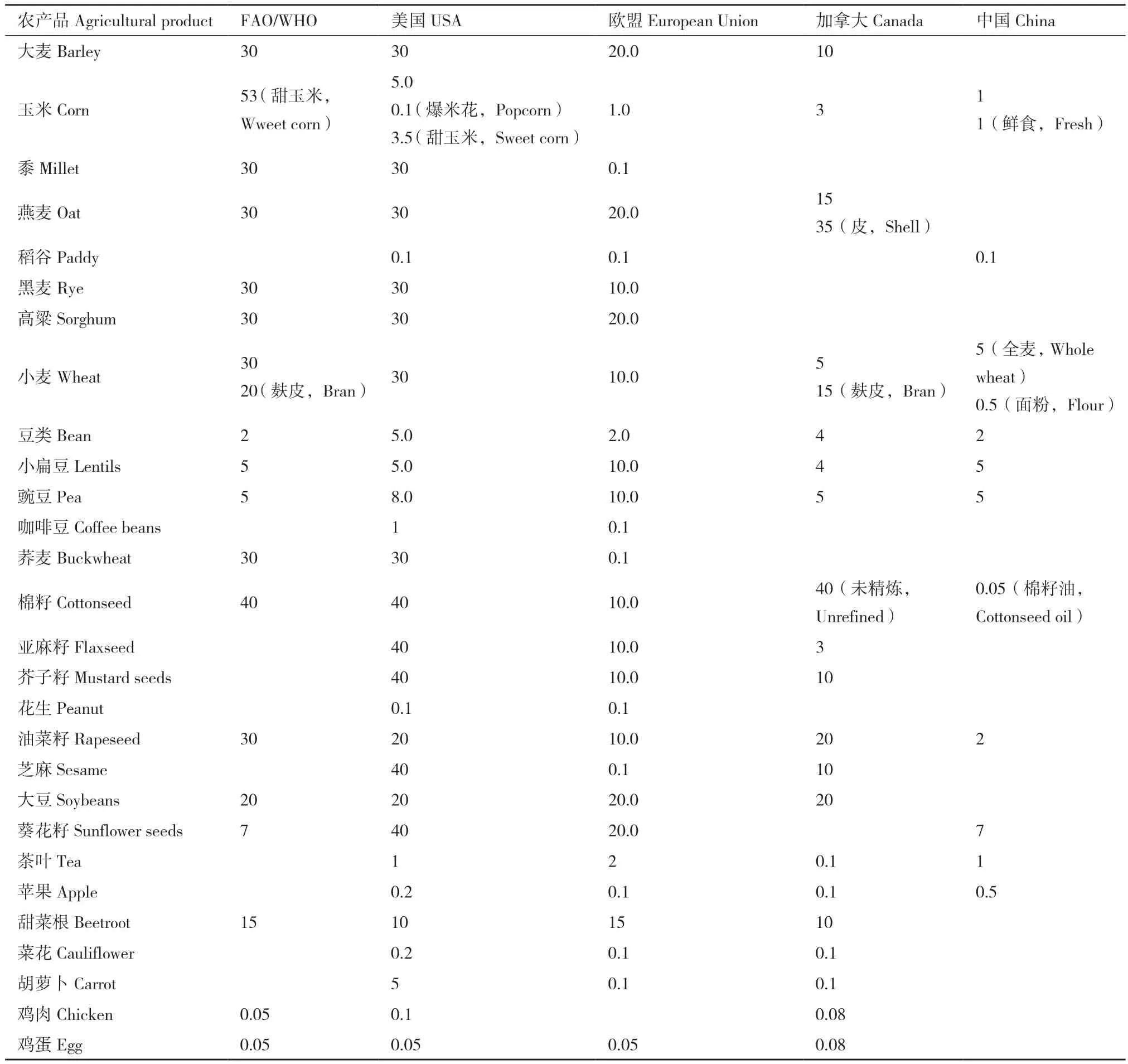
表1 主要农产品中草甘膦最大残留量(MRLs,mg/kg)[15]Table 1 Maximum residues of glyphosate in main agricultural products

图1 莽草酸合成芳香族氨基酸的途径及草甘膦对 EPSPS 催化反应的作用方式Fig.1 Pathway of shikimic acid to synthesize aromatic amino acids and the action mode of glyphosate on the catalytic reaction of EPSPS
生物学家根据草甘膦阻断植物和微生物莽草酸途径机理,通过基因改良获得了许多能够抗草甘膦、或能降解和利用草甘膦的微生物菌株,对消除草甘膦在自然界富集和阻止生态被破坏起到了重要作用,同时将微生物中的抗草甘膦基因用于植物,培育了大豆、玉米、烟草等许多抗草甘膦的转基因农作物[21]。但人们关注更多的是:哪些微生物能抗草甘膦?哪些能分解草甘膦?如何将微生物抗草甘膦基因整合于植物中以获得高抗性的转基因植物?而有关草甘膦对微生物的详细抑制机制却鲜有报道。
2 草甘膦对土壤微生物的影响
土壤微生物是保持农田生态系统的基础,也是评价土壤质量的重要指标,其多样性直接关系到农业生态系统的稳定性。草甘膦是一种极性分子,有磷酸基、氨基和羧基3个活性基,容易被土壤牢固吸附且不易流失。土壤中草甘膦来源途径有:(1)人为活动直接喷洒于土壤表层;(2)通过水灌溉或雨雪带入;(3)经植物叶茎吸收传输;(4)通过微生物及其它生物间接输送。
长期以来,有关草甘膦对土壤微生物的影响研究结果分为两类:一类学者认为,其对土壤微生物个体和群体影响不大,在土壤生态系统中,草甘膦可被微生物和植物降解、再吸收,土壤和微生物之间存在自平衡作用[20]。Hart等[22]研究了施用草甘膦19年后的土壤,与未经处理的对照组相比,试验组中微生物生物量、呼吸和氮矿化没有差异。Powell等[23]在4年间对转基因大豆与近等位系敏感品种进行了比较,发现二者根系微生物对凋落物分解速率基本相同,但草甘膦降低了土壤表层凋落物的分解速率,而对深层凋落物分解速率没有影响。凋落物中真菌生物量与细菌生物量的比值只是偶有不同,原生生物和线虫种群没有受到影响。但随着草甘膦的长期使用,常在地表水、河床沉积物及地下水中检测到草甘膦的主要代谢产物AMPA[24],因此另一类学者认为草甘膦对土壤微生物有重要影响,可直接作用于微生物个体和群体变化,进而改变土壤有机质含量和植物的抗病特性,最终影响了自然生态。陶波等[25]研究发现草甘膦对大豆根瘤菌(Bradyrhizobium japonicum)的抑制作用与草甘膦浓度呈正比,低浓度草甘膦对镰刀菌(Fusarium)产生激活作用,高浓度草甘膦对镰刀菌具有抑制作用,但伴随草甘膦加入时间的延长,其对大豆根瘤菌的抑制作用逐渐减弱。
将草甘膦直接作用于土壤微生物,研究发现,1 025 mg/kg草甘膦可完全抑制细菌和真菌的生长,(205-1 025)mg/kg的草甘膦对放线菌的抑制率达100%,(1.64-205)mg/kg的浓度对细菌种群也表现出抑制作用[26],同时发现,随着加药时间的延长,其对微生物的抑制作用逐渐减弱[27]。Zobiole等[28]发现,草甘膦处理对大豆根际土壤中镰刀菌、荧光假单胞菌(Fluorescent pseudomonads)、锰转化菌(Mn-transforming bacteria)和吲哚乙酸产生菌等微生物种群间的相互作用产生负面影响,导致有益的荧光假单胞菌、锰还原菌和吲哚乙酸产生菌数量减少,而有害的镰刀菌数量增加。根际假单胞菌、锰还原菌能够产生大量的次生代谢产物包括铁载体、氰化氢、胞外酶和各种抗生素,从而提高养分利用率并抑制竞争微生物群,介导锰转化(主要是锰还原),从而对植物养分利用和代谢过程产生重大影响。
Newman等[29]发现,空白对照相比,大豆和玉米经草甘膦处理后,各类蛋白细菌(Proteobacteria)相对丰度均有所增加,尤其γ-杆菌(Gammaproteobacteria)增加最多,玉米中增加1.5%,大豆中增加0.7%,这些菌属于黄单菌目(Xanthomonadales),主要是华杆菌科(Sinobacteraceae)和黄单胞菌科(Xanthomonadaceae)。经草甘膦处理后,酸杆菌(Acidobacteria)的相对丰度呈下降趋势,玉米和大豆的放线菌平均相对丰度分别从16.45%和14.35%降至14.95%和12.60%。
Mandl等[30]发现,与机械除草相比,使用草甘膦处理杂草的葡萄园中,在土壤中没有检测到毛霉,但有160多种不同的细菌被发现,其中一些是第一次在葡萄园土壤中检测到。经对比发现,经除草剂处理的土壤细菌中总数比机械除草处理的土壤中高260%,因此认为是除草剂引起了葡萄园土壤中微生物的种类变化。贫瘠土壤中微生物的生物量随着甘膦施用量的增加而减小。
草甘膦加入土壤后,对酸性土壤、中性土壤和碱性土壤的真菌群落多样性都产生了一定的影响。陈望舒[31]研究发现,草甘膦进入土壤会抑制酸性土壤和中性土壤的细菌多样性,但可促进碱性土壤中的细菌多样性。酸性土壤中蜡样芽胞杆菌(Bacillus)和链霉菌属(Streptomycetaceae)可以降解草甘膦,为自身提供碳和氮源,因此酸性土壤中的草甘膦更容易被降解。另外,通过对比施用草甘膦的贫瘠和肥沃土壤中微生物的微量热曲线发现,微生物均随着草甘膦浓度的增大而出现代活动变缓的现象,而肥沃土壤对微生物具有一定的保护作用,其半致死量(IC50)是贫瘠土壤的2.2倍[32]。
研究还发现,在较高的草甘膦使用量下,微生物生物量碳(Cmic)降低了45%,可培养细菌和真菌数量分别减少了84%和63%,真菌生物量减少了29%[33]。但在此条件下,革兰氏阴性(G-)菌群的分解代谢活性显著提高。DGGE分析表明,草甘膦使用量大的土壤中的细菌群落以G-细菌为主,通过基因检测抗草甘膦基因的复制数量显著增加,主要为罗尔斯通氏菌(Ralstonia sp.),γ-变形菌(Gammaproteobacterium)和伯克霍尔德菌(Burkholderia sp.)。由于G-细菌具有特定的细胞壁结构,因此比其它微生物更能抵抗化学威胁,并能够降解一些化学物质[34]。虽然草甘膦对土壤微生物群落的影响不同,但总体趋势是随时间推移,细菌群落组成自适应地向更耐草甘膦的物种转移[35]。已有学者初步发现草甘膦转基因植物根际土壤微生物的变化规律[20],草甘膦的使用导致大多数根际细菌和所有真菌生物量减少,并通过改变细菌群落的组成从而有利于更多耐草甘膦的细菌微生物群落的产生,随后这可能影响到碳(C)、氮(N)和磷(P)循环。草甘膦在转基因作物上使用后最初在分泌物中释放,后来从腐烂的组织中释放,还可通过根部释放,在抗草甘膦转基因(GR)的玉米根中也发现类似的转移模式,施用草甘膦4 d后,根际土壤中草甘膦浓度达到0.07 mg/kg。刘慧璐等[36]研究了种植抗草甘膦转基因大豆对土壤微生物数量的影响,连续几年的试验结果均发现,种植转基因大豆显著降低了土壤细菌、氨化细菌和硝化细菌的数量。她们认为转基因大豆不同程度地降低了根际土壤细菌的数量和细菌群落的多样性,并且对根际土壤细菌属(Nitrospira sp.)有一定抑制作用。对草甘膦影响GR大豆根际Mn氧化剂和Mn还原剂比值的观察发现,草甘膦降低了土壤中的植物有效锰和植物对Mn的吸收,进而影响了微生物的变化。
Druile等[37]研究了草甘膦对丛枝菌根(Arbuscular mycorrhiza)孢子活力及定殖能力的影响,发现播种1个月后,未经除草剂处理的土壤孢子活力比处理组高5.8-7倍,经处理的土壤中植物根系定殖率显著低于未处理的土壤中植物根系定殖率,又因为丛枝菌根是宿主和真菌养分交换的主要场所,因此草甘膦影响植物根系丛枝菌根真菌的生理活性从而影响到根系植物的定殖作用。该结果同时意味着植物和真菌的共生功能受到了影响,并推测丛枝菌根繁殖体活力的下降可能会影响植物多样性[37]。
3 草甘膦对有益微生物的影响
随着草甘膦使用时间延长,人们发现自然界中越来越多的生物含有草甘膦。微生物处在生态循环的最低端,草甘膦不仅影响到微生物个体和群体的变化,更重要的是以微生物为介质影响动植物和人类的生命活动。不同种类的微生物EPSPS对草甘膦的敏感性不尽相同,许多革兰氏阴性细菌如大肠杆菌和鼠伤寒沙门氏菌(Salmonella typhimurium)在低浓度的草甘膦条件下生长被抑制;而农杆菌CP4、无色杆菌和假单胞菌PG2982(Pseudomonas sp.PG2982)等菌株的EPSPS对草甘膦不敏感,能在高浓度的草甘膦中存活[19],后来又发现一些革兰氏阳性菌,包括肺炎链球菌(Streptococcus pneumoniae)和金黄色葡萄球菌(Staphylococcus aureus)也对草甘膦不敏感,这一类菌大部分都属于有害微生物。 早 在 1987年,Chakravarty等[38]研 究 了 草甘膦和其商品Roundup对大毒滑锈伞(Hebeloma crustuliniforme)、 红 蜡 蘑(Laccaria laccata)、 美 洲革 菌(Thelephoraceae americana)、 蒺 藜(Tribulus terrestris)和牛肝菌(Suillus)这5株根生真菌的毒性,在浓度超过10 ppm时即可导致这些真菌生长缓慢。但研究学者还发现存在于小麦面粉中的草甘膦残留物,经酵母菌发酵面团1 h后,其含量降低约1/5,这与草甘膦煮沸7 h的量大致相同。Braconi[39]通过研究草甘膦对酿酒酵母生长活性的影响发现,草甘膦在3.04 mg/L的浓度下对松二糖的同化作用有抑制性,但对总代谢活性没有影响,而在304 mg/L的浓度下,草甘膦能够诱导L-脯氨酸的氧化和几种碳源(纤维二糖、龙胆二糖、麦芽三糖、麦芽糖醇、甘露醇和山梨醇等)的产生,并抑制D-核糖和松二糖的生成。与对照组相比,高浓度草甘膦能使酵母菌的代谢活性提高80%,他们认为酵母菌的这一特性可用来解释为何在面包发酵过程中,面粉中草甘膦的浓度会不断下降[39]。
Clair等[11]研 究 了 3种 食 品 微 生 物 白 地霉(Geotrichum candidum)乳酸乳球菌乳脂亚种(Lactococcus lactis subsp. Cremoris)和德氏乳杆菌保加利亚种(Lactobacillus delbrueckii subsp. Bulgaricus)对草甘膦的敏感性(表2)。结果发现,念珠菌(G. candidum)和乳酸乳杆菌(L. lactis)对草甘膦的敏感度比德氏乳杆菌(L.delbrueckii)更高,在Roundup®使用浓度在1 000 ppm下时,观察到保加利亚乳杆菌的细胞内容物似乎有漏出。通过分析不同微生物对草甘膦的敏感性度发现,真核细胞生物四膜虫(Tetrahymena pyriformis)比原核细胞微生物费氏弧菌(Vibrio fischer)对草甘膦更为敏感[40]。
后来,Shehata等[41]又研究了草甘膦在体外对家禽微生物群的潜在病原体和有益微生物的影响,发现肠沙门氏菌(Salmonella entritidis)、鸡伤寒沙门氏菌(S. gallinarum)、鼠伤寒沙门氏菌(S. typhimurium)、产气荚膜梭菌(Clostridium perfringens)和肉毒梭菌(C. botulinum)等高致病菌对草甘膦具有高度的抗性;而大多数有益细菌,如粪肠球菌(Enterococcus faecalis)、屎肠球菌(E.faecium)、栗褐芽胞杆菌(Bacillus badius)、青春双 歧 杆 菌(Bifidobacterium adolescentis)、 乳 酸 杆菌(Lactobacillus spp.)和弯曲杆菌(Campylobacter spp.)对草甘膦是中度至高度敏感的。有益菌中的肠球菌(Enterococcus)会抑制梭状芽胞杆菌[42],而草甘膦对肠球菌具有毒害作用,因此他推测草甘膦会干扰正常的肠道菌群。他还认为草甘膦可能是过去10-15年德国的牛感染肉毒杆菌风险增加的一个重要因素[9]。肠球菌和双歧杆菌(Bifidobacterium)对草甘膦敏感,而腐殖酸具有保护肠球菌和双歧杆菌不受草甘膦残留影响的功能,有助于减少草甘膦诱导的肠道有益菌失调的发生率,并降低肉毒杆菌感染的风险,因此认为腐殖酸会抑制沙门氏菌等病原体的生长。

表2 草甘膦对微生物的抑菌效果[11,41]Table 2 Antibacterial effect of glyphosate on microorganisms
4 能降解草甘膦的微生物
目前,减少生态环境中草甘膦的物理、化学和生物等方法较少。物理法有极性吸附剂吸附热、酸碱处理等。此外,光催化剂与紫外线联用可高效降解水介质中的除草剂,但这两种方法都有一定的局限性。利用微生物降解和转化草甘膦等除草剂是最有效的途径,也是当前研究的热点之一[43],此方法也称生物修复法,是指通过使用微生物的降解作用将污染物转化为毒性较小的化合物[44],微生物及其分泌的酶可高效分解自然环境中的化学污染物,是一种成本低且安全高效的方法[45]。草甘膦在自然环境中的降解速率取决于微生物的降解速率,因此发现并确定可以降解草甘膦的微生物对防治草甘膦污染至为重要[46]。
根据已发现的微生物降解草甘膦作用机制,可将微生物降解草甘膦的途径归纳为肌氨酸途径和AMPA途径(图2)。(1)肌氨酸途径:在微生物C—P裂解酶的作用下,草甘膦C—P键断裂,生成肌氨酸,生成的肌氨酸在肌氨酸氧化还原酶的作用下,快速代谢生成甲醛和甘氨酸,并参与微生物的多个生理循环和提供磷源;(2)AMPA途径:在草甘膦氧化还原酶(glyphosate oxidoreductase,GOX)作用下,草甘膦C—N键断裂,生成AMPA和乙醛酸,部分AMPA会被微生物分解代谢,发生C—P键断裂,未被完全分解的会被分泌出胞外进入环境或再被其它微生物吸收分解,最终被矿化[47],而乙醛酸则作为三羧酸循环的底物,参与微生物正常的代谢途径。进一步研究发现,微生物的肌氨酸途径在磷缺乏情况下才会发生,由于环境中大都存在充足的磷源,能满足微生物的需求,因此草甘膦在环境中主要代谢生成AMPA。经过肌氨酸途径代谢的降解菌是将草甘膦作为唯一磷源,诱导C—P裂解酶生成,而在自然环境下,环境中充足的磷源会负调节裂解酶,使降解菌失去裂解草甘膦的能力[48-49]。草甘膦的3种主要中间代谢物是AMPA、肌氨酸和乙酰草甘膦(Acetylglyphosate),它们会再通过不同的代谢途径被分解转化。
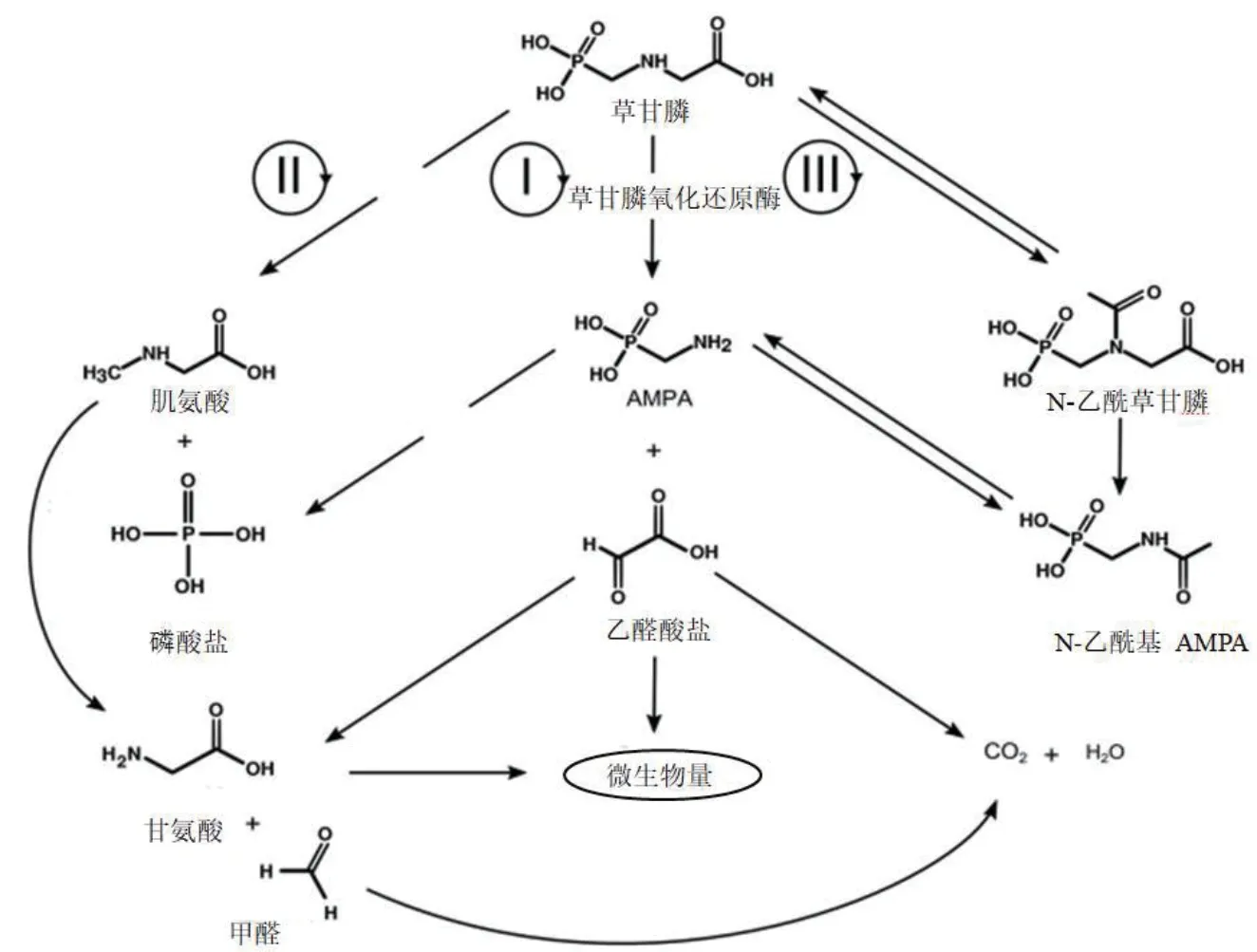
图2 草甘膦降解途径Fig.2 Degradation pathway of glyphosate

表3 降解草甘膦的微生物[47,51-53]Table 3 Microorganisms that can degrade glyphosate[47,51-53]

表3续表
自1983年Moore等[50]筛选出了降解草甘膦的假单胞菌PG2982细菌后,许多学者相继发现了有将草甘膦作为唯一磷源、或唯一碳源、氮源的微生物,也发现了可同时利用碳源和氮源进行生命活动的微生物,这些微生物包括大量的细菌和真菌。表3根据降解草甘膦的生化途径对已发现的微生物进行了归纳。在生物降解过程中,微生物代谢导致草甘膦分解成更小的分子,生物降解效率高于其它方法。影响微生物降解草甘膦的主要有微生物种类、pH、作用温度和草甘膦浓度等因素。目前,利用细菌降解草甘膦的研究比真菌多,用于草甘膦生物降解的C—P裂解酶系统在细菌中广泛存在。从土壤中分离的真菌菌株,如帚霉属(Scopulariopsis sp.)、绿色木霉(Trichoderma viride)、哈茨木霉(T.harzianum)、交链孢霉(Alternaria sp.)和黑曲霉(A. niger),这些真菌菌株通过AMPA途径降解草甘膦。大多数微生物将草甘膦作为磷源进行代谢,少数微生物将其作为碳源、氮源进行代谢。然而在微生物生长代谢过程中,对碳源的需求远高于对氮、磷源的需求。因此,利用草甘膦作为碳源的微生物可以产生更高效的去除过程;磷酸盐影响草甘膦的降解,C—P键的裂解是肌氨酸通路的第一步,但在AMPA途径中,C—P键的裂解是第二步,因此,磷酸盐不影响黄杆菌(Flavobacterium sp.)将草甘膦降解为AMPA,但会影响假单胞菌(Pseudomonas sp. PG2982)降解草甘膦。研究表明,节杆菌菌株不能利用草甘膦作为氮源,是因草甘膦降解过程中释放的过量磷酸盐,抑制了细胞代谢。此外,在缺氧土壤中的草甘膦微生物降解率低于有氧土壤[54]。
5 总结与展望
由于草甘膦是一种极性分子,有磷酸基、氨基和羧基这3个活性基,容易被土壤吸附而不易流失。在草甘膦作为除草剂使用时,它还会通过抑制5-烯醇丙酮莽草酸-3-磷酸合成酶对土壤微生物产生负面影响。长此以往,草甘膦不仅会直接作用于土壤的微生物个体和群体,还会影响到一些微生物和植物的共生作用,进而会影响土壤有机质含量和植物的抗病性。研究还发现,土壤中存在着可通过肌氨酸途径和AMPA途径降解草甘膦的微生物,由于现在的土壤中磷源比较充足,因此可降解草甘膦的帚霉属、绿色木霉、哈茨木霉、交链孢霉和黑曲霉等微生物主要通过AMPA途径降解和转化土壤中残留的草甘膦。目前,降解环境中的草甘膦主要通过物理和化学方法,但二者均有一定的局限性。利用微生物降解和转化草甘膦等除草剂的生物修复法不仅高效,而且还可以和物理化学法联用,但仍存在着草甘膦中间代谢产物的残留问题,今后的研究可在降解草甘膦工艺优化层面展开。这对未来更安全高效地使用草甘膦等除草剂,减少环境污染均有一定的指导意义。

