结直肠癌标本经自然腔道取出术对患者氧化应激及免疫功能影响
邢玉龙,刘刚,吴泽晖,史良会
(皖南医学院第一附属医院胃肠外科,安徽 芜湖 241000)
结直肠癌(colorectal cancer,CRC)是全球高发的消化道恶性肿瘤之一,由于中国经济发展和饮食条件的改善,其发病率较从前增加显著[1]。多数患者早期并未发现异样,确诊时多以中晚期为主,目前仍是以手术为主,术后辅助以放化疗。腹腔镜技术的发展引领了外科的革命,传统腹腔镜手术仍保留腹部约5 mm切口,切口损伤的存在仍会导致患者术后免疫功能的异常,影响机体功能恢复,增加术后切口感染及后期切口疝等并发症的发生率[2],全腹腔镜结直肠癌经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)仅留有腹部戳卡瘢痕,手术标本经肛门或女性阴道取出,避免了切口相关并发症。考虑经阴道取出的二次伤害及性别限制,本研究目的在于比较腹腔镜辅助结直肠癌根治术与全腹腔镜NOSES术(经肛门拖出)对患者体内氧化应激及免疫微环境的影响,为结直肠癌患者治疗方案提供选择依据。
1 资料和方法
1.1 一般资料 选取2018年9月—2020年7月皖南医学院弋矶山医院胃肠三科收治的高位直肠癌和乙状结肠癌且可搜集完整住院资料的患者作为研究对象进行回顾性研究,分为NOSES组(观察组22例)和腹腔镜辅助结直肠切除术(LACR)组(对照组26例)。均行标准手术治疗,NOSES组患者年龄38~83岁,平均年龄(61.11±11.70)岁,男性10例,女性12例,乙状结肠癌9例,直肠癌13例;LACR组年龄35~80岁,平均年龄(61.80±11.50)岁,男性13例,女性13例,乙状结肠癌13例,直肠癌13例。
1.2 纳入条件 ①肠镜下病理确诊为乙状结肠或高位直肠癌;②肿瘤分期≤T3期,肿瘤最大直径<5 cm且环肠周直径≤3 cm;③术前无明显手术禁忌证;④术前均告知患者病情及手术风险,签订手术知情同意书。排除标准:①术前行放、化疗及免疫等相关治疗;②术后复发结直肠癌或合并其他恶性肿瘤患者;③因其他疾病已行手术治疗。治疗方案:均由同一组手术医师完成,遵守其标准化术式进行。
1.2.1 NOSES组 取脐上穿刺建立气腹,放入腹腔镜镜头,五孔法置入Trocar并置入腹腔镜器械,清扫肠系膜下动脉根部淋巴结,向下分离至腹膜折返水平;用强生腔镜切割闭合器于腹膜折返水平离断直肠,扩肛,经肛门碘伏冲洗直肠;远端直肠切开一小口,置入标本保护套,经肛托出,再经肛侧保护套开口将吻合器底钉座送入腹腔;采用反穿刺法置入吻合器底钉座,用线性切割闭合器离断结肠,将标本装入保护套内,经肛取出,重新闭合远端直肠;经肛门置入吻合器出体,从直肠切断线中点穿出中心杠,腔镜引导下与底钉座对接并完成吻合。
1.2.2 LACR组 取脐上穿刺建立气腹,放置腹腔镜镜头,五孔法置入Trocar并置入腹腔镜器械,将乙状结肠向上提起,向下分离至直肠中段水平;用强生腔镜切割闭合器于直肠中段离断直肠;取右下腹经腹直肌切口5 cm,使用切口保护套,选择肿瘤近端5 cm离断降结肠,近端荷包缝合,置入吻合器底钉座,收紧荷包线接扎,放回腹腔;重建气腹,扩肛后,经肛置入吻合器主体,经切缘戳出中心杆,腔镜下于近端底钉座对接后吻合,退出吻合器。
1.3 观察指标及相关检测方式 记录总手术时长,术中总出血量,淋巴结清扫数目,术前1天(D1)及术后第2天(D2)、术后第7天(D3)分别以比色法检测超氧化物歧化酶(SOD)、TBA法检测丙二醛(MDA)及流式细胞学检测T细胞(CD3+、CD4+、CD8+、CD4+/CD8+)和免疫浊度法检测免疫球蛋白(IgA、IgM、IgG)和免疫比浊法检测补体(C3、C4)。

2 结果
2.1 两组患者术前相关资料及手术结果的比较 两组患者性别、年龄、BMI、手术时间、肿瘤位置、肿瘤直径及T分期,术中总出血量、淋巴结清扫数目均无统计学意义(P>0.05),见表1。
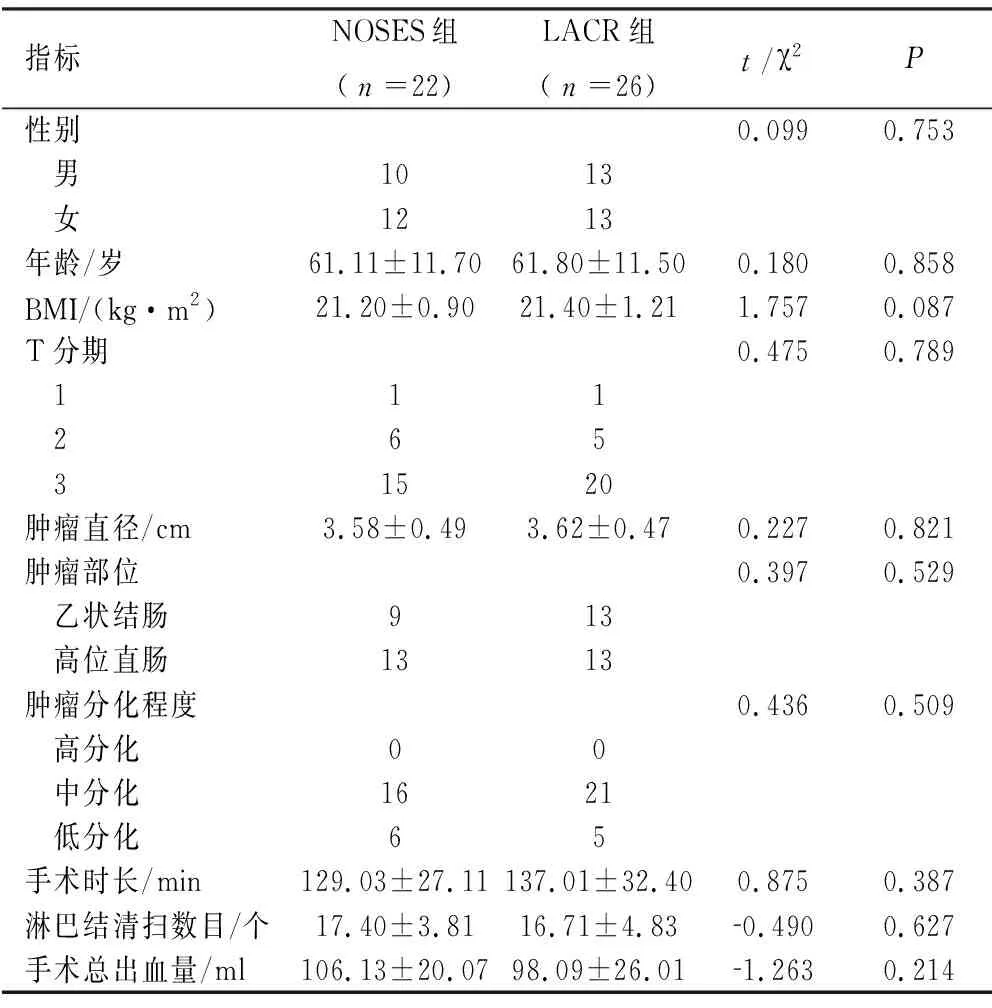
表1 两组患者术前相关资料及手术结果
2.2 细胞免疫学检测(CD3+、CD4+、CD8+、CD4+/CD8+)结果 两组患者组内比较D2时CD3+、CD4+、CD4+/CD8+值均明显低于D1时(P<0.05),D3均升高,仅两组 CD4+/CD8+值升高及LACR组CD3+、CD4+值高于D2时差异有统计学意义(P<0.05)。两组患者组间比较D1时CD3+、CD4+、CD8+、CD4+/CD8+值比较差异无统计学意义(P>0.05),D2时NOSES组CD3+、CD4+、CD4+/CD8+值均较LACR组高(P<0.05),D3时NOSES组仅CD4+/CD8+值仍高于LACR组(P<0.05),见表2。
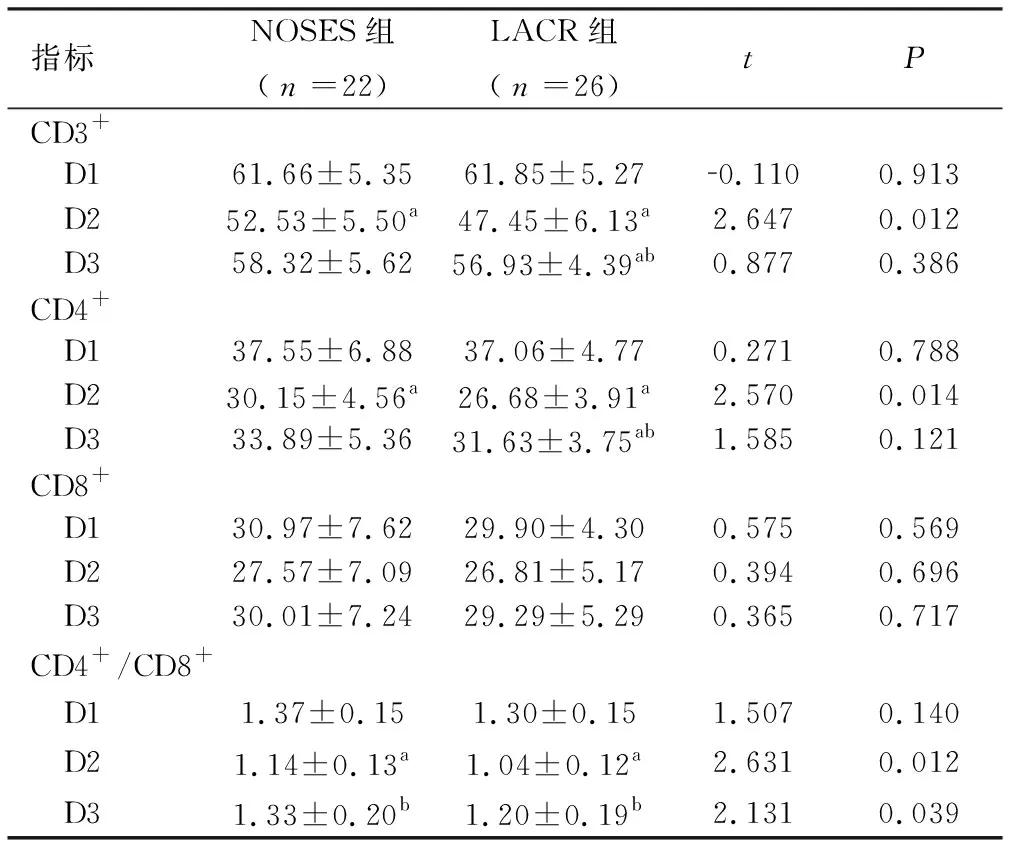
表2 两种不同手术方式对患者T淋巴细胞不同亚群的影响
2.3 体液免疫(IgA、IgM、IgG)及补体系统(C3、C4)检测结果 两组患者组内比较D2时IgM、IgG、C3值均明显低于D1时(P<0.05),D3时三者检测值均高于D2(P<0.05),仅LACR组D2时IgA值低于D1时(P<0.05)。两组患者组间比较D1时免疫球蛋白及补体(IgA、IgM、IgG、C3、C4)差异比较无统计学意义(P>0.05),D2时NOSES组IgM、IgG、IgA值均较LACR组高,D3时NOSES组仅IgG值仍高于LACR组(P<0.05),见表3。
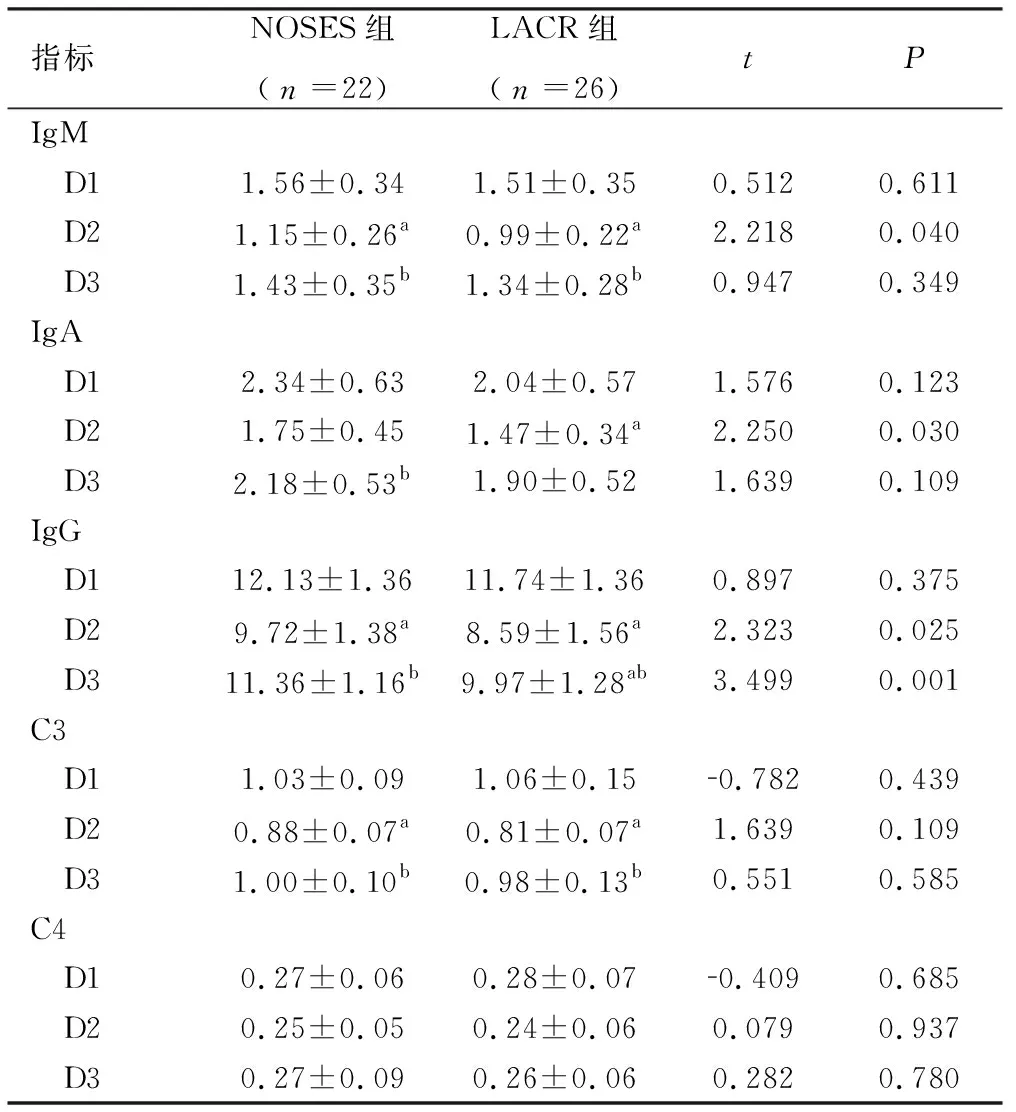
表3 两种不同手术方式对患者体液免疫的影响 单位:g/L
2.4 氧化应激反应(SOD、MDA)检测结果 两组患者组内比较D2时SOD值低于D1时(P<0.05),LACR组中D3时SOD值高于D2时有统计学意义(P<0.05),两组患者D2时MDA均高于D1(P<0.05),D3时MDA值均较D2时低(P<0.05)。两组患者组间比较D1时MDA、SOD值差异比较无统计学意义(P>0.05),D2、D3时NOSES组SOD值较对照组高,MDA值明显低于LACR组(P<0.05),见表4。

表4 两种不同手术方式对患者机体氧化应激的影响
3 讨论
现代微创外科的不断发展,结直肠癌经自然腔道内镜手术摒弃了传统的腹部切口,减少了腹腔对外界的暴露和手术后切口的创伤,Karagul S等[3]研究发现 NOSE 完全腹腔镜根治性手术并发症总发生率明显低于传统腹腔镜手术,但标准化根治术对患者的伤害仍不可避免,应激反应是机体受到外界伤害是内环境的自我调节,当手术创伤超过机体可调节范围,则引起全身各器官的功能障碍,氧化应激是氧化剂与抗氧化防御系统之间的平衡失调,似乎是许多慢性疾病的病理生理中的一个共同因素,氧化应激系统可能参与到结直肠癌的发病机制当中,当体内促氧化剂超过机体微环境抗氧化能力,则会破坏组织细胞的DNA,增加细胞癌变的风险[4-5],有趣的是研究发现其可能降低了肿瘤远处转移的可能性[6],SOD是抗氧化系统的重要物质,MDA是应激后自由基作用于脂质发生氧化反应产生,本研究中术后第2天及第7天SOD均出现不同程度的下降,MDA均上升,但NOSES组患者体内SOD仍高于LACR组,MDA组间比较低于LACR组,提示减少腹部手术切口,明显降低了术后体内氧化应激反应,对患者组织细胞的创伤可能有一定的保护作用。
手术、麻醉时间越长,对机体的免疫功能抑制越大,它们在抵御恶性肿瘤和抑制转移中起着重要作用,免疫抑制在很大程度上增加了早期癌细胞发生免疫逃逸的潜在风险[7-8],且研究发现肿瘤患者由于瘤体生长作用不同程度地抑制机体的免疫能力,本研究发现,两种手术术后第2天患者CD3+、CD4+、CD4+/CD8+水平较水平均明显下降,但NOSES组高于LACR组患者,术后第7天均恢复至术前相当的水平,说明传统腹腔镜直肠癌根治术对患者短期细胞免疫功能的抑制作用更强,张小军[ 9]研究发现传统腹腔镜手术较开腹手术而言,其术后T淋巴细胞水平明显高于开腹组,随访2~3年后发现其生存率也高于开腹手术,说明术后完整的细胞免疫功能与患者预后密切相关。在Ordemann J等[10]研究的腹腔镜辅助和开腹手术中发现,表达CD4+和CD8+的淋巴细胞亚群的数量在腹腔镜手术和常规手术中均无变化,判断手术切口对免疫功能无影响,该研究中腹腔镜组手术平均用时为(210±45) min,开放手术为(149±49) min,可能由于手术医师对腹腔镜器械掌握的熟练程度,增加了手术时长及麻醉药物的使用,可能是导致比较结果的无差异性的最大因素。免疫球蛋白作为体液免疫的主要物质,在术后抗感染方面体现重要的作用[11],本研究发现术后第2天两组患者IgM、IgG均出现下降,NOSES组高于LACR组,且术后第7天LACR组IgG仍处于较低水平,说明减少腹部切口和肠道暴露有利于体液免疫功能的保护。SIgA在肠道黏膜免疫中占有重要地位,LACR组患者术后第2天IgA出现减少,可能与腹部切口及肠道暴露于外界有关,但第7天便迅速恢复,且经短期住院观察未发现两组患者出现重大免疫相关疾病及严重的感染症状,这与抗生素的预防性使用、术中降低创伤和免疫功能保护及加速康复外科理念相结合不无关系。补体系统是辅助机体免疫的调节因子,参与免疫反应,在某些类型的癌症中发现补体可能也参与其发生[12-13],本研究发现行NOSES组患者术后短期C3水平较高,且两组患者术后第7天便恢复至术前水平,C4术前与术后均无明显差异,说明增加腹部切口对补体调节系统影响较小。
综上发现两种手术均会导致术后的应激损伤及免疫功能被抑制。腹腔镜结直肠癌NOSES可较好地减轻患者术后机体微环境中组织的氧化应激损伤,且可以更加完整地保护术后免疫功能,可能对癌症进一步的治疗有前期辅助作用,但肿瘤分期越差,腹腔冲洗液检出肿瘤细胞阳性率越高[14],对于NOSES患者的选择需严格把握适应证。

