卡托普利肾动态显像联合计算机断层血管成像诊断肾血管性高血压的临床应用研究
卫建辉,翟哲民,王玉梅,李敏,尚丽丽,杜柳杨,乔纤,刘玲玲
(1. 河南省三门峡市中心医院高血压科,河南 三门峡 472000;2. 三门峡职业技术学院,河南 三门峡 472000)
肾血管性高血压(renovascular hypertension,RVHT) 是指各种原因引起肾动脉或者其主要分支的狭窄(renal artery stenosis,RAS)或者闭塞,引起肾血流量减少或者缺血从而引起的继发性高血压。RVHT占继发性高血压20%,在高血压人群中发生率约为1%~5%,且RVHT往往为恶性高血压,在恶性或难治性高血压的发生率为10%~40%[1-2]。临床实践中RAS十分常见,但是不是所有的RAS都可引起RVHT,而仅仅当RAS引起了肾脏血流动力学改变时方可导致高血压。目前,数字减影血管造影(digital subtraction angiography,DSA)是诊断RAS的“金标准”,为有创的解剖评估检查且主要用于计划同期进行肾动脉介入治疗[3]。然而RVHT诊断需要解剖和功能方面综合评估,螺旋计算机断层血管成像(computed tomography angiography,CTA)是无创评价RAS的金标准,具有极高的敏感性、特异性和准确性[2],可直接反映动脉血管的解剖特征[3],卡托普利肾动态显像(captopril renal scintigraphy,CRS)检查则是较好评价肾脏血流动力学变化,是诊断RVHT的重要功能性检查,具有较高的敏感性、特异性。本研究的目的是探讨、评价CRS以及其联合CTA诊断RVHT的临床价值。
1 资料与方法
1.1 一般资料 选取2019年1月—2020年12月就诊于三门峡市中心医院高血压科门诊后高度怀疑为RVHT并收住院的高血压患者200例,其中男113例,女87例,平均年龄(51.29±10.35)岁,血压:收缩压(21.17±1.63) kPa,舒张压为(13.59±1.48) kPa,均先行肾动脉CTA,将CTA结果提示RAS≥70%的116例患者进一步行基础肾动态显像(baseline renal scintigraphy,BA-RS)和CRS检查,最后行双侧肾动脉DSA。所有患者均在进行各项检查之前同意、签署知情同意书,并且得到我院医学伦理委员会的批准,本研究符合《赫尔辛基宣言》的基本原则。 纳入标准:患者符合且具备以下两条及以上时即高度怀疑RVHT,需要对其进一步检查评估[4]:①30岁之前或55岁之后发生的高血压,尤其是55岁以上的严重高血压;②既往可控制的高血压突然出现持续性恶化;③顽固性高血压(定义为当联合应用足量包括利尿剂在内的3种降压药物仍难以达到目标血压);④恶性高血压(合并有包括急性肾衰竭、急性失代偿性充血性心力衰竭、新发视神经或其他脑神经病变、Ⅲ或Ⅳ级视网膜病变等急性靶器官损害的高血压);⑤应用血管紧张素转换酶抑制剂类(ACEI)后出现的新发氮质血症或肾功能恶化;⑥无法用其它原因解释的肾脏萎缩或两肾大小相差>1.5 cm;⑦突然出现的难以解释的肺水肿;⑧不能解释的血清肌酐水平升高或需肾脏替代治疗;⑨高血压合并多支冠脉病变或外周血管疾病;⑩不能解释的慢性心力衰竭或难治性心绞痛;○11高血压并有腹部或腰背部血管杂音;○12高血压合并低钾血症。排除标准:排除CTA禁忌证者,排除其它原因的继发性高血压患者(如肾实质性高血压、原发性醛固酮增多症、睡眠呼吸暂停低通气综合征、库欣综合征、嗜铬细胞瘤、垂体瘤或垂体微腺瘤、甲状腺与甲状旁腺功能异常相关的高血压、药源性高血压、主动脉缩窄、真性红细胞增多症以及结缔组织疾病)与原发性高血压。
1.2 研究方法
1.2.1 CTA的设备与方法检查方法 使用GE Lightspeed VCT 64层螺旋CT机(美国通用电气公司)。患者取仰卧位,扫描前30 min服清水500~1000 ml,扫描时屏气,扫描范围包括胸廓入口处至耻骨联合上缘;采取智能跟踪法,监测层面位于T12椎体水平,当监测层面CT阈值达到200 HU时,经高压注射器A管注入碘海醇注射液80~100 ml,以3.5~4.0 ml/s的流速经肘静脉高压注射,对比剂注射完毕后,以相同速率自B管注入0.9%氯化钠注射液。扫描参数:管电压120 kV,管电流选用自动模式,层厚5 mm,螺距1.375∶1,重建间隔1.25 mm,取得容积数据后传至AW4.5(Advantage work station 4.5)影像工作站进行图像后处理。 图像处理由2名主治及以上职称的影像科医师对图像进行重建,依据原始横断面图像结合多种重建技术进行重建分析,应用图像后处理专用软件取得重建的肾动脉血管影像图,选取最优图像用作血管分析;后处理技术包括容积显示(VR)、多平面重组(MPR)、最大密度投影(MIP)、曲面重建(CPR)。如果2名医师意见有差异时,通过高级职称医师讨论后达成一致。
1.2.2 CRS基础的设备与方法 CRS检查包括BA-RS和卡托普利介入后肾动态显像(captopril-enhancedrenalscintigraphy,CE-RS)两部分,分为1日法和2日法。本研究采用“2日法”方案,于第1日行BA-RS检查,次日行CE-RS检查。①检查前的准备:所有纳入患者均正常饮食包括正常含钠量饮食 (每日食盐摄入量3~6 g),停服ACEI/血管紧张素Ⅱ受体拮抗剂类药物(ARB)5个服药周期(3~5 d),停服利尿剂2 d,无需停服其他类降压药物。②检查方法:BA-RS检查当日晨停服所有降压药,正常饮食,饮水500 ml后行BA-RS检查,饮水目的是为了水化;第2日晨停服所有降压药,检测血肾功能,空腹口服卡托普利50 mg(常州制药厂有限公司,国药准字H32023731),若患者的基础血压<15.96/10.64 kPa时用量减至25 mg,服药30 min后进流食,饮水500 ml,服药1 h后进行CE-RS检查。所有入选患者均于服卡托普利片前和服卡托普利片后的15 min、30 min、45 min、60 min以及显像结束后分别测量血压、心率并记录,检查后1~3 d检查血肾功能分析各指标水平。③显像前纳入的患者排空膀胱,检查时患者取仰卧位,探头置于患者腰部,扫描范围包括双肾和膀胱。显像设备采用美国GE Medical SyetemsH3000WD型SPECT仪(制造商:GE Medical Syetems Israel),配备低能通用型平行空准直器,矩阵64×64像素,放大倍数1.0。检查使用的显像剂是99mTc-DTPA[注射用亚锡喷替酸](批准文号:国药准字H10973060),购自北京新科思达医药科技有限公司,放化纯>95%。先测量满针注射器的放射性,然后由1位经验丰富的护士进行显像剂注射,注射方式为经肘静脉“弹丸式”注射显像剂,一次注射剂量为5~10 mCi(185~370 MBq),后即刻开始动态采集。首先行肾血流灌注显像,3秒/帧,共16帧,观察显像剂在腹主动脉、肾血管床充盈的动态过程;然后继续动态采集,60秒/帧,共20帧,观察双肾的大小、形态及显像剂在肾内摄取和清除的动态过程,并计算双侧肾的功能参数。④数据分析:将采集得到的图像进行计算机处理,利用感兴趣区技术(ROI)勾画双肾轮廓及本底,计算机自动生成双肾时间-放射性曲线 (即肾图曲线)并计算得到体表面积标准化的肾小球滤过率(GFR)值、20 min清除率、峰时(timetopeak,Tp)、摄取率(uptakeratio,UR)等参数值。观察指标:①双肾放射性高峰时间;②双肾放射性高峰摄取值之比;③双肾放射性20 min清除率;④双肾大小。
1.2.3 肾动脉DSA方法 对患者进行局部麻醉,采用Seldlinger技术,穿刺股动脉,置入动脉鞘管, 送入猪尾导管至腹主动脉、左右两侧肾动脉分别进行造影,显示狭窄部位、程度,造影术结束后拔出鞘管,压迫股动脉穿测点,加压包扎固定,术后返回病房,注意穿刺点敷料,观察穿刺侧下肢皮温、颜色、腘动脉及足背动脉搏情况,监测血压、心率变化。 双侧肾动脉或者其主要分支血管管径狭窄≥50%作为诊断RAS的标准。
1.3 结果判读标准
1.3.1 CTA检查 对RAS的分级以狭窄血管近端血管直径为正常血管直径标准,若狭窄位于肾动脉起始部,则以狭窄血管远端血管直径为正常血管直径标准。计算狭窄率作为RAS的定量分级,肾动脉狭窄率(%):(1-狭窄管腔直径/正常血管直径)×100%[5]。RAS的程度分级分为3级[6]:0级无狭窄;1级1%<狭窄<50%;2级50%≤狭窄<99%;3级完全闭塞即狭窄100%。
1.3.2 CRS诊断 RVHT的标准依据美国核医学协会制定的诊断指南[7]关于CRS检查的阳性标准,符合以下条件中的任何一条即可诊断为CRS阳性,提示为RVHT[7]:①CE-RS或CRS示高峰延迟且高峰时间>6min;②CRS的相对摄取比较基础肾动态显像的相对摄取比下降(CE-RS比BA-RS的UR值下降)>5%;③基础肾动态显像示一侧肾功能严重受损,表现为肾脏相对摄取比<30%,高峰时间≤2 min,肾脏体积缩小,但CRS提示肾功能未见明显变化;④CRS的肾小球滤过率比基础肾动态显像的肾小球滤过率下降≥10%。
1.3.3 DSA肾动脉狭窄分级 RAS程度分级标准同CTA[6],即RAS的程度分级分为3级:0级,无狭窄;1级,1%<狭窄<50%;2级,50%≤狭窄<99%;3级,完全闭塞即狭100%。由2名主治医师及以上职称、经验丰富的血管外科医师进行阅片。
1.3.4 CTA联合CRS诊断RVHT标准 CTA提示RAS率≥70%且CRS阳性。
1.3.5 RVHT的诊断标准 临床实践中高血压患者在符合高度疑诊RVHT的条件下,DSA检查示肾动脉主干及(或)其分支直径狭窄≥70%时具有较显著的血流动力学改变形成的高血压为RVHT[8]。
1.4 观察指标
1.4.1 主要观察指标 血肌酐、尿素氮、血胱抑素C、肾小球滤过率(eGFR)、24 h尿蛋白定量(MAU)、超声示肾脏形态大小。
1.4.2 终止本试验情况 检查中出现低血压、皮疹、心悸胸闷、出汗,甚至不耐受等情况,视情况可立即终止本试验,必要时吸氧及药物对症支持处理。本研究过程中未发生低血压、心悸胸闷、不耐受等情况。

2 结果
2.1 CTA对RAS的诊断价值 CTA诊断RAS的灵敏度为95.45%(105/110),特异度为87.78%(79/90),阳性预测值为90.52%(105/116),阴性预测值为94.05%(79/84),准确度为92.00%(184/200)。CTA与DSA诊断RAS的一致性较好(Kappa=0.837,P<0.001)。见表1。

表1 CTA对RAS的诊断价值
2.2 CRS对RVHT的诊断价值 CRS诊断RVHT的灵敏度为97.27%(107/110),特异度为92.22%(83/90),阳性预测值为93.86%(107/114),阴性预测值为96.51%(83/86),准确度为95.00%(190/200)。CRS与DSA诊断RAS的一致性较好(Kappa=0.899,P<0.001)。见表2。

表2 CRS对RVHT的诊断价值
2.3 CTA联合CRS对RVHT的诊断价值 采用系列诊断试验,两种诊断方法均为阳性判断该受试者为患者,否则就判断结果为阴性。CTA联合CRS诊断RVHT的灵敏度为93.64%(103/110),特异度为100.00%(90/90),阳性预测值为100.00%(103/103),阴性预测值为92.78%(90/97),准确度为96.50%(193/200)。CTA联合CRS与DSA诊断RAS具有较好的一致性(Kappa=0.930,P<0.001)。与单独CTA诊断RVHT进行比较,CTA联合CRS诊断RVHT的特异度升高(P=0.001),阳性预测值升高(P=0.001)。见表3。
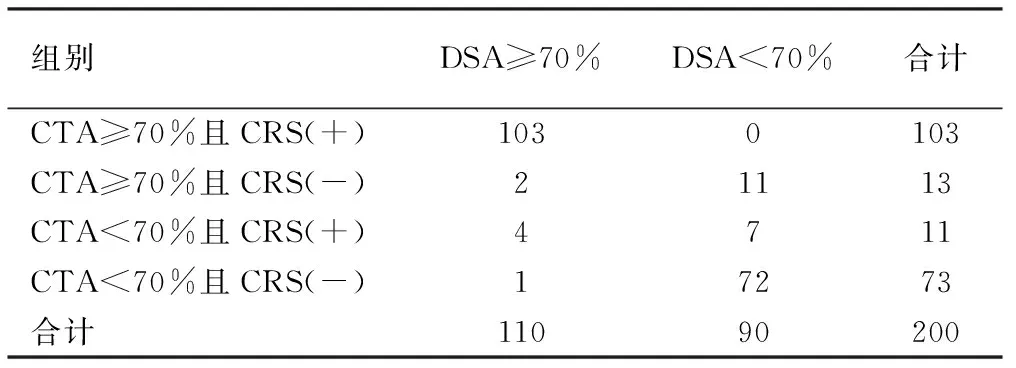
表3 CTA联合CRS对RVHT的诊断价值
3 结论
RAS是指肾动脉主干及(或) 其分支直径减少≥50%,狭窄两端收缩压差≥2.66 kPa或平均压差≥1.33 kPa。一般来说,此程度的狭窄才可引起肾血流量的显著下降,并且影响肾灌注压和肾小球滤过率(glomerular filtration rate,GFR),进而激活病理生理进程,临床上主要表现为RVHT和缺血性肾病。RAS临床主要导致慢性缺血性肾病(chronic ischemic renal disease ,CIRD)和RVHT。RVHT是指继发于RAS的高血压,随着狭窄或缺血的改善,升高的血压可改善和治疗。
临床实践发现,RAS不等同于RVHT,也不是所有的RAS都能引起双侧肾脏的血流动力学改变进而导致RVHT。因此,全面诊断RVHT包括解剖诊断与功能诊断两个方面,后者检查受到较高的重视,包括双功能超声、CTA、MRA以及DSA,而多层螺旋CT能够详细将病变程度清晰展示出来,为后续临床鉴别诊断提供依据[9],尤其是高分辨率的CTA(64排及以上)是无创评价RAS的金标准,可清晰显示肾动脉主干及一、二级分支血管的管腔,动脉管壁钙化、夹层、斑块与出血,肾实质以及肾动脉内支架,并且评估偏心性狭窄,开口起源于腹主动脉前后的病变部位狭窄程度的准确性优于DSA,其具有很高的敏感性、特异性和准确性,CTA的缺点是对比剂可致肾损害与血肌酐>3.0mg/ml而不宜使用,重度心功能不全或者主动脉瓣返流时易致CTA假阳性[3]。DSA是诊断RAS的金标准,但为有创检查且造影剂易致肾损伤,不作为常规筛查手段,仅适用于计划同期行肾动脉介入治疗[3]。RVHT的功能性诊断检查——CRS似乎被忽视,其是通过ACEI来反映RAS所致肾血流动力学改变的情况,对诊断RVHT具有重要作用,对预测RVHT患者能否从再血管化中获益也有重要价值,是一种安全、简便、无创及较高特异性与敏感性的检查方法。刘莉等[10]在卡托普利治疗有效的RVHT患者的研究中首次提出卡托普利可以改善肾动态显像诊断RAS的敏感性,其机制是卡托普利阻断血管紧张素Ⅱ的生成,出球小动脉扩张明显,肾小球内灌注压下降,使得狭窄侧肾脏在服用卡托普利后表现出与其基础肾动态及非狭窄侧肾脏不同的显像变化。此方法不依赖于肾血管解剖结构,可提供双肾和单肾的肾小球滤过率、具有滤过功能的肾脏大小以及慢性肾脏疾病分期等情况,进而对RAS患者的病情进行功能学诊断与评估。目前CRS已经应用于RVHT的诊断与研究。据国外相关研究显示[11],CRS诊断的敏感性为71.00%~92.00%,特异性为72.00%~98.20%,CRS诊断RVHT的敏感性为68.00%~83.00%,特异性是63.00%~98.00%。本研究综合分析了临床高度疑诊的RVHT患者的肾动脉CTA及CRS等数据信息,从解剖形态和功能方面进行评估RVHT。
目前RVHT的诊断标准国内外尚无完全统一的定义,只有肾动脉狭窄到一定程度影响到肾脏血流灌注,继而血压即表现为高血压才发生RVHT,临床上通常采用RAS程度≥70%认为存在RVHT。本研究以RAS程度≥70%为RVHT的诊断标准。本研究结果显示,CTA诊断RVHT与DSA诊断RVHT具有较高的一致性(Kappa=0.837,P<0.001),CTA诊断RAS的灵敏度为95.45%(105/110),特异度为87.78%(79/90),阳性预测值为90.52%(105/116),阴性预测值为94.05%(79/84),此与相关研究结果相一致。研究表明,CTA对RAS、RVHT敏感度和特异度均达95%,CTA诊断与DSA具有较好的一致性,且较清晰地显示肾动脉主干及其分支形态、钙化灶及狭窄程度[12]。研究显示,通过CTA显示RAS程度>50%的肾皮质血流量与对照组相比有明显差别,表明CTA可以作为诊断肾皮质血流减少的诊断依据[13]。CTA作为一种准确性高、清晰度好的非侵入性诊断方法,操作简单、安全,可显示多方位、多角度的血管影像,具有强大的图像后处理功能,可以很好地显示血管硬化斑和血管狭窄程度[14-15]。
功能性检查CRS对RVHT的诊断是不可或缺的一部分。本研究对纳入标准的患者进行规范的CRS检查,研究结果显示,CRS诊断RVHT的灵敏度97.27%(107/110),特异度92.22%(83/90),阳性预测值93.86%(107/114),阴性预测值96.51%(83/86),CRS与DSA诊断RAS的一致性较好,进一步佐证了CRS在诊断RVHT、评估肾脏血流量具有非常重要的作用。这与国内外的文献报道十分相似[16-17]。刘莉等[10]研究结果显示,CRS的敏感性是70.80%,特异性是82.60%,CRS诊断RVHT的敏感性和特异性分别是85.00%、66.70%,也再次提示CRS检查在RVHT筛查、诊断中的重要性。阜外医院的研究显示CRS诊断RVHT的敏感性是93.00%,特异性是95.00%,由此可见,CRS检查对RVHT诊断的重要作用和较高临床价值。尽管经皮肾动脉造影术或DSA是传统诊断肾动脉解剖狭窄的金标准,可直观显示病变的分布、狭窄程度、解剖特征等,对钙化病变、支架再狭窄、肾内分支动脉狭窄等也较好显示,但该检查为有创、放射线剂量较大、对比剂有肾脏毒性,并且在诊断方面与 CTA比较基本上无优势,一般不作为 RAS 的筛查诊断,尤其对患有其他疾病的老年人,仅仅适用于计划同期行肾动脉介入治疗的患者。经分析考量上述检查的特点,本研究选择肾动脉CTA联合CRS从解剖形态和功能学方面诊断RVHT,研究结果进一步显示,与CTA单独诊断比较,CTA联合CRS诊断RVHT的特异度及阳性预测值明显升高,是比较理想的诊断RVHT组合,二者为无创性检查,可操作性高及安全性大,二者联合使用后可显著提升RVHT的准确性。
肾动态显像检查中测量的数值是评估肾实质功能的灵敏指标,其改变提前于外周血胱抑素C、肌酐和尿素氮[18]。临床上常用的肾功能各指标,仅仅是反映总肾功能,不能反映单侧肾功能情况。当出现肾病时,肾动态显像可以从图像、曲线、多方面提示肾脏的受损状况。双肾功能发生不同程度受损时,肾动态显像对肾脏功能的敏感性显著高于肾功能。
文献报道[10],CRS诊断RVHT的最重要因素是RAS的程度。CRS诊断RVHT的敏感性随RAS程度的增加而升高,即当RAS狭窄程度为60%~90%时,RVHT可表现为特征性改变,但对于>90%及<60%的病变,其诊断敏感性下降。刘莉等[10]研究结果表明,CRS诊断RVHT的敏感性与特异性会随着肾动脉狭窄程度的加重而增高,如果肾动脉狭窄程度≥90%时,其敏感性趋近或者达到100%。然而,CRS检查同其他检查一样也存在假阳性结果,其原因:血压较低、膀胱充盈、血容量不足、先天肾脏发育不良、肾囊肿、部分长期服用钙通道阻滞剂类(如氨氯地平片)降压药物的患者出现双侧一致的假阳性变化,而假阴性的原因有:①患者肾素-血管紧张素系统(RAAS)活性比较高,服用的卡托普利片剂量不足,即使是口服50 mg卡托普利也不能拮抗其活性,进而不能产生有意义的肾动态显像变化;②血相对容量负荷过大;③一侧或者双侧肾动脉严重狭窄或者闭塞而致该肾功能较差;④肾动脉分支狭窄。CRS检查阳性提示肾动脉狭窄已经引起血流动力学改变,进而引起高血压即RVHT。只有在RAS导致肾素一血管紧张素一醛固酮系统发生变化时,CRS才有可能出现阳性结果。有研究结果表明,RVHT的筛查、诊断过程中,解剖诊断与功能诊断检查联合应用可明显提高RVHT的诊断,且具有较高的敏感度、特异度和阳性预测值[19-20]。因此,在临床实践中,不能单凭卡托普利肾动态显像阴性就排除RAS,CRS检查是具有较高敏感性的无创性检查方法,可验证RAS有无功能,对指导进一步治疗具有重要意义。
如果患者RAS<50%,通常不会导致血压明显升高和肾功能损害,宜行内科药物保守治疗,RAS程度在65%~80%时,可引起较明显的血流动力学改变,最终导致高血压即RVHT和双肾功能下降,此时需要手术治疗。有资料提示[4]患者RAS程度≥50%,临床出现高血压和肾功能损害是药物治疗的重要指征。Simon P等[21]证实RAS≥60%的患者肾脏分泌的肾素明显增加,表现为高肾素性高血压,且伴有肾功能损害。
综上所述,CTA与CRS均是临床诊断RVHT的重要方法,具有无创、易操作、安全、便捷、敏感性与特异性均较高等特点,二者的联合可显著提高RVHT诊断的准确性,为制定或优化个体化治疗方案提供精确的实践依据。由于本研究的样本量较小,仍需进行大样本的前瞻性研究进一步明确。
(致谢三门峡市中心医院CT室李展医生、核医学科赵杰医生给予的专业技术支持)

