血清P-LAP与妊娠期糖尿病的相关性
徐跃心,吕文豪,南 洋,刘晓敏,俎晓霞,续星强,宋雯霞*
(1.长治医学院,山西 046000;2.长治市妇幼保健院,山西 046000;3.山西医科大学附属长治市人民医院, 山西 046000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠前糖代谢正常,妊娠期才出现糖尿病的患者[1],多发生于妊娠中晚期,以糖代谢异常、胰岛素抵抗(insulin resistance,IR)为主要特点,大部分孕妇可通过饮食+运动疗法控制症状,少数孕妇需加用胰岛素来控制血糖。GDM孕妇患巨大胎儿、胎儿生长受限、胎儿窘迫及新生儿低血糖等疾病的风险增高,且新生儿成年后发生肥胖和IR的风险将大大增加,同时GDM孕妇未来罹患2型糖尿病(T2DM)、代谢综合征、动脉粥样硬化等疾病的风险增加[2-4]。研究发现,胎盘分泌的胎盘亮氨酸氨基肽酶(placental leucine aminopeptidase,P-LAP)与胰岛素信号转导通路之间存在着重要的联系,而胰岛素信号转导通路障碍是发生IR的重要因素[5-6]。为明确P-LAP在GDM发生、发展中的作用,本研究通过检测正常妊娠期妇女、GDM妇女血清中空腹血糖、胰岛素及P-LAP水平,旨在探讨P-LAP与GDM的相关性。
1 资料与方法
1.1 研究对象 选取2019年9月至2020年7月于山西省长治市人民医院行系统产检并分娩的糖耐量正常孕妇40例(对照组)和GDM孕妇45例(GDM组)。诊断标准:孕24~28周行75g OGTT试验阳性者(即空腹血糖≥5.1mmol/L,1h血糖≥10.0mmol/L,2h血糖≥8.5mmol/L),按WHO标准诊断阳性者即为GDM,并选择其中经饮食+运动疗法使血糖控制良好者入组。孕妇的年龄、孕产次、体重、身高、体质量指数(body mass index,BMI)等一般资料比较,差异均无统计学意义(P>0.05),见表1。标本采集均经医院伦理委员会批准,患者知情同意并签署知情同意书。
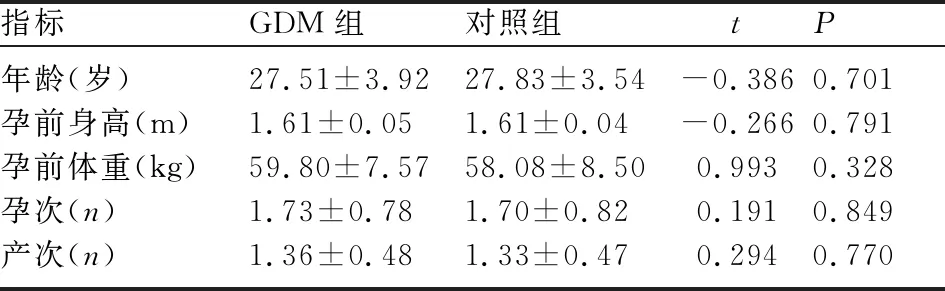
表1 两组孕妇的一般资料比较
1.2 纳入标准 (1)年龄21~40岁,分娩孕周37~41+6周。(2)孕24~28周确诊的GDM患者,无肝、肾、胆囊、胰腺、甲状腺、心、肺疾患,无孕前糖尿病、高血压、糖代谢异常、脂代谢异常、肥胖等内外科合并症,无糖尿病家族史、GDM病史者。(3)自然受孕、单胎妊娠、月经周期规律、末次月经明确。(4)胎儿一般状况良好,无前置胎盘,无宫内发育迟缓,无先天性心脏病等。
1.3 标本的采集与处理
1.3.1 标本的采集 采集孕妇分娩前肘静脉血5mL,分别置EDTA抗凝管混匀,存于4℃冰箱,2h内离心(3000r/min,10min),将血浆分离置EP管,-80℃冰箱保存。胎盘娩出后,立即断脐,检查胎盘大体并剪除全部胎膜及脐带(残留部分不超过2cm),待自然流血停止,用纱布拭去所附血凝块,对胎盘进行称重并记录。
1.3.2 标本的测定 血糖测定采用葡萄糖已糖激酶法,胰岛素测定采用电化学发光法,P-LAP测定采用ELISA法。ELISA检测试剂:人胎盘亮氨酸氨肽酶(P-LAP)ELISA试剂盒(上海沪鼎生物科技有限公司,上海)。应用全自动酶免分析仪器(Bio-Rad Evolis全自动酶免分析仪)检测,检测过程中所有操作严格按设备说明书进行。
1.3.3 计算指标 胰岛素抵抗指数( HOMA-IR)=空腹血糖×空腹胰岛素/22.5,反映组织对胰岛素的敏感性。胎盘系数=胎盘质量/新生儿体质量,正常值为0.167。胰岛β细胞分泌功能指数(HOMA-β)=20×空腹胰岛素/(空腹血糖-3.5),反映胰腺胰岛素分泌能力。BMI=体重/身高2(kg/m2) 。

2 结 果
2.1 GDM与对照组的胰岛素 、血糖水平以及新生儿体质量、胎盘重量比较 GDM组的胰岛素、血糖水平高于对照组,差异有统计学意义(P<0.05);两组的新生儿体质量及胎盘重量比较,差异无统计学意义(P>0.05),见表2。
2.2 GDM与对照组的P-LAP、HOMA-IR、胎盘系数、HOMA-β及BMI比较 GDM组的HOMA-IR、胎盘系数高于对照组,P-LAP水平低于对照组,差异有统计学意义(P<0.05)。两组的HOMA-β、BMI比较,差异无统计学意义(P>0.05),见表3。
2.3 P-LAP水平与胰岛素、血糖、新生儿体质量、胎盘重量、HOMA-IR、胎盘系数、HOMA-β及BMI的相关性分析 两组孕妇的P-LAP水平与胰岛素、血糖及HOMA-IR水平存在负相关(P<0.05),而与新生儿体质量、胎盘重量、胎盘系数、 HOMA-β及 BMI无明显相关性,见表4。

表2 两组的胰岛素、血糖、新生儿体质量及胎盘重量水平比较

表3 两组P-LAP、HOMA-IR、胎盘系数、HOMA-β及BMI水平比较
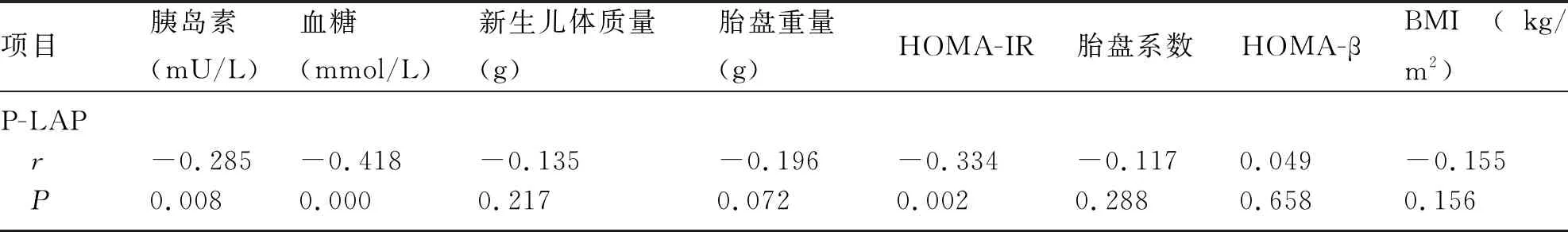
表4 P-LAP水平与胰岛素、血糖、新生儿体质量及胎盘重量的相关性
3 讨 论
IR是指外周组织及靶器官对胰岛素敏感性和反应性降低的一种代谢病理机制,妊娠妇女普遍存在IR,以满足胎儿生长的需求、机体代谢需要以及母体中枢神经系统对血糖水平的依赖。当IR不断加重,机体无法代偿,便发生了GDM。血糖升高是GDM的主要临床表现,IR则是GDM的主要病理生理基础。研究发现[5],胰岛素的后信号转导通路是IR的重要分子机制,其中葡萄糖转运异构体4(glucose transporter isoform 4,GLUT4)的基因转录调节及易位对于胰岛素信号转导通路的调节尤为重要。大量实验发现[6-8],P-LAP作为锌依赖性膜氨基肽酶家族的成员,与CLUT4共同存在于脂肪细胞及骨骼肌细胞的GLUT4特异性囊泡(GLUT4-specialized vesicles,GSV)的囊腔中,它们在细胞内室与质膜的相对分布相同,因此推测为了维持脂肪细胞及骨骼肌细胞中正常的GLUT4水平,需要P-LAP的存在。妊娠妇女体内存在两种活性的亮氨酸氨肽酶(leucine aminopeptidase,LAP),因其是一种蛋白水解酶,具有强大的肽链外切酶功能,在细胞的保护、疾病的防御、生理功能的调控等方面都扮演着不可或缺的角色。Laustsen等[9-10]研究发现,对非妊娠妇女血清中的LAP进行电泳分析后,只呈现1条活动带,且置于60°环境下30min仍呈稳定状态,亦对L-蛋氨酸的抑制作用敏感,而妊娠妇女血清的LAP出现了3条活动带,置于60°环境下呈不稳定状态,并且不受L-蛋氨酸的抑制而被选择性染色。由于这3条带均显示了胱氨酸氨基肽酶的活性,代表了一种酶的3种不同构象形式。因此为了区别,将妊娠期分泌的、不被L-蛋氨酸抑制的LAP统称为P-LAP。妊娠期的P-LAP主要存在于胎盘的合体滋养细胞中,其水平随着妊娠期胎盘的增大不断增加,并在分娩后快速下降至非妊娠水平。P-LAP是至今为止发现的体内唯一能降解催产素的酶,因此也称其为缩宫素酶(oxytocinase,OTase)[1,11]。
胎盘作为胎儿的附属器官,其分泌的雌激素、孕激素、人胎盘生乳素、缩宫素酶、细胞因子及生长因子等都对维持正常妊娠起着重要作用[1,12]。本研究结果显示,GDM组的血清P-LAP水平低于对照组,胰岛素及血糖水平均高于对照组(P<0.05)。这提示胎盘分泌的P-LAP可能与GDM发生有关。结合P-LAP对GLUT4的影响,推测血清中P-LAP水平降低能使血清中GLUT4的表达发生改变,进而影响胰岛素信号转导通路,加重IR,诱发GDM。本研究发现,GDM组的HOMA-IR、胎盘系数均高于对照组,差异均有统计学意义(P<0.05);两组的HOMA-β比较,差异无统计学意义(P>0.05)。HOMA-IR指数升高提示IR加重,胎盘系数增高常伴有围产儿死亡及新生儿患病率的增加。HOMA-β指数升高提示胰岛β细胞分泌的胰岛素增加,然其功能变化不明显。本研究结果显示,两组孕妇的P-LAP水平与胰岛素(mU/L)、血糖(mmol/L)及HOMA-IR水平存在负相关(P<0.05);而与胎盘系数及HOMA-β无明显相关性。表明胎盘分泌的P-LAP水平与GDM孕妇的IR有关,在GDM的发生、发展中发挥着关键作用。
近年来,随着对P-LAP研究的不断深入[13-17],发现其在脂肪和肌肉细胞中与GLUT4共同参与血糖及胰岛素的调节,参与妊娠期加压酶活性调节,与妊娠期尿崩症、子痫前期及早产等有关。P-LAP在胎盘滋养细胞中的分泌与表达增强了囊泡上GLUT4的表达,导致细胞对葡萄糖的摄取增加,同时增强了细胞对胰岛素的易感性。因此,推测妊娠妇女体内P-LAP水平降低是诱发GDM的关键因素,P-LAP水平可否作为评定GDM患者病情进展的指标有待进一步研究。
综上所述,孕妇体内P-LAP水平降低,加重了IR,进而促进了GDM的发生。目前发现的P-LAP在GLUT4发挥作用的信号途径的作用机制尚未完全明确,如P-LAP如何与GLUT-4发生联系,在GLUT-4易位的具体机制和影响因素等,提高孕妇体内P-LAP水平可否预防或减缓GDM的发生,进而减少孕产妇的不良妊娠结局的发生,这些都为我们下一步的研究提供了方向。

