食欲素A促进短暂性全脑缺血大鼠的海马CA1区谷氨酸摄取并抑制迟发性神经元死亡
周 鸿,邓 健,杨 锋,余 杰,胡林旺*
(湖南省人民医院 1.神经外二科,2.药学二部,湖南 长沙 410002)
突触间隙内谷氨酸的过量蓄积导致的兴奋性毒性是缺血性脑损伤(ischemic brain injury,IBI)的重要机制之一,并且是神经二次损伤和病后转归主要的不良因素[1]。胶质细胞谷氨酸转运体-1(glial glutamate transporter 1,GLT-1)承担了约90%的中枢神经系统的谷氨酸转运,且80%以上的GLT-1表达于海马[2]。海马CA1区对缺氧缺血最为敏感,且海马CA1区锥体层神经元损伤会导致认知、学习和记忆功能障碍,直接导致IBI患者的不良预后[3]。因此,研究海马CA1区GLT-1的表达与功能对研究IBI后的兴奋性谷氨酸毒性反应至关重要。
在IBI患者脑脊液中食欲素A(orexin-A,OX-A)含量降低,且OX-A低含量与IBI严重程度呈正相关[4]。侧脑室注射OX-A能降低脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型大鼠的脑梗死体积[5]。以上现象提示:OX-A可能具有抗IBI的效应。而OX-A对短暂性全脑缺血(transient global cerebral ischemia,tGCI)中GLT-1的表达、转运活性以及对谷氨酸摄取能力仍不清楚,因此本研究观察侧脑室注射OX-A对tGCI大鼠海马CA1区GLT-1表达与功能的影响,并分析其机制。
1 材料与方法
1.1 实验动物与试剂
30只7周龄SPF级雄性SD大鼠[长沙市天勤生物技术有限公司,SCXK(湘)2019-0014];OX-A试剂和LY294002[phosphotidylinsitol-3-kinase(PI3K)抑制剂]试剂(MedChemExpress公司);谷氨酸定量试剂盒和硫堇溶液(北京索莱宝生物科技有限公司);Fluro-Jade C(FJ-C)染色试剂盒(Chemicon公司);膜蛋白提取试剂盒(上海生工生物工程有限公司);[3H]-glutamate试剂(PerkinElmer公司);DHK试剂(Sigma-Aldrich公司);NeuN、GLP-1、PI3K、p-PI3K、AKT和p-AKT抗体(Cell Signaling Technology公司);BCA蛋白定量试剂盒、ECL化学发光试剂盒、GAPDH抗体和HRP标记二抗(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 大鼠的分组及处理:将大鼠随机分为假手术(sham)组(n=6)和tGCI造模组(n=24)。采用改良四血管闭塞法对大鼠进行tGCI造模,缺血10 min后,恢复血液灌流[6]。将18只造模成功的大鼠随机分为模型(model)组、OX-A组(造模后1 d,侧脑室注射给药30 μg/kg OX-A)和OX-A+LY294002组(100 μg/kg LY294002)3个亚组,每个亚组纳入6只大鼠。侧脑室微量注射仪进针位置为前卤后0.8 mm,向右1.5 mm,深度3.8 mm,注射速度为1 μL/min,注射后留针8 min。注射后2 d进行后续实验。
1.2.2 脑海马CA1区组织样本收集:麻醉大鼠后,断头取脑,分离脑组织留存,然后通过解剖显微镜分离出海马CA1区组织。
1.2.3 Western blot检测GLP-1、p-PI3K和p-AKT蛋白表达:用RIPA试剂分离各组海马CA1区组织的总蛋白,用常规Western blot孵育GLP-1、PI3K、p-PI3K、AKT、p-AKT和GAPDH抗体。并在曝光显影后,用Image J软件定量各样本目的条带的吸光度值。
1.2.4 [3H]-glutamate放射性配基-受体结合实验检测海马CA1区GLT-1的结合能力和对谷氨酸的摄取能力:用膜蛋白提取试剂盒分离各组海马CA1区组织的膜蛋白,并用BCA法对膜蛋白定量后,分别取50 μg膜蛋白、[3H]-glutamate试剂和DHK试剂用于制作总结合管和非特异性管,并在37 ℃下孵育各管30 min后,将一部分反应液用GF/C玻璃纤维滤膜抽滤并用Hepes缓冲液冲洗滤膜2次;将另一部分反应液加入NaOH溶液(0.3 mol/L)中并室温反应20 min后,将所得混合溶液滴入GF/C玻璃纤维滤膜中。将上述所有滤膜烘干后,加入2 mL闪烁液并避光孵育过夜,用液体闪烁仪测定放射强度,然后根据scatchard反应曲线计算GLT-1的最大结合量(maximum binding capacity,Bmax)、解离常数(dissociation constant,Kd)和谷氨酸摄取量。
1.2.5 海马CA1区神经组织中谷氨酸含量的测定:按谷氨酸定量试剂盒步骤,各组分别取0.1 g海马CA1区组织,用组织裂解液在冰上匀浆,收集匀浆液,并用BCA法进行膜蛋白定量;将匀浆液和反应液混合后,用紫外分光光度计分别记录波长340 nm处反应20 s和5 min 20 s时的吸光度值A1和A2,计算A2-A1值,并根据标准曲线计算谷氨酸含量(mmol/L),最后根据蛋白含量换算单位mg蛋白中谷氨酸含量。
1.2.6 尼氏(Nissol)染色检测尼氏体:取各组脑组织,用石蜡包埋,并切为5 μm厚脑片。脑片经脱蜡和再水化后,用0.1%硫堇溶液常温染色30 min,然后用显微镜观察并拍照,并在200×镜下计数海马CA1区每1 mm×1 mm区域内尼氏体数量。
1.2.7 FJ-C(Fluro-Jade C)染色检测退化神经元:取各组脱蜡至水后的脑片(30 μm厚),依次经1% NaOH/80%乙醇溶液和0.06%高锰酸钾溶液浸泡后,用0.01% FJ-C溶液室温避光孵育45 min,然后用荧光显微镜观察并拍照,并在200×镜下计数海马CA1区每1 mm×1 mm区域内FJ-C阳性染色细胞数量。
1.2.8 NeuN免疫组化染色检测神经元:取各组脱蜡至水后的脑片(5 μm厚),用常规免疫组化法孵育NeuN抗体,并在DAB显色后,用显微镜观察并拍照,并在200×镜下计数海马CA1区每1 mm×1 mm区域内NeuN阳性染色细胞数量。
1.3 统计学分析
2 结果
2.1 海马CA1区PI3K/AKT信号活性的变化
与假手术组比较,模型组海马CA1区PI3K/AKT信号活性明显降低(P<0.05);与模型组比较,OX-A能完全逆转tGCI造成的海马CA1区PI3K/AKT信号活性灭活(P<0.05);而相对OX-A组,PI3K/AKT信号抑制剂LY294002能抑制OX-A对PI3K/AKT信号增强效应(P<0.05)(图1)。

A,B.expressions of p-PI3K; C, D. the expressions of p-AKT; *P<0.05 compared with sham group; #P<0.05 compared with model group; △P<0.05 compared with OX-A group图1 海马CA1区PI3K/AKT信号活性的变化Fig 1 Changes of PI3K/AKT signal activity in hippocampal CA1 n=6)
2.2 海马CA1区GLP-1表达与功能的变化
与假手术组比较,模型组海马CA1区GLT-1表达、Bmax值和谷氨酸浓度明显增加(P<0.05),Kd值和谷氨酸摄取量明显降低(P<0.05);与模型组比较,OX-A能完全或部分逆转tGCI造成的海马CA1区的上述指标变化(P<0.05);而相对OX-A组,LY294002能抑制OX-A对tGCI的效应(P<0.05)(图2,表1)。
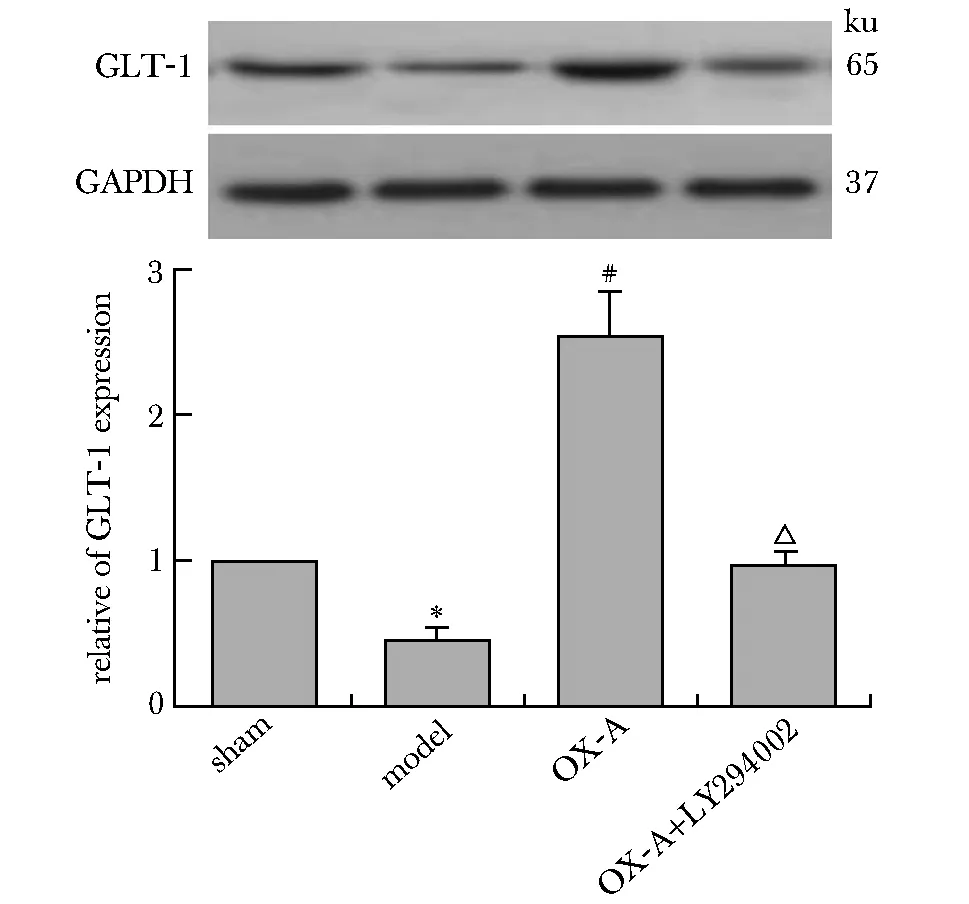
*P<0.05 compared with sham group; #P<0.05 compared with model group; △P<0.05 compared with OX-A group图2 海马CA1区GLP-1蛋白表达的变化Fig 2 Changes of GLP-1 protein expression in hippo
表1 海马CA1区GLP-1功能的变化Table 1 Changes of GLP-1 function in hippocampal CA1 n=6)
2.3 海马CA1区神经元的病理学改变
与假手术组比较,模型组海马CA1区尼氏体和NeuN阳性神经元数量明显降低(P<0.05),FJ-C阳性神经元数量明显增加(P<0.05);与模型组比较,OX-A能增加海马CA1区尼氏体和NeuN阳性神经元数量并降低FJ-C阳性神经元数量(P<0.05);而相对OX-A组,LY294002能抑制OX-A对tGCI的效应(P<0.05)(图3,表2)。
表2 海马CA1区尼氏体、NeuN阳性细胞和FJ-C阳性细胞的密度Table 2 Density of Nissl body, NeuN positive cell and FJ-C positive cell in hippocampal CA1

图3 海马CA1区神经元的病理学改变Fig 3 Pathological changes of hippocampal CA1 neurons (scale bar=50 μm)
3 讨论
IBI是造成全球人类的第一大致残和第三大致死的重要病因[7],但目前IBI的治疗效果并不太理想[8]。因此,寻找更多有效的IBI治疗策略颇为紧迫。
OX-A具有减轻IBI的作用[5,9],但具体机制尚不完全清楚。兴奋性谷氨酸的神经毒性是IBI的重要机制之一[1]。IBI后,海马CA1区细胞外谷氨酸的清除主要依赖GLT-1将细胞外谷氨酸摄取到胶质细胞内[2]。在大鼠tGCI模型中,在海马CA1锥体层发生迟发性神经元死亡(delayed neuronal death,DND)之前,就观测到CA1星形胶质细胞GLT-1的表达和谷氨酸转运蛋白电流的最大幅度的降低[10],本研究同样观测到在tGCI大鼠海马CA1区GLT-1表达降低和DND。在缺氧环境下,OX-A能通过增加GLT-1的表达促进体外胶质细胞对谷氨酸的摄取能力[11],这可能是OX-A抗IBI的机制之一。而OX-A对大鼠tGCI模型中海马CA1区GLT-1表达和功能的影响尚不清楚,本研究结果显示,OX-A能增加海马CA1区GLT-1的表达和最大结合量,并促进GLT-1对谷氨酸的亲和力和摄取能力,减少了兴奋性谷氨酸在细胞外水平,最终减少了DND。
在糖氧剥夺条件下,星形胶质细胞的PI3K/AKT信号活性降低;而增强PI3K/Akt信号活性可上调星形胶质细胞的GLT-1的表达并增强其摄取细胞外谷氨酸的能力[12],这一结果提示GLT-1的表达受到PI3K/AKT信号活性调节。OX-A降低MCAO大鼠的脑梗死体积的作用与其激活PI3K/AKT信号活性相关[5]。本研究结果显示,大鼠tGCI后海马CA1区PI3K/AKT活性降低和GLP-1表达、结合与摄取功能下降相一致;给予OX-A治疗后PI3K/AKT活性增强和GLP-1表达、结合与摄取功能增高相一致,这一结果说明,在大鼠tGCI模型中,OX-A对GLP-1表达与功能的促进作用与其上调PI3K/AKT活性相关。此外,本研究还通过侧脑室注射PI3K/AKT抑制剂LY294002的方法进一步证实了OX-A通过上调PI3K/AKT活性来发挥促进GLP-1表达、结合与摄取谷氨酸功能以及减轻DND的作用。
综上所述,外源性OX-A可通过上调PI3K/AKT信号活性来增加tGCI大鼠海马CA1区GLT-1表达、增强与GLP-1结合和摄取谷氨酸的功能并减轻兴奋性谷氨酸导致的DND。

