三亚河红树林土壤纤维素降解菌的分离
曾德华,吴志祥,赵怀宝,刘 俊,寇旭阳,张 源
(1.三亚市林业科学研究院,海南 三亚572022;2.海南热带海洋学院a.热带海洋生物资源利用与保护教育部重点实验室;b.生态环境学院,海南 三亚 572000)
0 引言
红树林是热带、亚热带海湾、河口泥滩上特有的常绿灌木和小乔木群落;它生长于陆地与海洋交界带的滩涂浅滩,是陆地向海洋过渡的特殊生态系统。红树林不单是部分海洋生物的栖息地,还具有防浪护堤、纳污及净化等生态功能,具有较高的工业、药用及旅游开发价值。红树林生态系统具有高生产力,高归还率和高分解率的“三高”特点,其中的微生物发挥着重要作用。红树林底质中存在的微生物资源,不仅具有陆源微生物的基本特征,而且通常具有降解或转化有机污染物的巨大潜力,在物质循环中发挥着重要作用[1]249,[2]562。
近年来,红树林生态环境中的微生物资源引起了科学家的高度关注,对来自世界各地区红树林环境的微生物进行了研究。Sengupta和Chaudhuri[2]562从不同红树林沉积物和根系中分离得到Azospirillum、Azotobacter、Rhizobium、Clostridium和Klebsiella等固氮菌。Holguin等[3]257研究了红树林生态系统中参与营养转运的微生物,发现固氮菌、溶磷菌和真菌较多。印度学者Ananda等[4]872研究了西海岸红树根际内生真菌的多样性。Jalal等[5]640从马来西亚红树林沉积物中分离到多种细菌,如Chromobacteriumviolaceum、Pseudomonasaeruginosa、Serratiarubudaea、Klebsiellapnuemoniae等。Baskaran等[6]28从印度安达曼红树林沉积物中分离到42株放线菌,其中大部分为链霉菌属。杨晓洪等[7]99,[8]118在八门湾红树林分离到23个细菌类群、22个古菌类群、15个真菌类群,12个放线菌类群。高兆明[9]36研究发现红树林地区绝大多数真菌都能产生木质纤维素酶。戴旭青[10]36研究发现78株具有降解纤维素能力的菌株,大部分为真菌,放线菌次之,细菌最少。谢为天等[11]157在红树林中筛选出一株名为解淀粉芽孢杆菌的菌株,具有产淀粉酶及蛋白酶的能力,其酶具有较强的稳定性。赵艳娟[12]107采用18种放线菌培养基在北海红树林根际土壤中分离出42株放线菌,其中一株链霉菌属菌株有淀粉酶活性、无纤维素酶活性。姚琦等[13]859研究发现,土壤微生物群落多样性随着月份变化有着显著的变化,突出表现在12月份土壤微生物群落有较强的活性,但2月份土壤微生物具有物种多且分布均匀的特征。麦国琴等[14]180从深圳福田红树林土壤中分离了80株真菌,经过产酶发酵复筛,获得2株同时具有较高木聚糖酶和纤维素酶活的真菌。其中一菌株木聚糖酶和纤维素酶的酶活分别为39.01 IU 和 0.87 IU。冯玲玲等[15]1357在研究海南三亚红树林底泥中放线菌多样性和抗菌活性,共分离到149株放线菌,隶属6个目12个科16个属,其中小单抱菌属为优势属;其中20株放线菌具有抗菌活性,82株放线菌含有生物合成基因,表明海南三亚红树林含有丰富的药用放线菌资源,具有从中发现新颖活性物质的潜力。马军等[16]999从红树林根际土壤中筛选出一株产纤维素酶的革兰氏阳性菌,经分析鉴定为枯草芽孢杆菌(Bacillussubtilis)。曾思泉等[17]39利用水解圈法从三亚红沙河红树林区分离得到1株纤维素降解真菌 SCSIO 43503。经过分子生物学鉴定并综合形态学特征,推测其为枝孢属(Gladaxporism) 真菌。
三亚河红树林物种丰富、古老,得天独厚的条件也孕育了丰富的微生物资源。随着城市快速发展,特别是排污等影响,其生境也不同程度受到了影响。研究和开发红树林沉积物中的微生物,不仅有助于理解生态学过程,而且可应用于红树林生态系统的监测、管理及恢复。从三亚河红树林底质中筛选出具有降解纤维素能力的菌株,进行分离、纯化,对其形态学特征和生理生化实验做初步鉴定,进行酶的活性研究,为后续开发利用做准备。
1 研究方法与材料
1.1 采样地点设置
三亚河红树林自然保护区位于18°19′~18°37′N,108° 36′~109°46′E。在三亚河沿岸红树林中根据不同群落、不同的河道区段,选取7个样地进行采样。
1.2 取样
在每一样地,采用五点法对每一个样品进行取样。在每个点取0~5 cm,5~10 cm,10~15 cm,15~20 cm,25~30 cm的土壤若干,将各个点的同一深度土样混合,并做标记,待用。
1.3 试验方法
1.3.1 培养基
(1) 羧甲基纤维素钠平板分离培养基
羧甲基纤维素钠10.0 g 、蛋白胨10.0 g 、酵母膏5.0 g 、KH2PO41.0 g、MgSO4·7H2O 0.2 g、NaCl 10.0 g、琼脂20.0 g、水1 000 mL,121 ℃ 灭菌20 min 。
(2) 刚果红纤维素琼脂培养基
KH2PO40.5 g 、(NH4)2SO42 g、 纤维素粉 1.88 g 、MgSO4·7H2O 0.25 g 、刚果红 0.2 g 、琼脂 18 g、水1 000 mL,121 ℃ 灭菌20 min 。
(3) 羧甲基纤维素钠液体培养基
羧甲基纤维素钠10.0 g、蛋白胨 10.0 g 、酵母粉5.0 g 、KH2PO41.0 g 、MgSO4·7H2O 0.2 g 、NaCl 10.0 g、水1 000 mL,121 ℃ 灭菌20 min[18]146。
(4) 蛋白胨液体培养基
蛋白胨10.0 g、NaCl 5.0 g、水1 000 mL、pH值为7.2~7.4 ,121 ℃ 灭菌20 min 。
(5) 葡萄糖蛋白胨液体培养基
葡萄糖 5.0 g、蛋白胨5.0 g、NaCl 5.0 g、水1 000 mL、pH值为7.2 ~ 7.4,121 ℃ 灭菌20 min[19]151。
1.3.2 样品预处理
去除植物残体等杂物,准确称取10.0 g土样,加入至装有 90 mL无菌水的250 mL锥形瓶中,用玻璃棒搅拌均匀。放入30 ℃、200 r·min-1条件下的振荡培养箱中40 min,静置2 h,取上清液便得10-1稀释菌液。取1 mL菌液,加入装有9 mL无菌水的试管中,反复吹打5次使菌液混合均匀,便得10-2菌液。按照上述方法,得到浓度为10-1、10-2、10-3、10-4四个梯度的菌液。
1.3.3菌株的初筛、复筛及菌株的分离
取10-2、10-3、10-4的适量菌液涂布于羧甲基纤维素琼脂分离培养基上,倒置于37 ℃恒温培养箱中培养。每隔12 h观察一次,培养36 h后取出对菌落进行观察,根据菌落形态挑选菌落。将挑选出来的菌落重复划线接种于羧甲基纤维素钠平板分离培养基,直至纯化出形态稳定的单个菌落,观察并记录其菌落形态指标。
将挑选纯化出的单个菌落接种于装有15 mL羧甲基纤维素钠液体培养基的25 mL的试管中,置入37 ℃、180 r·min-1条件下的振荡培养箱中培养4 d。将培养的试管充分振荡后用移液枪吸取菌液,点接法接种于刚果红纤维素琼脂培养基中,每个平板中接一种菌株,且菌液对称的接种4个位置。将平板放入37 ℃的恒温培养箱中培养,每12 h观察一次,48 h后观察透明圈,并记录菌落的直径(d)、透明圈的直径(D),计算D/d值。
1.3.4 菌株的鉴定
根据菌落的形态学特征初步鉴定菌株的种属,对复筛出 D/d 值排名前三的菌株参考《微生物实验教程》[20]351做生理生化实验,包括甲基红试验(MR试验)、吲哚试验、乙酰甲基甲醇试验(vp试验)、溴甲酚紫试验、葡萄糖发酵产气实验、革兰氏染色实验。
1.3.5 纤维素粗酶活性测定
将复筛得到降解纤维素能力强的3 种菌株接种于装有15 mL液体培养基的试管中,在37 ℃、180 r·min-1条件下的振荡培养5 d。在4 ℃ 、4 000 r·min-1,离心20 min;用磷酸盐缓冲液洗涤2次,在4 ℃、4 000 r·min-1,离心10 min ;使用超声波处理20 min,在4 ℃、5 000 r·min-1,离心20 min,取上清液即得粗酶液。将粗酶液用乙酸-乙酸钠缓冲液,稀释10倍。
(1) DNS法测定最适波长的确定。 关于使用DNS法测定还原糖所用波长,在400~550 nm 都有报道[21]197,[22]535。取2 mL葡萄糖标准溶液和2 mL 蒸馏水置于试管中,再各加2 mL DNS试剂,沸水浴10 min,流水冷却,定容至15 mL,在400~740 nm 比色。
(2) 葡萄糖标准曲线的绘制。如表1所示配制溶液,测定吸光值,应用SPSS作回归分析。
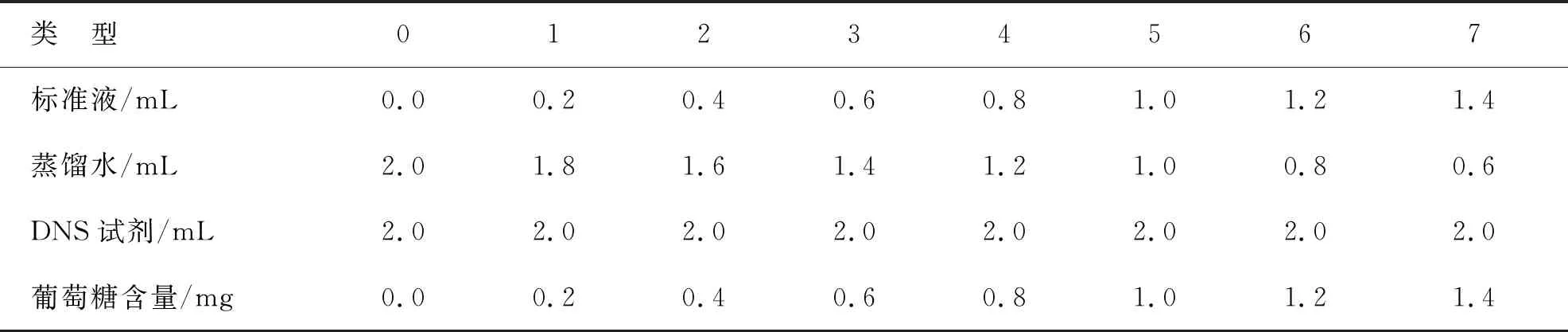
表1 葡萄糖标准曲线吸光值测定
(3) 纤维素酶活性测定。 吸取粗酶液0.2 mL 加入试管,加1%羧甲基纤维素缓冲液 1.8 mL混匀;在 40 ℃ 保温 30 min 后,加入DNS试剂 2 mL,混匀后置于沸水浴中加热10 min;流水冷却,在选定最适波长下比色,根据葡萄糖标准曲线进行计算。定义酶活性单位( U) :在40 ℃、pH6.8的条件下,每分钟内生成 1 μg·mL-1葡萄糖所需要的酶量(U·mL-1)[23]151,[24]3,[25]58。使用酶活性公式
计算酶的活性含量,其中:U为所测酶的活性,单位为U·mL-1;x为样品OD值的平均值;a、b由葡萄糖标准曲线回归方程确定;n为粗酶稀释倍数;T为酶促反应时间;0.2为所加酶液的体积。
2 结果与分析
2.1 菌株的初筛
将 10-1、10-2、10-3、10-4稀释菌液分别涂布于羧甲基纤维素钠琼脂培养基在37 ℃恒温培养箱中倒置培养,36 h 后根据其菌落形态挑取单个菌落,使用平板划线法纯化于羧甲基纤维素钠琼脂培养基,共筛选、纯化出12株具有降解羧甲基纤维素钠能力的菌株。
2.2 菌株的复筛
经观察并统计,对透明圈直径及菌落直径记录,发现6株菌株可以产生透明圈,结果见表2。

表2 菌株的筛选
通过上述实验,共筛选出12株菌株具有羧甲基纤维素钠降解能力,在进行复筛时却发现,只有6株菌株能够产生透明圈。这说明SW-1、SW-4、SW-5、SW-9、SW-10、SW-11 菌株能够利用羧甲基纤维素钠(CMC-Na),但不能利用纤维素;或者说它们不适合在液体培养基培养。
2.3 菌株的鉴定
12株菌株通过连续5次的平板划线接种,各菌株出现稳定形态的菌落,菌落描述见下表3。

表3 12种菌株的形态学描述
可以看出,这些菌株之间的形态差异较大。在颜色上,有亮黄色、也有乳白色;菌落大小上,最小的菌落SW-9仅0.8 mm,最大的菌落SW-6约5.6 mm;形状有突起也有扁平,产长菌丝也有短菌丝。
将D/d值排名前三的菌株SW-2、SW-3、SW-8进行生理生化实验,其结果见表4。

表4 菌株SW-3、SW-8、SW-2生理生化测定
根据表3 、表4 结果,结合《伯杰细菌手册》[26]3,初步鉴定SW-3 菌株为枯草芽孢杆菌,SW-8 菌株疑似芽孢杆菌属一种。
2.4 纤维素酶活性的测定结果
2.4.1最适波长的确定
DNS法测还原糖含量的条件各异,对还原糖的测定也产生一定的影响[27]95,[28]84。考虑到各种因素对实验的干扰,结合文献报道,在 400~740 nm测定结果见图1。
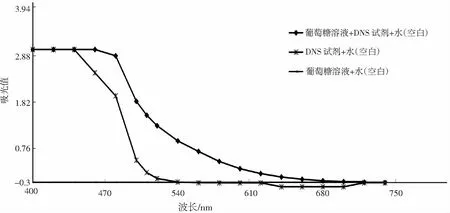
图1 用DNS测定还原糖含量在不同波长下的吸光值
从图1中可以看出,DNS试剂与葡萄糖反应后的生成物在400~720 nm 范围内都有吸收值,在480~600 nm 范围内有明显的吸收值。而DNS试剂在400~540 nm范围内具有吸光值,540 nm处基本不存在吸光值。为了避免DNS 试剂吸光值对生成物吸光值造成影响,所以要根据“吸收最大,干扰最小”的原则,选定的最适波长应该在生成物具有较显著的吸光值,而且DNS试剂的吸光值处于低水平。540 nm 处生成物具有较显著的吸光值,而且DNS试剂的吸光值处于低水平,所以选择540 nm 进行还原糖测定,以提高了测定结果的准确度[29]156。
2.4.2葡萄糖标准曲线的绘制
根据表2配制的溶液,测得对应的吸光值(A),绘制的葡萄糖标准曲线为y=0.874 3x-0.022 4,线性回归系数R2=0.996 5,可用于酶活性测定。
2.4.3纤维素酶活性测定结果
将复筛得出的SW-3 、SW-8 、SW-2分别加入羧甲基纤维素液体培养基中,在37 ℃、180 r/min条件下的振荡培养箱中培养 5 d。经离心、破碎和稀释,制取 10-1粗酶液,使用DNS 法测定的纤维素粗酶活性见表5。
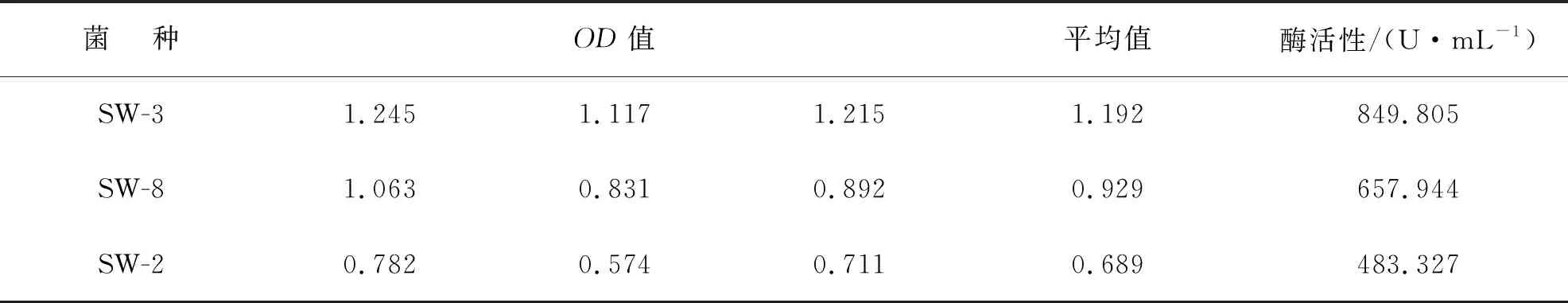
表5 三个菌株纤维素粗酶活性
由表5可以看出,SW-3菌株的酶活性最高,为849.805 U·mL-1,是SW-8酶活性的1.29倍,是SW-2菌株的1.75倍,而SW-8菌株酶活性是SW-2菌株的1.36倍。
3 讨论
红树林生态系统是热带、亚热带海岸带海陆交错区重要的、特殊的生态系统,具有维持生物多样性、防风消浪的作用,对重金属、石油和生活污水等有较强的纳污能力,对污染物有较强的净化功能,而微生物在红树林生态系统中发挥着重要作用[30]449。
本研究检测到的12株菌株对羧甲基纤维素钠具有降解能力,细菌最多;其中有6株菌株能够降解纤维素,占总量的50%。对降解能力较高的3株菌株进行了形态学及生理生化鉴定,得出降解能力最强的菌株SW-3为枯草芽孢杆菌,其粗酶活性为849 U·mL-1。筛选菌株的多与少,与取样地点、季节、使用的培养基、样品菌液的制备以及研究者对不同菌落的辨别能力都有关系,这还有待进一步比较和研究。
如何在刚果红琼脂培养中接种是一个值得研究的问题。研究中采用了菌落点接法和打孔菌液接种法。其中菌落点接法接种试验中,培养3 d后未出现透明圈;打孔菌液接种法是在菌落上打孔,在孔中注入菌液培养,在实验中并未出现张洁娜等[19]151所述菌落生长,只见透明圈出现,不具评判菌种降解能力的意义。鉴于接种方法对透明圈的产生具有一定的影响,所以应该对接种方法进行比较研究,选择对透明圈产生影响最少的方法进行接种。同时还要考虑到菌种的接种量对透明圈产生的影响。
在酶活性测定方面,戴旭青等[24]113研究表明,筛选出的78株降羧甲基解纤维素钠的菌株大部分是真菌,放线菌次之,细菌最少,酶活性最大值为1 074 U·mL-1。本研究中共筛选出 12 株菌,细菌最多,真菌次之,放线菌最少;40 ℃、pH 6.8条件下酶活性为849 U·mL-1,与上述研究有一定差异性。出现这种原因可能是从土样中筛选出的菌株较少,对统计影响较大。马军等[16]977筛选出一株产纤维素酶的枯草芽孢杆菌,在55 ℃、pH 6.8 条件下酶的活性为(1 253.2±16.629) U·mL-1。本研究中粗酶的活性低于其所测值,原因可能在于试验所用粗酶液未进行提纯且未进行最适温度、pH值测试。梁倩等[31]122筛选出3种菌,其所产纤维素酶学活性分别为977.92、1 089.79和 1 538.44 U·mL-1。从文献中来看,真菌的纤维素酶活性低于芽孢杆菌。
DNS 法在测定还原糖含量的众多方法中凭着其简便、快速的特点被广泛使用,但其中存在各种因素的干扰,确定测定的波长是DNS 法测定的重中之重。在本研究中,将各因素(葡萄糖、显色液、水)在400~740 nm 波长下进行测定,本着“吸收最大,干扰最小”的原则,选定了540 nm 的波长。王俊丽等[32]157研究发现,根据回归系数和比耳定律,在葡萄糖含量为0~40 mg·L-1,520 nm为最适测定波长。本研究中采用的是1 mg·mL-1葡萄糖标准溶液,远高于文献所用浓度,所以最适波长有所差别。刘最等[33]48、程鹏等[23]3、高建民[34]6等采用的也都是540 nm 的波长。
在今后的研究中,需要对菌株SW-3进行细化的研究,包括应用16sRNA、ITS 序列测定[35] 64,[36]42,构建系统发育树;对其生长曲线进行测算,探索最佳繁殖条件。对其所产纤维素酶进行纯化及性质分析,对酶的最适温度、最适pH值以及金属离子对酶活性的影响进行研究,以及对菌株的生长曲线和酶活性变化对应关系和酶的稳定性进行研究,为制备降解纤维素菌剂提供依据。
4 结论
研究共筛选出12株具有降解羧甲基纤维素钠能力的菌株,其中细菌最多,真菌次之,放线菌最少。对12株菌种进行复筛,得到6株菌株具备降解纤维素能力,其中菌株SW-3的降解能力最强,鉴定其为枯草芽孢杆菌,其粗酶活性为849 U·mL-1。

