快速升温下皮革珊瑚及真叶珊瑚共生虫黄藻与共生细菌的丰度与多样性
李长青,陆 昊,盖如新,周 洋,王沛政,李卫东
(1.海南三亚国家级珊瑚礁自然保护区管理处,海南 三亚,572000;2.海南热带海洋学院 生态环境学院 海南 三亚,572022;3.海南大学 生态环境学院,海口 570228)
0 引言
珊瑚礁是世界上生物多样性最丰富的生态系统之一。20世纪珊瑚白化已经造成世界各地珊瑚大量死亡,对海洋生态系统造成了严重影响[1]。由于全球气候变暖,世界各地珊瑚礁白化频率和程度在增加,珊瑚礁覆盖大幅下降[2]。中国南海经常发生由于温度变化原因导致的珊瑚白化事件[3],在过去40年间,中国南海北部东沙环礁水温升高2 ℃导致40%的珊瑚以前所未有的速度白化[4]。
珊瑚共生体包括珊瑚宿主、珊瑚内共生虫黄藻和微生物,微生物包括细菌、真菌、古细菌和病毒等;内共生生物与宿主之间相互作用和沟通机制对宿主健康发挥着重要作用[5-6]。虫黄藻是珊瑚体内重要的、能进行光合作用的内共生生物[7]15667。如今珊瑚共生虫黄藻受到全球海面温度升高的威胁,这种温度带来的压力通常会导致珊瑚体内虫黄藻释放,最终致珊瑚白化和死亡[8]。当环境发生变化时,虫黄藻能够通过改变其在珊瑚宿主内的群体结构从而适应宿主体[9-10]。
珊瑚和虫黄藻共生体适应不断变化的环境条件的能力取决于宿主和共生体群体的稳定性[7]15668。Berkelmans等[11]认为珊瑚对温度的耐受性与其体内共生的虫黄藻类型有关。共生虫黄藻优势种群与地理隔离和环境变化有关系[12]。在共生虫黄藻多样性研究中,科学家对其形态与超微结构进行了长期探索和研究[13],但是由于虫黄藻种类繁多,其形态学特征还不能完全解决虫黄藻分类问题[14]。相比传统的形态学分类,使用 DNA 序列进行虫黄藻分类分析则显得更为高效与方便[15]。通过分子学方法研究虫黄藻多样性发现,虫黄藻具有极高的多样性[16],其种类也可由A-I的9个主要系群细分为上百个种[17]。如今ITS2(the internal transcribed spacer 2)区域仍然是学者们区分虫黄藻种类最为有效的DNA标记方法之一[18]866。
除虫黄藻外,珊瑚内共生细菌对珊瑚健康状态也有着直接影响[19],珊瑚共生细菌主要集中在其黏液和体内,对维护珊瑚健康和抵抗疾病有着非常重要的保护作用[20]355,[21]。随着高通量技术的快速发展,结合高通量技术分析细菌多样性方法已经在珊瑚内共生细菌种群研究中得到很好的应用。Sunagawa等[22]利用高通量技术测序方法测序细菌16s rRNA基因,分析Montastraeafaveolata珊瑚内共生细菌多样性。Bayer等[23]利用高通量方法,分析红海Stylophorapistillata珊瑚内共生细菌多样性,发现Endozoicomonas在这种珊瑚内胚层组织中非常丰富,这种细菌与珊瑚有着密切联系。当环境发生变化时,如温度升高,珊瑚共生菌在珊瑚体内可以产生有益化合物或抗体等来应对这种来自环境的压力,来维持整个珊瑚的稳定性[20]357。Kushmaro等[24]研究发现海水温度升高只是一个诱导因素,当海水温度升高时,珊瑚自身抵抗力会下降并增加细菌毒性。在关于珊瑚病原体研究中发现珊瑚白化和弧菌有着直接关系[25-27]。罗尼氏弧菌Vibrioshilonii会产生胞外毒素进而抑制虫黄藻光合作用,使虫黄藻溶解导致珊瑚白化,且不同虫黄藻对罗尼氏弧菌Vibrioshilonii毒素响应是不同的[28]。Serratia会导致珊瑚白痘病发生,最后影响珊瑚健康并造成珊瑚大面积死亡[29-30]。
综上所述,共生藻和共生菌平衡对珊瑚的稳定和健康非常重要,当这种平衡由外界环境改变打破后,整个珊瑚共生藻与细菌共生系统的联系断裂,使得珊瑚白化或者感染疾病死亡。本研究通过2种珊瑚在热刺激后短暂时间内,利用高通量测序方法来研究它们体内共生虫黄藻和细菌多样性及总量的变化情况,以期在全球气候逐渐变暖的情况下为珊瑚礁生态系统保护和修复工作提供参考依据。
1 材料与方法
1.1材料
所有实验样品均从中国海南万宁市外海采集,实验采集软珊瑚皮革珊瑚(Sarcophytontrocheliophorum)和石珊瑚肾形真叶珊瑚(Euphylliaancora)各5个个体,并将所有皮革珊瑚和肾形真叶珊瑚分割成约10 cm2的小个体,并将其附着在陶瓷基座上。于本实验室珊瑚馆暂养2周,珊瑚缸水体量为60 L,温度为26 ℃,盐度为35,pH为8.2,光暗比为12 h∶12 h,2周后待2种珊瑚所有个体恢复正常,触手正常伸展后进行实验。
1.2 方法
1.2.1 急性升温应激
随机挑选10个皮革珊瑚与10个肾形真叶珊瑚个体,分别放置于2个水族缸中(温度:26 ℃,盐度:35,pH:8.2,光暗比12 h∶12 h,体积:70 cm×50 cm×60 cm)。在24 h内调节加热棒缓慢升高水族缸水温(每隔4 h升高1 ℃),当水温升高至32 ℃后维持12 h,其他环境条件不变。实验结束,剪取对照组中5个皮革珊瑚个体的触手各0.2 g,混合命名S-1;对照组肾形真叶珊瑚各0.2 g,混合命名E-1;处理组皮革珊瑚命名S-2与肾形真叶珊瑚命名E-2。
1.2.2 DNA提取、扩增和测序
使用海洋生物基因组DNA提取试剂盒(擎科,广州,中国)提取珊瑚共生体样本基因组。严格遵循试剂盒说明书步骤操作,所提 DNA 经过质量检测后存放于-80 ℃冷冻保存备用。
对细菌16s rRNA基因的V3-V4可变区进行 PCR 扩增,高通量测序接头序列均用下划线标注。ITS引物和16s rRNA引物反应体系与PCR扩增程序参照文献[31]方法。根据Illumina MiSeq平台的标准操作规程构建 PE2×300库,最后于Illumina Miseq PE300平台测序(Majorbio)。
以DNA为模板,ITS2正向引物:
5-TACACGACGCTCTTCCGATCTACTGGAATTGCAGAACTCCGTG - 3
ITS2-reverse反向引物:
5-GAGTTCCTTGGCACCCGAGAATTCCAACTAGGGGATCCATATGCTTAAGTTCAGCGGGT - 3
对虫黄藻ITS2 rDNA基因进行 PCR 扩增。
使用正向引物341F:
5′-CCCTACACGACGCTCTTCCGATCTGCCTACGGGNGGCWGCAG -3′
反向引物805R:
5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC-3′对细菌16s rRNA基因的V3-V4可变区进行 PCR 扩增。
1.2.3 序列信息学分析
参照Liang等[32]的方法,使用Trimmomatic软件平台剔除低质量分数(<20)序列。将所有样本序列按照序列间的距离进行聚类,序列按97%相似度标准分成不同OTU(Operational Taxonomic Units)。基于OTU聚类分析结果,使用软件Motuur对样本聚类结果进行阿尔法多样性指数分析得到单样本的多样性(Alpha多样性),通过 Good’s物种覆盖度(Coverage)、群落丰富度(Ace)和群落多样性(Shannon)指数反映微生物群落的覆盖率、丰度和多样性。
1.2.4 虫黄藻ITS2序列分析
根据NCBI中的Genbank含有的虫黄藻ITS2数据库对所有样本进行blastn比对分析,筛选出OTU序列的最佳比对结果,并对比对结果进行过滤,默认满足相似度>90%且coverage>90%的序列被用来后续分类,不满足条件的序列则被归为unclassified[17]。最后在每种珊瑚测序结果中选取丰度较大且具有代表性的OTUs使用Maximum parsimony来构建进化树。
使用QIIME进行network分析。选取丰度排序在前100位的OTU信息,绘图时选取具有显著联系 (weight≥100) 的节点,采用kamada kawai算法进行绘图。样本以矩形为标识,不同样本颜色不同,OTU或物种分类以饼图为标识,面积大小代表整体丰度大小,饼图中的不同色块代表不同样本在该OTU或物种分类上的丰度大小。
1.2.5 细菌16s序列分析
2 结果
2.1 虫黄藻多样性分析
虫黄藻引物ITS2测序结果共获得234 547个Raw num,然后按照barcode标签序列识别并区分样品得到各样本数据(表1)。最后处理过滤和去除嵌合体与非特异性扩增序列后总共得到233 991个有效序列(S-1:44 091;S-2:55 356;E-1:38 039;E-2:96 505)。每个样品获得的OTUs进行多样性指数分析(表2)。从Chao指数和Ace指数可以看出,在热处理后,2种珊瑚的共生虫黄藻测序数据总数明显增多。在升温后,肾形真叶珊瑚的Shannon指数降低,但皮革珊瑚Shannon指数几乎不变,Simpson指数分析可以得到相同结果。升温前后来看Shannon指数和Simpson指数均表明虫黄藻多样性方面肾形真叶珊瑚显著高于皮革珊瑚。
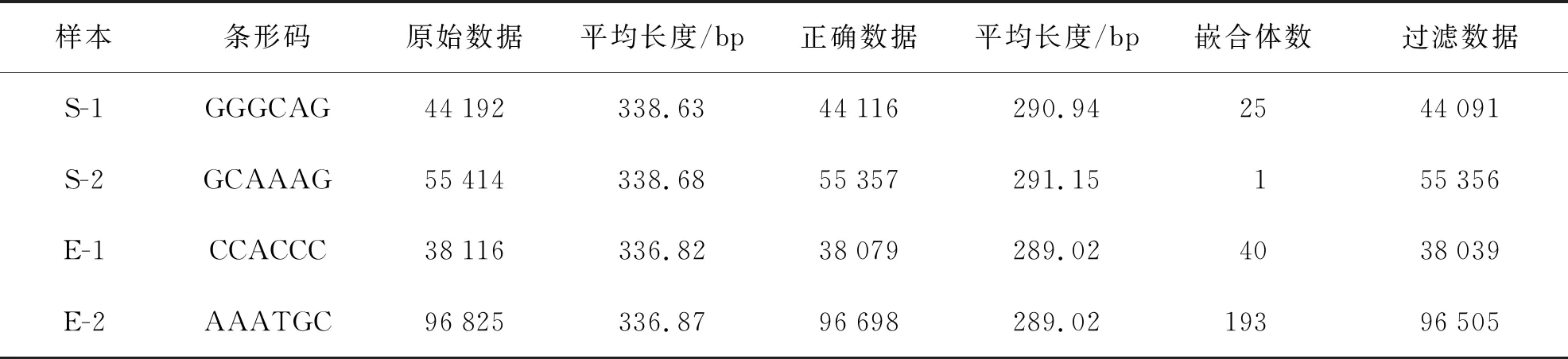
表1 虫黄藻ITS2序列测序数据信息统计
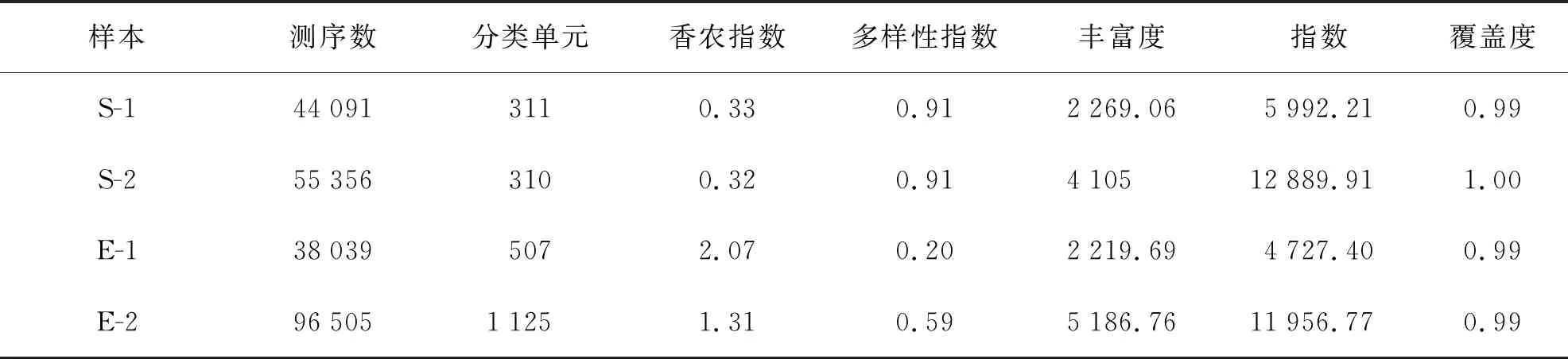
表2 Alpha多样性指数统计
将每个样品的OTUs与Genbank含有的虫黄藻ITS2数据库进行blastn比对分析,最后选取丰度较高的OTUs使用Maximum parsimony来构建进化树(图1)。结果显示,在皮革珊瑚中存在Clade C和Clade D两个系群虫黄藻,其中:Clade C系群为皮革珊瑚优势种群,在肾形真叶珊瑚中同样有Clade C和Clade D两种虫黄藻,但Clade D为优势种群。选取丰度排序在前100位的OTU信息,选取具有显著联系 (weight≥100) 的节点最后进行network分析并绘图,结果如图2。
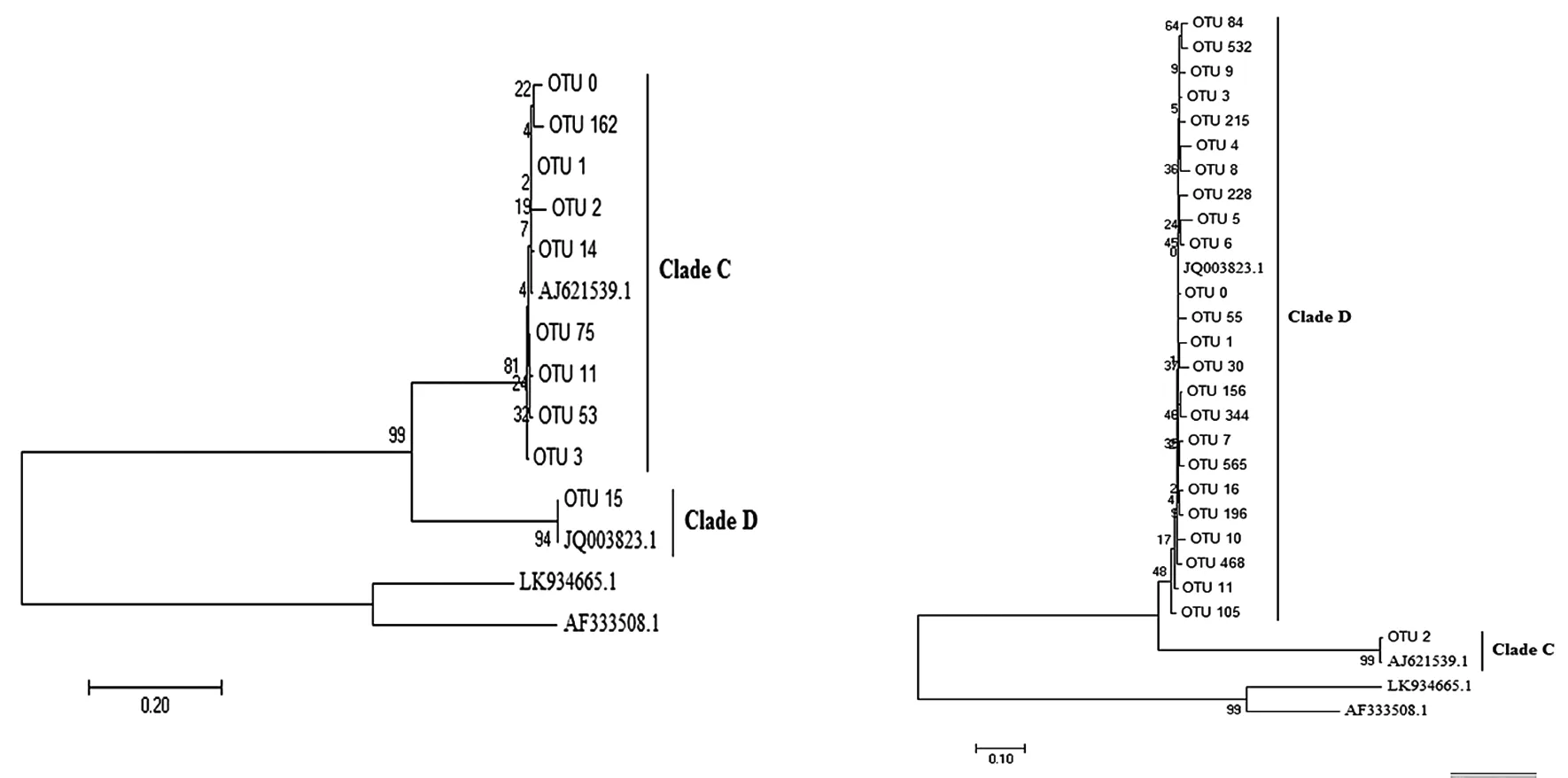
(a)皮革珊瑚 (b)肾形真叶珊瑚图1 基于不同OTUs的ITS2基因序列构建系统进化树
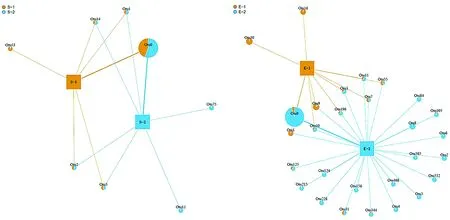
(a)皮革珊瑚 (b)肾形真叶珊瑚图2 皮革珊瑚和肾形珊瑚的network分析结果注2:两种珊瑚的图中矩形代表样本,不同样本颜色不同;OTU以饼图为标识,面积大小代表整体丰度大小,饼图中的不同色块代表不同样本在该OTU分类上的丰度大小。
2.2 细菌多样性
基于细菌16s rDNA基因的测序结果,经处理过滤和去除嵌合体与非特异性扩增序列后,共计得到115 692个有效序列(表3)。将所有样本序列按照序列间距离进行聚类,再根据序列之间的相似性将序列分成不同的操作分类单元 (OTU),把每个样品获得的OTUs进行多样性指数分析,结果见表4。从Chao指数和Ace指数可以看出,在热处理后,2种珊瑚的内共生细菌的总数均出现下降。热处理后,2种珊瑚的Shannon指数和Simpson指数呈现出明显的差异,皮革珊瑚的内共生细菌多样性明显下降,而肾形真叶珊瑚的内共生细菌多样性明显增加。
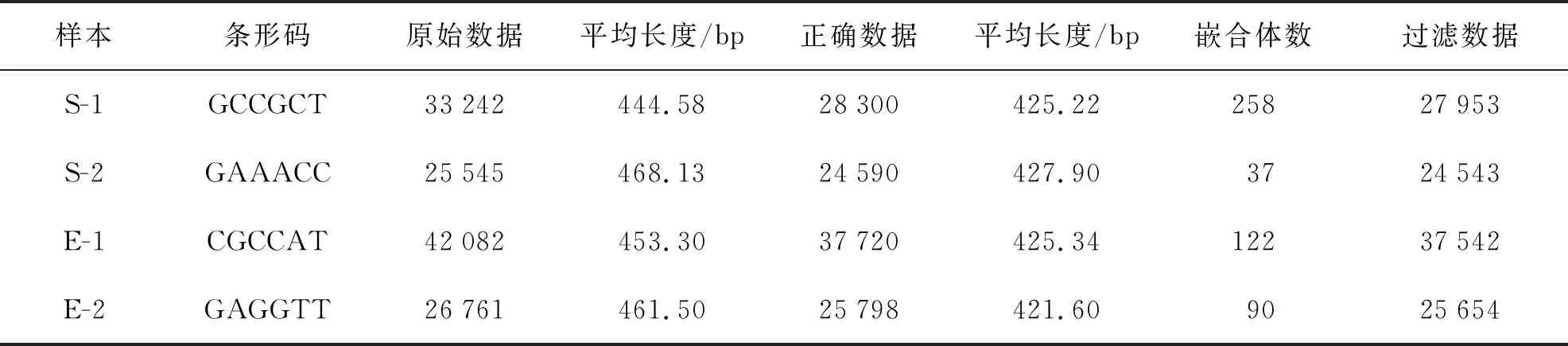
表3 基于细菌16s rDNA基因各样本数据信息
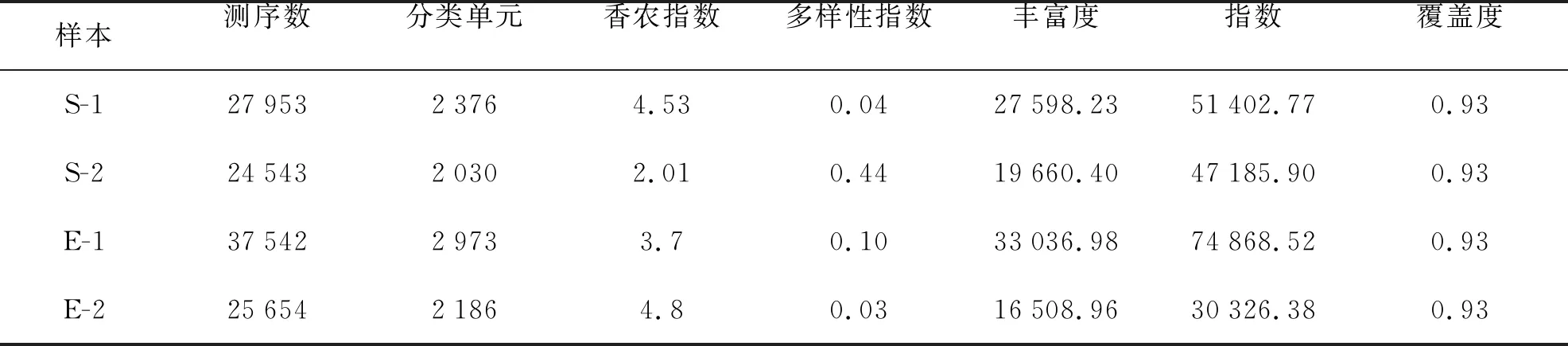
表4 Alpha多样性指数
对每个样品获得的OTUs基于RDP数据库进行物种分类,获得在属水平上群落结构分布柱状图(图3)。皮革珊瑚在升温前Spongiibacter、Achromobacter、Solimonas、Stenotrophomonas、Oceanococcus和Citrobacter为优势种群,升温后细菌多样性下降明显,Delftia和Serratia上升为优势种群(图4),与对照组差异显著(P<0.01)(图5a)。肾形真叶珊瑚珊瑚升温前优势种群为Oceanococcus(Ectothiorhodospiraceae科)、Solimonas(Sinobacteraceae科)、Marivita(Rhodobacteraceae科)、Citrobacter(Enterobacteriaceae科)和Stenotrophomonas(Xanthomonadaceae科),升温后肾形真叶珊瑚细菌多样性增加,优势种群成为Alcanivorax(Alcanivoracaceae科)、Loktanella(Rhodobacteraceae科)、Neptuniibacter(Oceanospirillaceae科)、Leisingera(Rhodobacteraceae科)和Achromobacter(Alcaligenaceae科),其中Oceanococcus、Spongiibacter、Marivita和Solimonas的数量显著下降(图5b)。
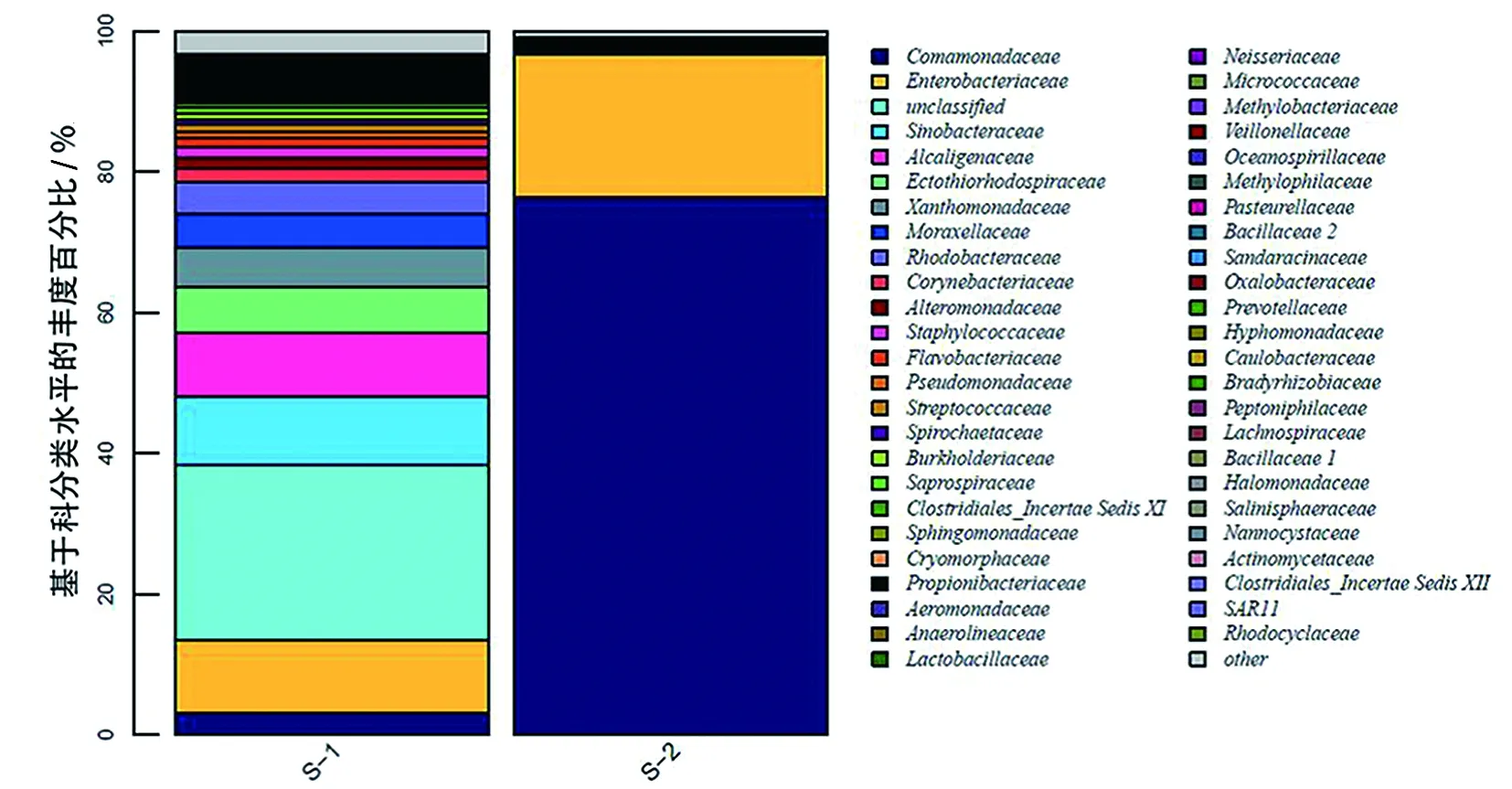
(a)皮革珊瑚

(b)肾形真叶珊瑚图3 皮革珊瑚和肾形真叶珊瑚在热处理前后内共生的细菌群落多样性变化
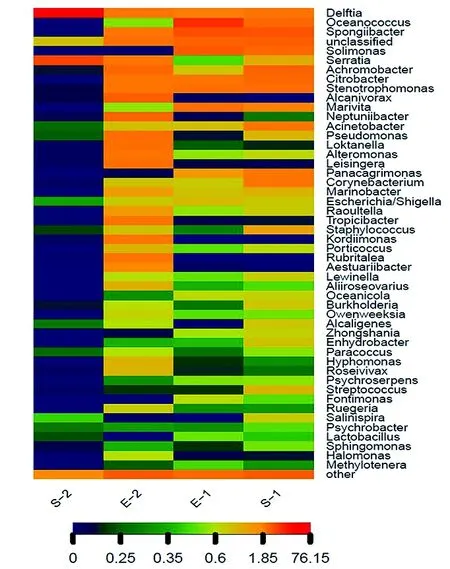
图4 其生细菌各属分类水平丰度热图
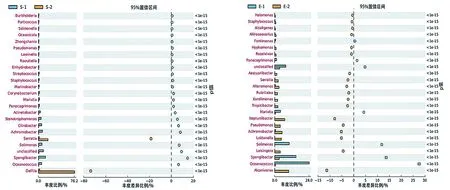
(a)皮革珊瑚 (b)肾形真叶珊瑚图5 热处理前后菌群丰度差异分析
3 讨论
本研究利用高通量测序技术初步研究了急性热刺激对中国南海2种珊瑚内共生虫黄藻及细菌的响应。基于高通量测序技术OTUs框架,利用ITS2 rDNA引物扩增来研究珊瑚共生虫黄藻的多样性方法已被很多的研究者认可和使用[33-35]。Chen等[36]曾报道中国南海的肾形真叶珊瑚的共生藻都为Clade C,而本研究高通量测序结果表明肾形真叶珊瑚共生藻优势系群为Clade D,皮革珊瑚内共生虫黄藻优势系群为Clade C。2种珊瑚在经过热刺激处理后,内共生虫黄藻优势系群并没有发生改变,这与Stat等[37]研究一致。本研究的2种珊瑚在热刺激后短暂时间内虫黄藻的总数增加,而 Strychar等[38]认为珊瑚在受到外界热环境影响后导致虫黄藻逃逸,这可能由于珊瑚热处理后珊瑚组织失水导致;在热刺激后皮革珊瑚内共生虫黄藻多样性变化不明显,可能和皮革珊瑚对温度的耐受性较强有关[39],而在热处理后肾形真叶珊瑚虫黄藻多样性下降。
在热刺激后2种珊瑚内共生细菌总数都下降,这可能和细菌本身对温度的耐热性有关,耐热性低的细菌会在升温后死亡。皮革珊瑚在升温后内共生细菌多样性降低,内共生细菌Delftia(Comamonadaceae科—Burkholderiales目)和Serratia(Enterobacteriaceae科—Enterobacteriales目)成为优势种群。其原因可能为Delftia是好氧菌(aerobic),在热刺激后珊瑚代谢增强,虫黄藻总量增加,光合作用释放了更多的氧气,导致好氧菌Delftiasp数量增加成为优势菌所致。Ritchie[40]研究发现珊瑚共生细菌能够分泌具有抗生素能力的黏液来抵抗Serratia,升温破坏了珊瑚的这种抵抗能力。Chiu[41]对Euphyllia glabrescens的共生细菌分布研究发现Alphaproteobacteria经常分布在黏液和表皮之间,而Gammaproteobacteria在胃肠道中检测到,并且在黏液和表皮中很少观察到。肾形真叶珊瑚在热刺激前,Gammaproteobacteria(Oceanococcus、Solimonas、Citrobacter、Stenotrophomonas)和Alphaproteobacteria(Marivita)为优势种群,这和Chiu[41]的研究结果一致。肾形真叶珊瑚在热刺激后其内共生细菌多样性变高,Alcanivorax(Alcanivoracaceae科)、Loktanella(Rhodobacteraceae科)、Neptuniibacter(Oceanospirillaceae科)、Leisingera(Rhodobacteraceae科)和Achromobacter(Alcaligenaceae科)变为优势菌,常见的珊瑚病原菌Vibrio、Cyanobacteria和Serratia等变化不明显。

