无乳链球菌对奶牛乳腺成纤维细胞金属蛋白酶及uPA 系统表达的影响
(内蒙古农业大学兽医学院,内蒙古呼和浩特 010018)
奶牛乳腺炎是奶牛被多种病原微生物(细菌、支原体等)感染而引起的一种奶牛乳腺发生的炎症,属于奶牛常见疾病。组织器官的纤维化过程主要与细胞外基质(extracellular matrix,ECM)的沉积、分解和相关细胞凋亡等有关,奶牛乳腺成纤维细胞(bovine mammary fibroblasts,BMFBs)是乳腺纤维化的主要参与细胞,在奶牛乳腺发生纤维化时可以产生ECM[1]。ECM 的合成和降解平衡失调,与基质金属蛋白酶(matrix metalloproteinases,MMPs)、基质金属蛋白酶组织抑制因子(tissuse inhibitors of matrix metalloproteinases,TIMPs)和纤溶酶原(plasminogen,Plg)激活系统的蛋白酶活性有关[2-3]。MMPs 系统是调控ECM 代谢的主要酶系,能使纤维胶原蛋白和ECM 的某些成分变性和降解,其中MMP-2 和MMP-9 同属于MMPs家族中的明胶酶类,结构相似,可降解IV 型胶原蛋白等ECM 组分;两者的催化活性主要受基因表达、酶原活化和活化后调节3 个方面的调控[4]。MMPs 能使卵泡形态发生改变,对哺乳动物卵泡发育发挥着重要作用[5]。纤溶酶原激活物(plasminogen activator,PA)是一种丝氨酸蛋白酶,是纤溶酶形成的启动物,纤溶酶可激活MMPs 从而降解ECM[6]。PA 包括组织型纤溶酶原激活物(tissue plasminogen activator,tPA)和尿激酶型纤溶酶原 激 活 物(urokinase type plasminogen activator,uPA)。纤溶酶原激活物抑制因子(plasminogen activator inhibitors,PAIs)包括PAI-1 和PAI-2,其中PAI-1 是大小为50 kDa 的蛋白,其活性中心与PA 活性中心不可逆共价结合后,可以使PA 失去活性[7]。PAI-1 通过调节ECM 的降解和沉积、刺激细胞增殖、调节细胞的粘附作用等过程参与许多疾病的发展,如对组织纤维化、肿瘤和心血管疾病等的发生发展都有作用[8]。
无乳链球菌(S.agalactiae)是引起奶牛乳腺炎的主要病原菌之一。有研究报道,临床型乳腺炎中链球菌的检出率远远高于其他致病菌[9]。引起奶牛乳腺炎的链球菌中无乳链球菌、停乳链球菌(S.dysgalactiae)和乳房链球菌(S.uberis)分离率较高[10],由链球菌引起的奶牛乳腺炎传播速度快、传染性强、传播范围广。无乳链球菌也称为B组链球菌,是革兰氏阳性细菌。其属于高接触性传染菌,主要通过养殖人员、蚊蝇和养殖场取乳设备等接触传播扩散[11]。奶牛发生乳腺炎时,乳腺组织会呈现不同程度的红肿、胀痛;局部乳区会出现发热症状,还会伴随精神沉郁、烦躁、拒绝进食等异常情况;乳汁混浊甚至含有条状物或颗粒样混浊,泌乳减少甚至停止[12]。无乳链球菌为人兽共患病病原菌,尤其喜好感染孕妇、新生儿等免疫功能不全者,可引起产妇产后感染、菌血症、心内膜炎等疾病,死亡率较高[13-14];其还可引起尼罗罗非鱼器官障碍衰竭,最终导致鱼死亡[15]。
目前,关于肝脏和肾脏等组织纤维化的研究较多,鲜见关于无乳链球菌对奶牛BMFBs MMPs/TIMPs 与uPA 系统表达作用的研究报道。本研究主要用热灭活的无乳链球菌菌液作用于体外培养的BMFBs,通过研究其对MMPs/TIMPs 和uPA 系统表达的影响,从而进一步阐明奶牛乳腺纤维化的病理过程和发病机理,不仅为明确ECM 代谢分子机制提供试验数据,也为全面理解MMPs/TIMPs 及uPA 系统对奶牛乳腺纤维化预防和治疗的新方法以及新药物的研究与开发奠定理论基础。
1 材料与方法
1.1 菌种及细胞
S.agalactiae菌种由本实验室分离、鉴定并保存,BMFBs 由本实验室保存备用[16]。
1.2 主要试剂
Multisource Total RNA Miniprep Kit,购自AXYGEN 公司;全蛋白提取试剂盒,购自生工生物工程(上海)股份有限公司;反转录试剂盒、qPCR 试剂盒,购自TaKaRa 公司;DMEM/F12 培养基,购自Gibco 公司;BCA 蛋白浓度测定试剂盒,购自碧云天生物技术研究所;鼠抗β-actin 单克隆抗体(KM9001),购自天津三箭生物技术股份有限公司;兔抗MMP-2 多克隆抗体、兔抗MMP-9 多克隆抗体、兔抗uPA 多克隆抗体、兔抗PAI-1 多克隆抗体、兔抗TIMP-1 多克隆抗体、兔抗TIMP-2 多克隆抗体,购自Proteintech 公司;山羊抗兔IgG-HRP、山羊抗鼠IgG-HRP 二抗,购自天津三箭生物技术股份有限公司;SDS-PAGE 凝胶制备试剂盒,购自北京索莱宝科技有限公司;ECL 显色液、蛋白预染Maker,购自Thermo 公司;MMP-2 和MMP-9 明胶酶谱法检测试剂盒,购自上海信帆生物科技有限公司。
1.3 热灭活菌液配置
取冻存的S.agalactiae置于5 mL 营养肉汤培养基中,37 ℃恒温摇床低速培养10~18 h;菌液混浊后在营养琼脂培养基上划线继续培养,待长出肉眼可见菌落后,挑取单个菌落扩增培养;在培养基上挑取4~5 个长势好的单菌落移至营养肉汤培养基中(重复1 次),37 ℃恒温摇床低速培养15~18 h,倍比稀释进行涂板计数;根据实验室前期研究摸索情况,选取适宜浓度,将菌液制成107cfu/mL,并于75 ℃水浴锅中热灭活30~40 min 备用。
1.4 BMFBs 的复苏及培养
预先将5 mL 青霉素-链霉素溶液(青霉素100 U/mL、链霉素0.1 mg/mL)加入555 mL 含10%胎牛血清(FBS)的DMEM/F12 培养基中,配置完全培养基。将冻存的BMFBs 从液氮中取出,37 ℃温浴1 min,转移细胞及3~5 mL 完全培养基至15 mL 离心管中,1 000 r/min 离心6 min;弃去培养基,加入3~5 mL 新的完全培养基重悬细胞,将细胞转移至25 cm3细胞瓶,置于37 ℃恒温生化培养箱中培养,隔日换液并观察细胞生长情况;待细胞铺满细胞瓶后按1:3 进行传代,传至第7 代细胞形态轮廓清晰,单层长满后加入无血清培养液对细胞饥饿处理24 h;处理组加入1 mL 107cfu/mL灭活的S.agalactiae菌液,对照组加入1 mL 无血清的细胞培养基,分别作用6、12、24、48 h,收集细胞上清液检测MMP-2、MMP-9 活性,提取总RNA 和总蛋白。
1.5 试验方法
1.5.1 实时荧光定量PCR 检测 选用β-actin为内参基因,qPCR 反应体系参考TB® Premix ExTaq™II 说明书进行操作,并于QuantStudioTM7 Flex Real-Time PCR System 仪器进行反应。设计β-actin、MMP-2、MMP-9、TIMP-1、TIMP-2、uPA、PAI-1基因引物序列(表1),送至生工生物工程(上海)有限公司合成。根据RNA 提取试剂盒说明书,提取处理组和对照组细胞总RNA,通过酶标仪测量各组RNA 浓度和纯度,参照反转录试剂盒说明书制备cDNA,保存于-20 ℃备用。以β-actin作为内参基因,利用RT-qPCR 试剂盒检测MMP-2、MMP-9、uPA、PAI-1、TIMP-1、TIMP-2mRNA 转录水平,设置3 次重复试验。
1.5.2 Western Blot 检测 利用全蛋白提取试剂盒提取BMFBs 总蛋白,采用BCA 检测试剂盒检测蛋白浓度。蛋白经金属浴100 ℃ 5 min 变性后,-80 ℃保存备用。分别以鼠抗β-actin 单克隆抗体(1:10 000 稀释)、兔抗MMP-2 多克隆抗体(1:500稀释)、兔抗MMP-9 多克隆抗体(1:500 稀释)、兔抗uPA 多克隆抗体(1:500 稀释)、兔抗PAI-1多克隆抗体(1:500 稀释)、兔抗TIMP-1 多克隆抗体(1:300稀释)、兔抗TIMP-2多克隆抗体(1:300)为一抗,以山羊抗小鼠IgG-HRP(1:4 000)、山羊抗兔IgG-HRP(1:3 000)为二抗,采用Western Blot 检 测MMP-2、MMP-9、TIMP-1、TIMP-2、uPA、PAI-1 蛋白表达情况,设置3 次重复试验。

表1 qPCR 引物序列
1.5.3 明胶酶谱活性检测 参考MMP-2、MMP-9酶谱检测试剂盒操作说明书,制备含MMP 底物蛋白的SDS-PAGE 凝胶;S.agalactiae灭活菌液处理不同时间(6、12、24、48 h)后,收集处理组和对照组细胞上清液,与2×SDS-PAGE nonreducing buffer 按照体积比1:1 混合,上样,在110 V 电压下进行凝胶电泳;分别用明胶酶谱检测试剂盒1×Buffer A、1×Buffer B 敷育凝胶,然后CCB 染色液染色并脱色;将凝胶放在扫描仪上扫描,透亮区域即为MMP-2、MMP-9 的酶谱及活性位置。
1.6 数据分析 RT-qPCR 结果的数据处理采用2-ΔCT法,Western Blot 条带和明胶酶谱条带用ImageJ 软件进行灰度值分析,以目的蛋白灰度值/内参蛋白灰度值表示蛋白相对定量的结果。然后进行统计分析,各组内差异采用双因素方差分析,以P<0.05 表示差异具有统计学意义(P>0.05:与对照组相比差异不显著;P<0.05,与对照组相比差异较显著;P<0.01,与对照组相比差异显著;P<0.001,与对照组相比差异极显著),以GraPhPad Prism5 软件制作柱状图。
2 结果与分析
2.1MMP-2、MMP-9mRNA 转录、相应蛋白表达水平及明胶酶谱分析
2.1.1MMP-2、MMP-9mRNA 转录水平 作用6、12、24、48 h 后,与对照组相比,处理组MMP-2mRNA 转录水平除在6 h 时差异不显著(P>0.05)外,其他各时间点转录水平均升高,其中作用后12、24 h 显著升高(P<0.01),48 h 表达水平稍回落,差异较显著(P<0.05)(图1-A);MMP-9mRNA 转录水平呈降低—升高—降低—升高变化趋势,在作用后12、48 h 差异不显著(P>0.05)(图1-B)。结果表明,热灭活S.agalactiae处理BMFBs 后,MMP-2mRNA 转录水平与对照组相比总体呈上升趋势,MMP-9mRNA 转录水平呈下降趋势。
2.1.2 MMP-2、MMP-9 蛋白表达情况 与对照组相比,MMP-2 蛋白除在作用6 h 时表达差异不显著(P>0.05)外,在12 h 和48 h 时表达极显著升高(P<0.001),而在作用24 h 时显著下降(P<0.01)(图2-A);MMP-9 蛋白在作用6 h 时表达较显著升高(P<0.05),在作用12 h 时极显著下降(P<0.001),在其余时间点差异不显著(图2-B)。结果表明,热灭活S.agalactiae处理BMFBs 后,MMP-2 蛋白水平与对照组相比主要呈升高-降低-升高趋势,MMP-9蛋白表达水平呈先升高后下降趋势。
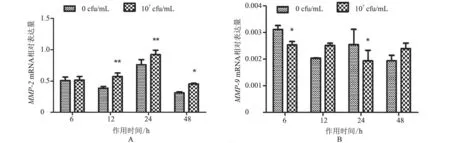
图1 MMP-2、MMP-9 mRNA 转录水平分析结果

图2 MMP-2、MMP-9 蛋白表达分析结果
2.1.3 MMP-2、MMP-9 蛋白明胶酶谱分析作用6、12、24、48 h 后,利用明胶酶谱法检测MMP-2 和MMP-9 蛋白活性。结果显示,可在72 kDa 位置处发现清晰、活化的MMP-2 条带,在92 kDa 位置处发现亮度微弱的活化MMP-9 条带(图3-A)。图中未出现130、225 kDa 的proMMP-2/MMP-9(MMP-2/MMP-9 蛋白前体)条带,这可能是由不同分子量蛋白在SDS-PAGE 电泳时迁移效率不同所导致。与对照组相比,MMP-2 活性在各个时间点均有差异,其中在作用6 h 和48 h 时差异极显著(P<0.001),12 h 和24 h 时差异显著(P<0.01,图3-B)。MMP-9 活性主要呈升高-降低-升高趋势,在作用12 h 时差异不显著(P>0.05),6、24、48 h 时差异极显著(P<0.001,图3-C)。结果表明,热灭活S.agalactiae处理BMFBs 后,MMP-2 的酶活性较MMP-9 明显,二者均在作用6 h、48 h 时活性最强。
2.2TIMP-1、TIMP-2mRNA 转录水平和相关蛋白表达情况

图3 MMP-2、MMP-9 蛋白明胶酶谱分析结果
2.2.1TIMP-1、TIMP-2mRNA 转录水平 处理6、12、24、48 h 后,与对照组相比,TIMP-1mRNA转录水平在中后期呈现先升高后降低趋势,在24 h 时表达极显著升高(P<0.001),在48 h 时表达显著降低(P<0.01),其余时间点表达不显著(P>0.05,图4-A);TIMP-2mRNA 转录水平则有着不同程度的降低。在处理后12 h 时显著降低(P<0.01),其余时间点均不显著(P>0.05,图4-B)。结果表明,热灭活S.agalactiae处理BMFBs 后,TIMP-1 mRNA 水平呈先上升后下降趋势,TIMP-2 mRNA 转录水平主要呈下降趋势。
2.2.2 TIMP-1、TIMP-2 蛋白表达情况 TIMP-1蛋白除在作用24 h 时表达不显著(P>0.05)外,在其余时间点表达均显著,呈先降低后升高的变化趋势,在6 h 时极显著降低(P<0.001),在12 h 时显著降低(P<0.01),在作用48 h 时表达极显著升高(P<0.001,图5-A)。TIMP-2 蛋白表达与对照组相比,在作用12 h 和24 h 时表达极显著升高(P<0.001),在作用其余时间点均不显著(P>0.05,图5-B)。结果表明,热灭活S.agalactiae作用BMFBs 后,TIMP-1 蛋白呈先下降后上升的趋势,TIMP-2 蛋白主要呈上升趋势,且在作用12 h 和24 h 时上升明显。

图4 TIMP-1、TIMP-2 mRNA 转录水平分析结果
2.3uPA、PAI-1mRNA 转录水平和相应蛋白表达情况
2.3.1uPA、PAI-1mRNA 转 录 水 平 作 用6、12、24、48 h 后,与对照组相比,uPAmRNA 转录水平总体呈降低趋势,在作用12 h 时显著降低(P<0.01),在24 h 时极显著降低(P<0.001),其余时间点不显著(P>0.05,图6-A);PAI-1mRNA 转录水平在作用后6 h 和48 h 时差异不显著(P>0.05),在12 h 时极显著降低(P<0.001),在24 h 时显著降低(P<0.01,图6-B)。结果表明,热灭活S.agalactiae作用BMFBs 后,uPA、PAI-1mRNA 转录水平与对照组相比主要呈下降趋势,且具有明显时间依赖性。
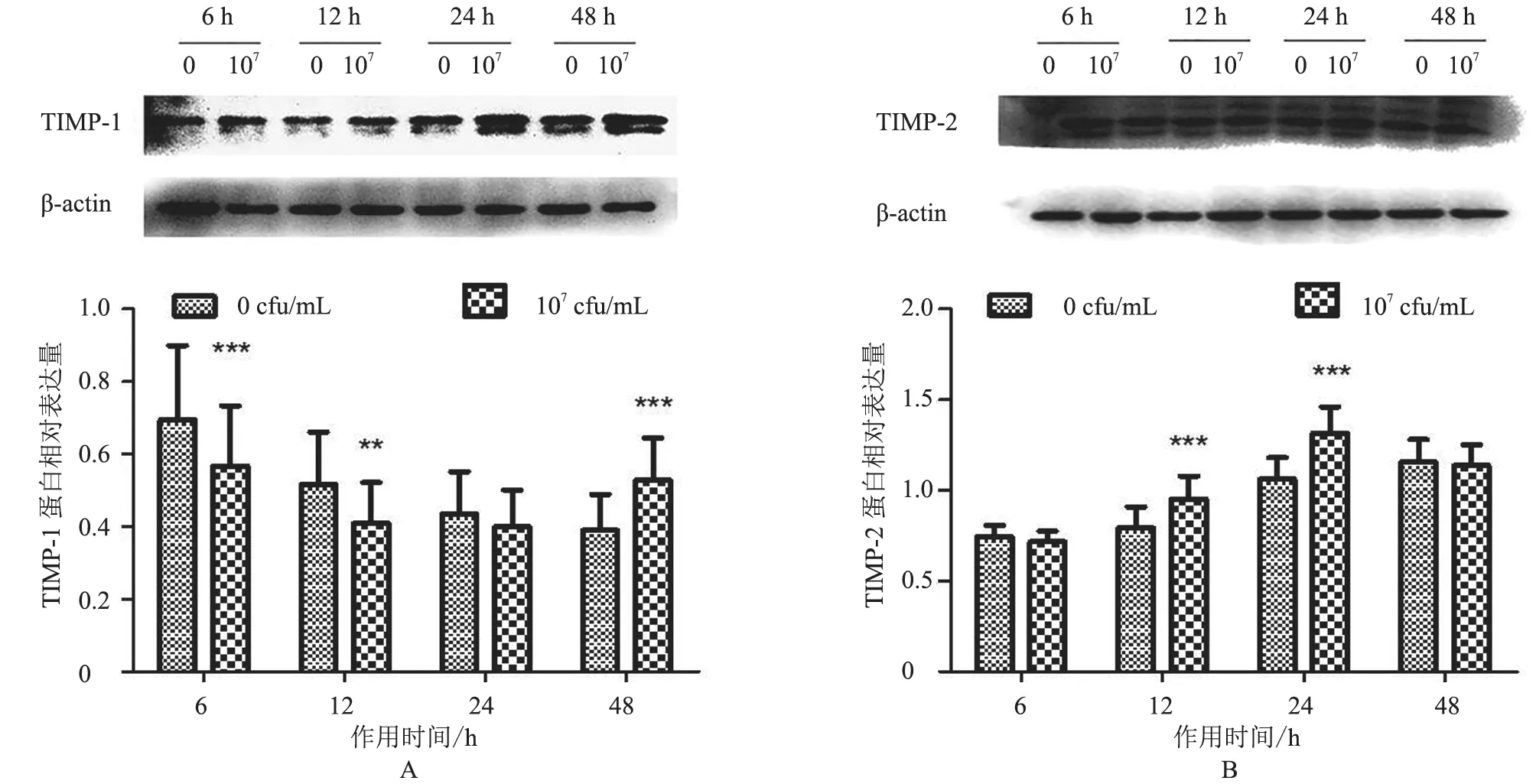
图5 TIMP-1、TIMP-2 蛋白相对表达量分析结果
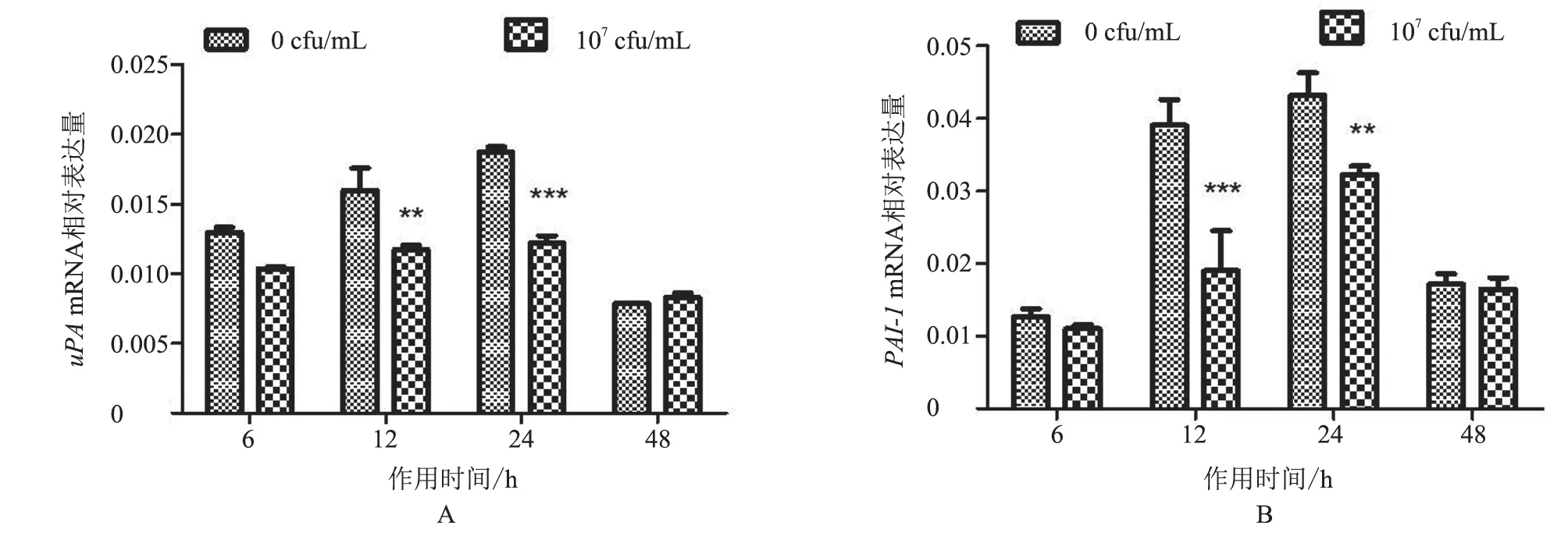
图6 uPA、PAI-1 mRNA 转录水平分析结果
2.3.2 uPA、PAI-1 蛋白表达情况 与对照组相比,uPA 蛋白除在6 h 时表达不显著(P>0.05)外,在其余时间点均有显著差异,其中在12 h 和48 h时均极显著降低(P<0.001),在24 h 时极显著升高(P<0.001,图7-A);PAI-1 蛋白在各个时间点表达均有显著差异,在作用6 h 和48 h 时极显著降低(P<0.001),在12 h 时显著上升(P<0.01),24 h 时表达极显著上升(P<0.001,图7-B)。结果表明,uPA、PAI-1 蛋白水平与对照组相比均主要呈先降低后升高再降低的趋势。
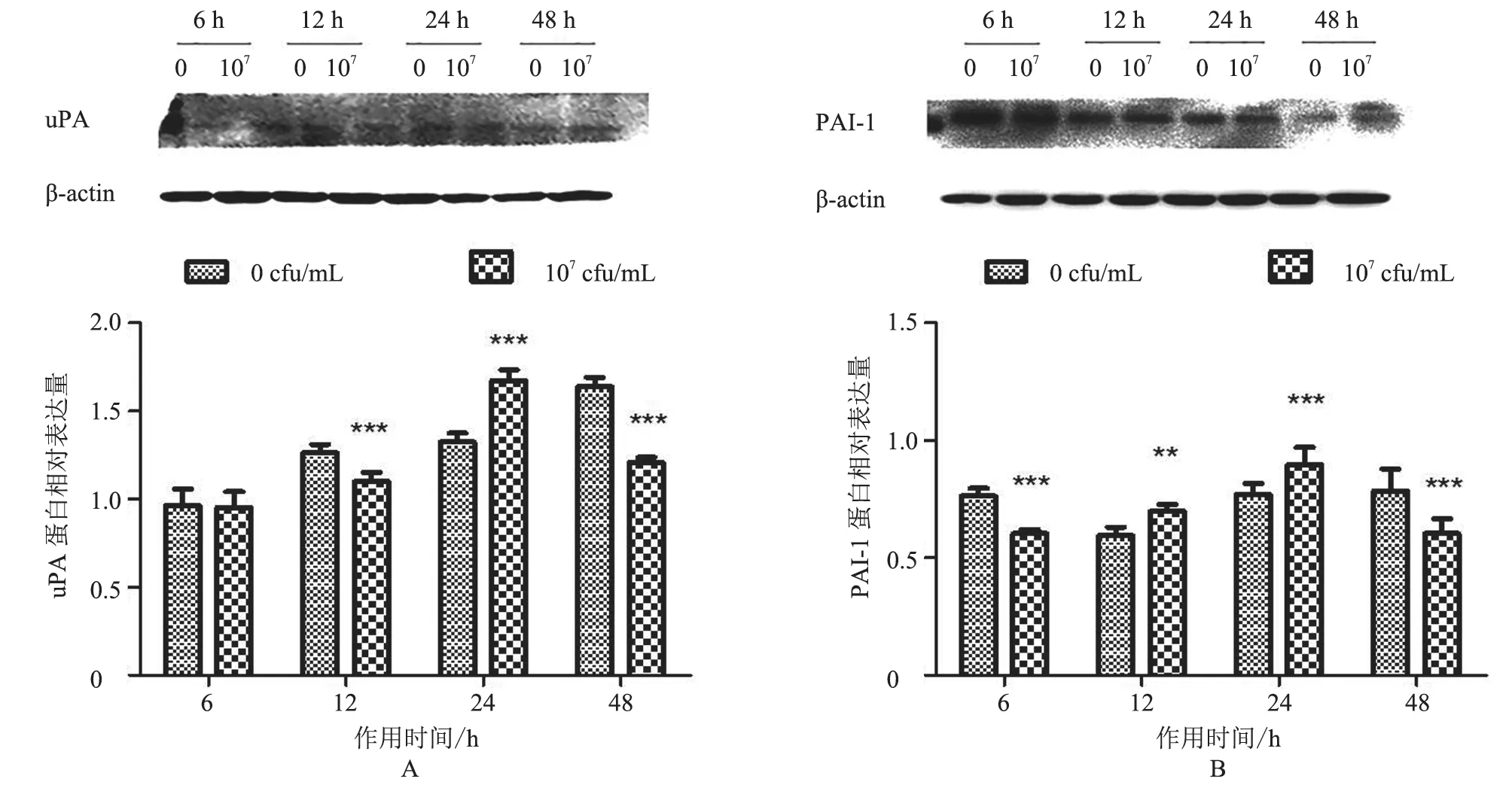
图7 uPA、PAI-1 蛋白相对表达量分析结果
3 讨论
MMPs 系统以及uPA 系统是调控ECM 代谢的主要酶系。MMPs 是抗纤维化因子,可以降解ECM 以限制组织和器官纤维化的发生。MMPs 作为酶原从细胞中分泌,需要通过蛋白酶(如纤溶酶)进行蛋白水解,纤溶酶原产生激活物主要发生在细胞表面。uPA 系统不仅参与纤溶蛋白降解,也可以促进MMPs 活化。uPA 系统、纤溶酶和MMPs 构成的级联激活反应是调节ECM 累积的关键途径之一,uPA 位于这个级联激活反应的顶端,可以促进MMPs 与纤溶酶一同降解ECM 等基膜成分,从而参与炎症反应,抑制纤维化进程[17]。有研究[18]表明,在肝纤维化中,星状细胞(HSC)活化并产生uPA和PAI-1,PAI-1 可与活化的uPA 结合,抑制其功能,加速ECM 沉积。在骨关节炎研究中发现,白介素-1β 可以上调uPA、PAI-1 和MMP-9 水平,进而调控ECM 的代谢平衡[19]。在博来霉素诱导的肺纤维化大鼠体内,过表达PAI-1 可加重纤维化[18];肺成纤维细胞中uPA 表达上调,PAI-1 呈下降趋势[20];然而,氯化汞引起的肾小管间质纤维化中,PAI-1 表达不断增加,而uPA 表达并没有增加[21],说明在不同器官纤维化中uPA 系统的表达存在差异,这可能与不同的诱导机制有关。本研究结果显示,热灭活的S.agalactiae诱导BMFBs 在早期表达MMP-2、MMP-9 和uPA,uPA 可以与纤溶酶原结合位点及uPA 受体结合,能将无活性的Pro-MMP 激活成为有活性的MMP[22]。随着时间延长,在中期PAI-1 表达上升,而MMPs 表达下降,PAI与uPA 结合,抑制了其功能,uPA 的下调可能促进了TGF-β1 前体激活,从而抑制MMPs 的活性,加重纤维化程度;uPA 纤溶酶一方面激活MMPs,引起ECM 降解,另一方面又诱导产生PAI-1,使纤溶酶的产生受限,激活不至于过度。说明uPA系统一方面调控ECM 的代谢,另一方面参与诱导调控MMPs 的激活和调控过程,而且在纤维化中可能与ECM 的降解平衡失调有关,也可能存在相互诱导或抑制的关系。
抑制MMPs 蛋白水解活性或上调TIMPs 表达通常是ECM 积累导致纤维化的重要原因之一[23]。关于组织器官纤维化的研究报道比较多,在CCL4和胆管结扎诱导的肝脏纤维化模型组中,MMP-2 和MMP-9 表达显著下降,而TIMP-1 表达显著增高[24];有研究[25]表明,MMPs 失衡与心肌纤维化的发展有关,在梗死大鼠实验模型中观察到发生心肌梗死的大鼠MMP-2、MMP-9 表达上调;据文献[26]报道,给予小鼠模型外源性LPS(lipopolysaccharide)刺激,会导致MMP-2、MMP-9 蛋白水平显著升高,心脏纤维化加重;有研究[27]发现,白介素-1β、表皮生长因子、肿瘤坏死因子-α 等因子可诱导MMPs转录,证明MMPs 的表达与细胞因子表达有关,而转化生长因子-β 可在转录水平阻断MMPs 的表达。本课题组前期研究表明,S.agalactiae可以诱导BMFBs 中TGF-β1、PDGF、bFGF 的 表 达[28],在L-NAME 诱导高血压大鼠模型中也观察到了TGF-β1 表达,TGF-β1 在炎症反应中起着重要作用,其过高表达可促进纤维化发生发展进程[29]。
本研究结果表明,S.agalactiae处理BMFBs后,明胶酶谱法检测MMP-2、MMP-9 酶活性良好,且呈上调趋势,这与陈良志等[30]研究结果类似;MMP-2 的分泌活性与MMP-9 相当,且二者活性在48 h 显著升高,这与缪增强等[31]的研究结果类似;在体内,活性MMP-2、MMP-9 才具有水解胶原及其他基质的作用,有研究[32]证明,在恶性肿瘤中MMP-2 的表达高于良性肿瘤,这种差异是由于活性MMP-2 表达不同引起的。在本试验中,MMP-2 分泌活性与MMP-2 蛋白表达呈现相同趋势,MMP-9 表达前期也与分泌活性相同,与该研究结果类似。PCL 兔膝后交叉韧带(PCL)损伤后,存在炎症细胞因子介导的MMPs 过表达,持续高表达的炎症细胞因子引发MMPs 活性增加后,损伤的关节软骨等组织将被降解,最终难以自我修复[33]。
但在本研究中,MMP-2 呈上升下降再上升的趋势,MMP-9 也随着时间的延长呈下降趋势,下降趋势可能与细胞因子的表达有关,也可能与S.agalactiae引发的不同诱导机制有关;在肺脏纤维化的相关研究中,MMP-9 减少可以减轻纤维化,此过程依赖于TGF-β1 的活性[34],说明在本研究中,热灭活的S.agalactiae诱导BMFB 分泌MMP-2、MMP-9 来降解ECM,可能抑制纤维化进程,同时MMPs也可能受到其他因素影响而降低表达。TIMPs 作为MMPs 的主要抑制因子,对MMPs 有很强抑制作用,可与MMPs 形成复合物以抑制其活性[26]。其中TIMP-1 能特异性抑制MMP-9,TIMP-2 能特异性抑制MMP-2,越来越多证据表明TIMP-2 具有双重调节功能,在MMP-2 的激活和抑制中均起作用[35]。MMP-9 与TIMP-1 在纤维化中关系密切。
李圣青等[36]研究发现,MMPs/TIMPs 比例失衡可能会加速肺纤维化进程,在肺纤维化后期,MMP-9 表达下降,而TIMP-1 表达上升,肺部成纤维细胞增生增多,局部发生肺实变。尽管TIMPs可以抑制MMPs 降解ECM,但在博来霉素模型中敲除TIMP-1 并不影响肺纤维化发生进程,敲除TIMP-2 基因小鼠肺纤维化程度与野生型小鼠相似[37];也有研究[38]发现,在博来霉素大鼠模型中,肺纤维化发生时,TIMP-1 表达呈现升高趋势,MMP-9 则呈下降趋势,MMP-9/TIMP-1 表达失衡,肺纤维化加重;在MCD 饮食诱导的非酒精性脂肪性肝纤维化模型中,TIMP-1 和MMP-9 表达呈相反趋势,说明TIMP-1 可以抑制MMP-9 表达[39];在TGF-β1 转基因小鼠中,TIMPs 表达上调,MMP-9 降低,MMPs/TIMPs 比例失衡导致肺纤维化[40]。
本研究中,TIMP-1 蛋白水平与对照组相比主要呈先下降后上升趋势,MMP-9 蛋白水平主要呈先升高后下降趋势,MMP-2 蛋白呈先升高后降低再升高趋势,而TIMP-2 则呈现先下降后上升趋势;MMPs 和TIMPs 呈相反趋势,在前期一直维持动态平衡,随着作用时间增长TIMP-1、TIMP-2表现出一定上升趋势,对MMPs 表现出抑制作用,MMP/TIMP 失衡,提示此时纤维化加重,与相关报道结果类似。也有研究[41]发现,早期肺纤维化模型中MMP-9 表达增加,而TIMP-2 水平较低,随着时间延长,MMP-9 表达下降,TIMP-2 表达上升,导致肺纤维化。本研究早期MMP-9 上升,TIMP-2 表达不明显,而后期TIMP-2 表达逐渐上升后,MMP-9 下降,与该研究结果一致。
有研究[42]表明,炎症初期MMP-19 表达增强而MMP-28 表达减弱,TIMP-1 和TIMP-2 转录水平升高,但TIMP-3 和TIMP-4 转录水平降低,说明炎症反应初期纤维化相关因子存在双向改变,MMPs 表达又受炎症细胞因子、细胞转化因子、生长因子和激素等调节。这可能是引起本试验MMPs 活性上升但蛋白表达量下降的原因,提示S.agalactiae可能通过激活MMPs/TIMPs 共同调控ECM 的降解与维持动态平衡;并可能存在某一种或多种MMPs/TIMPs 在S.agalactiae诱导乳腺纤维化过程中起促进纤维化或抑制纤维化作用。
本课题组前期研究表明,外源性细胞因子也可以促进ECM 蛋白表达[43];在肝纤维化模型中对PAI-1、TIMP-1 适当抑制可以使uPA 及MMPs活性有所提高,逆转肝纤维化和肝硬化发展进程[44];有研究发现,PAI-1基因缺失可以延缓纤维化进程[45];肺成纤维细胞中uPA 表达上调,而PAI-1 呈下降趋势[46];然而,氯化汞引起的肾小管间质纤维化中,PAI-1 表达不断增加,而uPA 的表达并没有增加[47],说明不同器官纤维化时uPA 系统的表达存在差异,这可能与不同的诱导机制有关。此外,在博来霉素肺纤维化模型中,经外源性uPA 刺激,TIMP-1 表达会减少,说明uPA 可以通过抑制TIMP-1,从而减轻肺纤维化程度[38];CCL4 诱导小鼠肝脏纤维化模型中证明,Smad7 和uPA 的过表达显著抑制了α-SMA 和TGF-β1 的表达[34]。本研究发现,在S.agalactiae作用48 h 后,TIMP-1 表达升高,而uPA 下降,与相关报道[38]研究结果类似,由此推测,在乳腺纤维化过程中uPA 系统不仅仅发挥调控MMPs 的作用,还可以抑制TIMPs,并与细胞因子相互联系共同调控乳腺纤维化发展。
有研究[6]证明,在肝纤维化中纤溶系统通过uPA-纤溶酶-MMPs-ECM 级联机制促进ECM 降解,但关于uPA 系统参与奶牛乳腺纤维化调控的研究报道很少,MMPs/TIMPs 及uPA 系统作为调控ECM 分解代谢的主要酶系,其在乳腺纤维化中的作用也尚未做过系统研究。本试验为明确MMPs/TIMPs 及uPA 系统对奶牛乳腺纤维化的影响奠定了基础,为进一步的研究提供了相关依据。

