Gustave Roussy Immune评分评估不可切除食管鳞状细胞癌患者预后的价值
曾玉婷 孙新臣
食管癌(esophageal carcinoma,EC)是发病率和致死率较高的恶性肿瘤[1]。同步放化疗(concurrent chemoradiotherapy,CCRT)是不可切除EC的标准治疗手段,部分患者接受CCRT后可获得长期生存,但也有部分患者1年内复发[1⁃2]。预后的异质性提示对患者进行风险评估并寻找可靠的评估指标尤为重要。系统性炎症反应被证实与肿瘤疗效和生存相关[3],炎症指标及其衍生参数,例如中性粒细胞计数/淋巴细胞计数比值(neutrophil/lymphocyte ratio,NLR)、淋巴细胞计数/单核细胞计数比值(lymphocyte/monocyte ratio,LMR)等已被作为评估肿瘤患者生存预后指标[4⁃5]。营养状况[6]、乳酸脱氢酶(lactate dehydroge⁃nase,LDH)等[7]也被报道与肿瘤进展、侵袭和转移相关,可用于评估肿瘤患者预后。BIGOT等[8]基于LDH、NLR和血清白蛋白(albumin,ALB)3个指标构建Gustave Roussy Immune评分(GRIm⁃Score),用于筛选计划行免疫治疗的进展期肿瘤患者。随后GRIm⁃Score在肺癌、可切除食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)患者的预后评估中也被证实具有临床指导意义[9⁃10]。但GRIm⁃Score在不可切除ESCC预后评估中的价值尚不清楚,基于ESCC预后的异质性,本研究旨在探讨放化疗前GRIm⁃Score评估不可切除ESCC患者预后的效能。
1 资料与方法
1.1 研究对象
选择2013年1月至2018年6月于本院接受CCRT治疗的ESCC患者为研究对象。纳入标准:⑴经临床和影像学评估为不可切除的局部晚期ESCC,或具有手术禁忌证;⑵接受针对性CCRT且未接受新辅助治疗;⑶首次放疗前1周内进行血常规及生化检查;⑷ZPS(Zubrod⁃ECOG⁃WHO performance status)评分0~2分;⑸年龄18~80岁。排除标准:⑴合并其他恶性肿瘤者;⑵存在放化疗相关禁忌证者;⑶临床和随访资料不完整者。本研究经本院伦理审查委员会批准,所有患者均签署知情同意书。
1.2 治疗方案
所有患者均采用6⁃MV X线直线加速器照射,总剂量60~66 Gy(2.0 Gy/次,5次/周);2个周期同步化疗,具体方案:RP方案(雷替曲塞2.5 mg/m2d1+顺铂25 mg/m2,d1~3),TP方案(多西紫杉醇 60 mg/m2+顺铂25 mg/m2,d1~3)。其中25例患者因不可耐受化疗相关毒副作用,仅接受1个周期同步化疗;69例患者完成CCRT治疗计划后接受了2~4个周期巩固化疗,方案包括RP方案、TP方案。
1.3 GRIm⁃Score定义
2017年BIGOT等[8]首次提出GRIm⁃Score,评分标准:⑴LDH赋值:正常值范围内计为0分,大于正常值上限(ULN)计为1分;⑵ALB赋值:≥35 g/L计为0分,<35 g/L计为1分;⑶NLR赋值:≤6计为0分,>6:计为1分;总分≤1分为低组,>1分为高组。考虑不同病种、不同研究中心检验试剂和检测方法的差异性及NLR临界值的波动性较大等因素,并结合既往相关研究的截断值计算方法[11],本研究采用受试者工作特征(ROC)曲线计算首次放疗前1周内LDH、ALB、NLR的最佳截断值(ALB:37.5 g/L,LDH:186.5 U/L,NLR:2.445),构建改良后的GRIm⁃Score(modified GRIm⁃Score,mGRIm⁃Score),评分标准:⑴LDH赋值:≤186.5 U/L计为0分,>186.5 U/L计为1分;⑵ALB赋值:≥37.5 g/L计为0分,<37.5 g/L计为1分;⑶NLR赋值:≤2.445计为0分,>2.445:计为1分;总分≤1分为低mGRIm⁃Score组,>1分为高mGRIm⁃Score组。
1.4 随访
以门诊复诊或电话进行随访,结束放化疗后2年内,每隔3个月对患者随访1次,之后每隔6个月进行1次随访,随访截至2020年6月。随访内容包括实验室检查(血常规、生化检查、血清肿瘤标志物)、上消化道造影及颈部、胸部、腹部增强CT扫描。中位随访时间为27.5个月(范围:1.0~81.0个月),期间无失访患者。总生存期(OS)定义为自CCRT至因任何原因死亡的时间;无进展生存期(PFS)为从CCRT至肿瘤发生进展或因任何原因死亡的时间。
1.5 统计学方法
采用SPSS 22.0软件、Medcalc 12.7软件进行统计学分析。采用χ2检验或Fisher确切概率法比较患者基线数据间的差异,采用Kaplan⁃Meier生存分析绘制生存曲线,log⁃rank检验分析曲线间的差异。使用Cox比例风险回归模型对可能与生存预后相关的变量进行单因素和多因素分。ROC曲线分析:将各指标的具体数值作为预测变量,OS中的“死亡”作为结局变量,最大约登指数对应的指标具体值即为最佳截断值,用ROC曲线下面积(AUC)评估预测效能,Z检验比较各指标AUC间的差异。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
根据纳入排除标准,共纳入150例患者进行分析,其中男性125例(83.3%)、女性25例(16.7%),确诊时的中位年龄为65岁(范围:37~79岁);病灶原发部位占比:上段食管(颈+胸上段)占48.0%(72/150),中段食管(胸中段)占28.0%(42/150),下段食管(胸下+腹段)占24.0%(36/150);食管原发灶长度中位数为6 cm;根据第八版AJCC临床TNM分期[12],Ⅱ期、Ⅲ期和ⅣA期的患者占比分别为16.7%(25/150)、2.7%(4/150)、80.6%(121/150)。
2.2 mGRIm⁃Score与临床病理特征的关系
mGRIm⁃Score与ESCC患者肿瘤复发转移率有关(P=0.012),高组较低组复发转移率更高,与性别、年龄、病灶长度、病灶原发部位、TNM分期等未见明显相关性(均P>0.05),见表1。
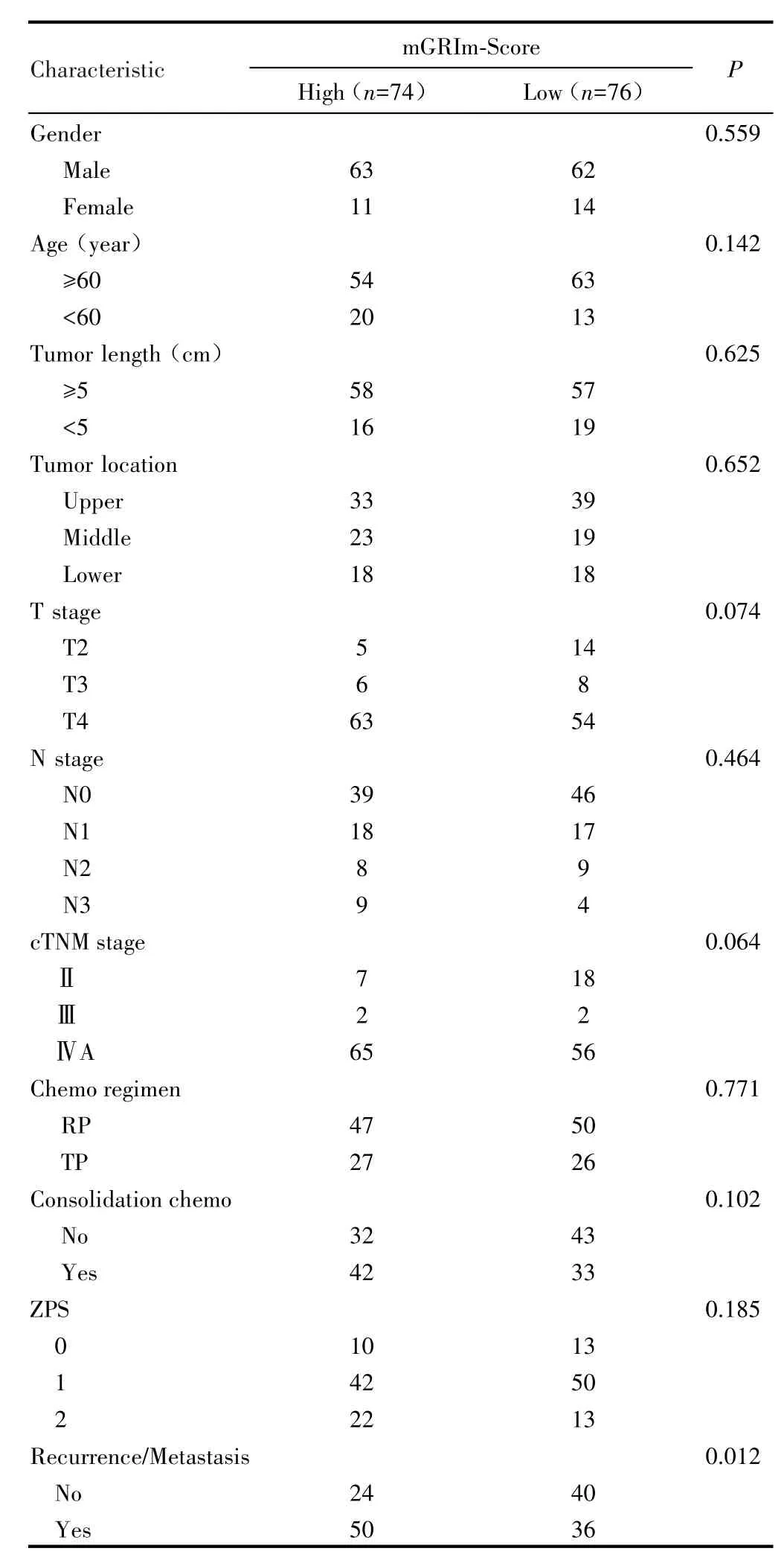
表1 mGRIm‐Score与ESCC患者临床病理特征的关系Tab.1 Relationship between mGRIm‐Score and clinical character‐istics of ESCC patients
2.3 生存分析
高 mGRIm⁃Score组和低 mGRIm⁃Score组患者的mOS分别为17.0个月(95%CI:9.6~24.4个月)和48.0个月(95%CI:38.9~57.1个月),差异有统计学意义(P=0.002);1年OS率分别为57.5% 和76.7%,3年分别为32.7%和55.8%,见图1A。高mGRIm⁃Score组和低mGRIm⁃Score组患者mPFS分别为12.0个月(95%CI:9.5~14.5个月)和 25.0个月(95%CI:15.7~52.4个月),差异有统计学意义(P=0.005);1年PFS率分别为45.2%和67.5%,3年分别为28.5%和47.8%,见图1B。根据ALB、LDH和NLR截断值将患者分组 ,结果显示 ALB<37.5 g/L、LDH>186.5 U/L 和NLR>2.445患者的OS更差(均P<0.05),见图2。
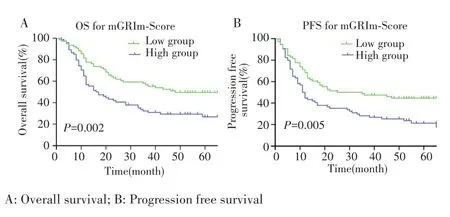
图1 高mGRIm‐Score和低mGRIm‐Score患者的生存曲线Fig.1 Survival curves of patients with high and low mGRIm‐Score
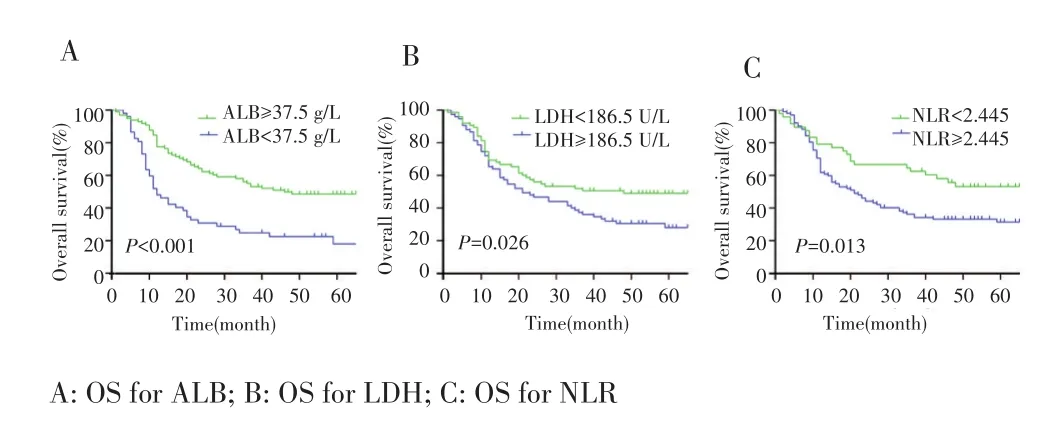
图2 根据ALB、LDH和NLR分组绘制Kaplan‐Meier生存曲线图Fig.2 Kaplan‐Meier survival curves for patients grouped by ALB,LDH and NLR
2.4 单因素和多因素分析
单因素Cox回归显示,T4期、N+期、ⅣA期、ZPS为2、mGRIm⁃Score高组、LDH>186.5 U/L、ALB<37.5 g/L和NLR>2.445均与较差的OS相关;多因素Cox分析结果显示,T4期、N+期、mGRIm⁃Score高组是影响OS独立危险因素,见表2。多因素Cox回归结果显示,T4期、N+期、mGRIm⁃Score高组是影响PFS的独立危险因素,见表3。
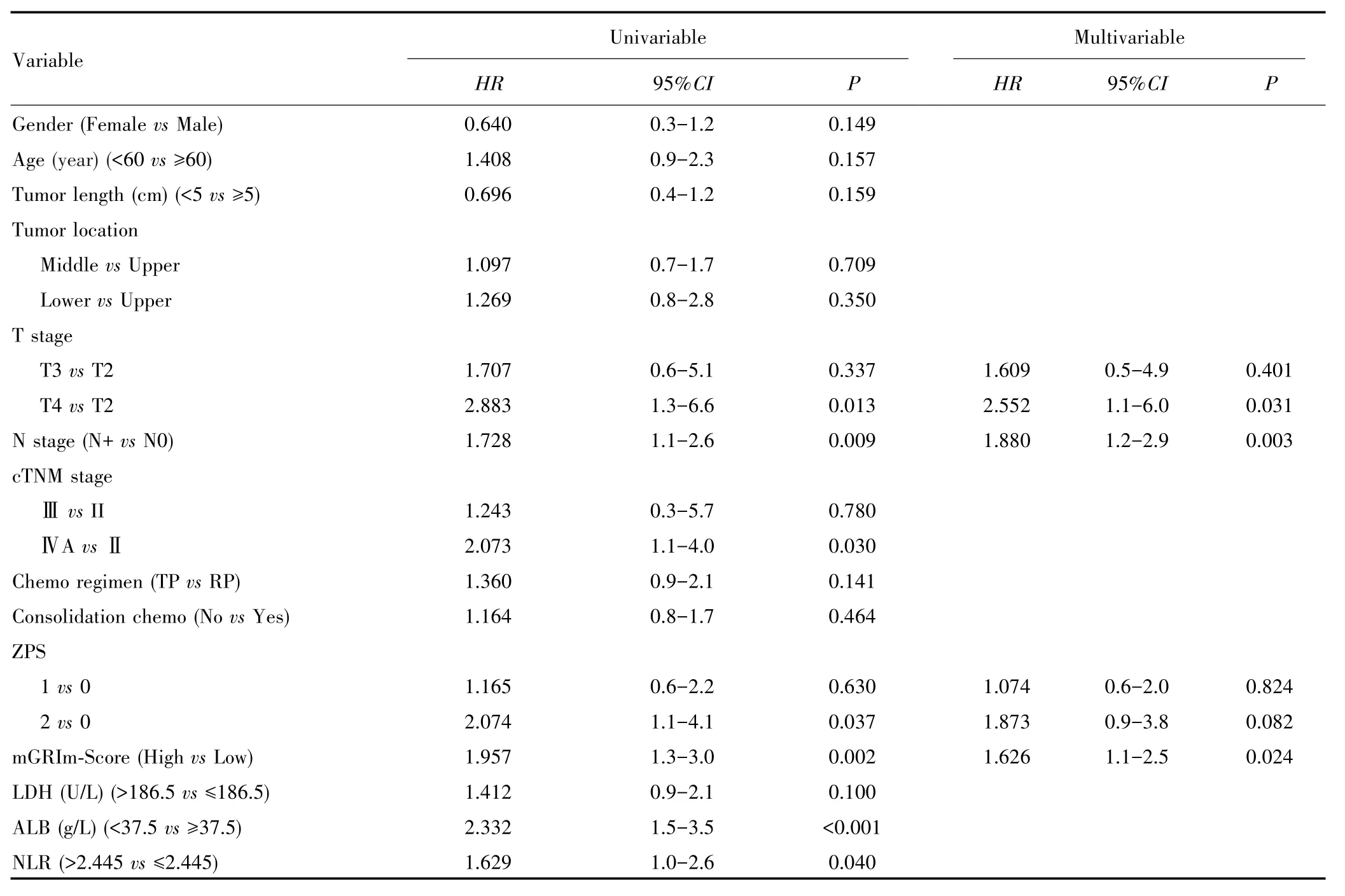
表2 影响OS的单因素和多因素Cox回归分析Tab.2 Univariable and multivariable Cox regression analysis of OS
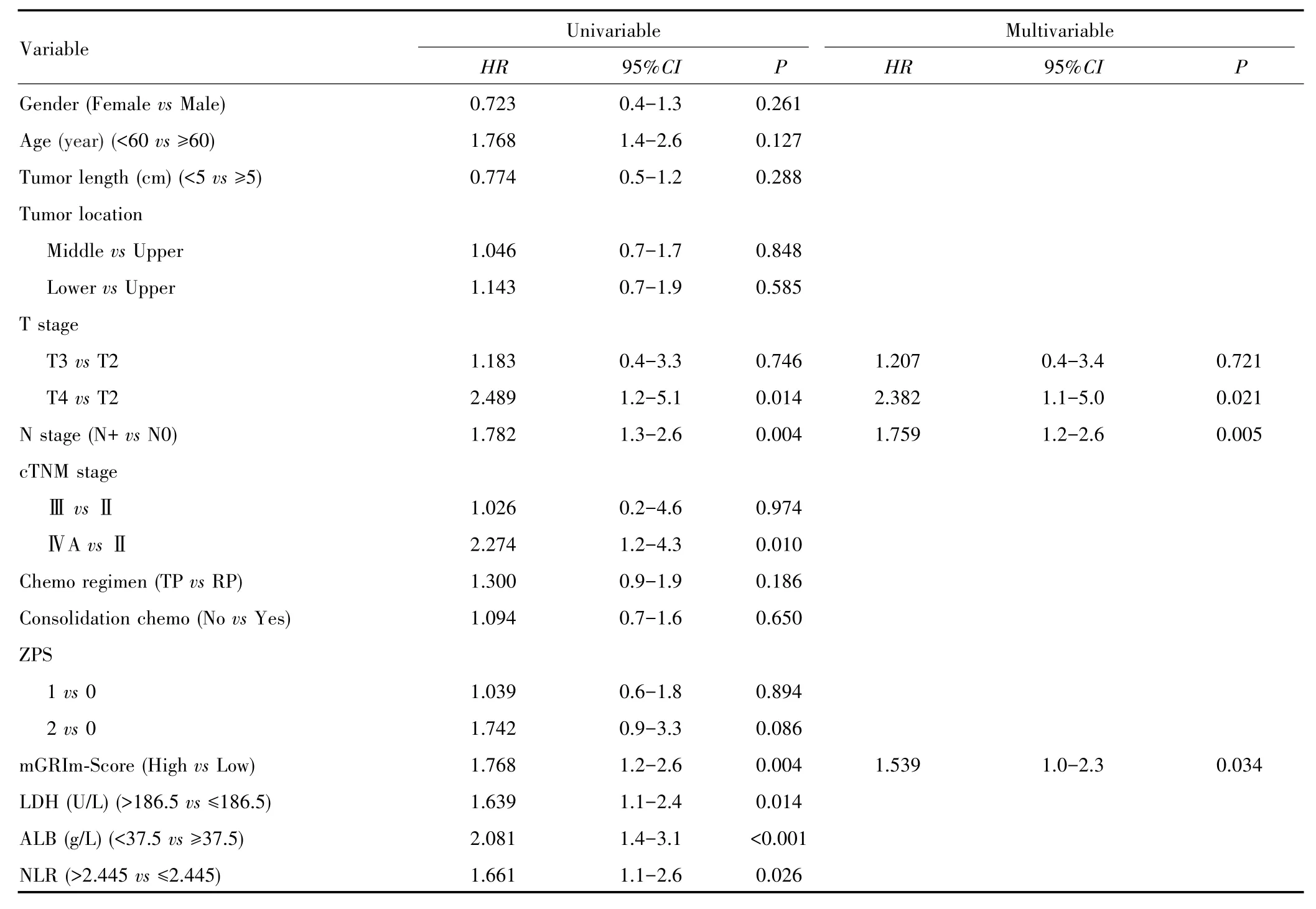
表3 影响PFS的单因素和多因素Cox回归分析Tab.3 Univariable and multivariable Cox regression analysis of PFS
2.5 ROC曲线分析
以死亡为因变量进行ROC曲线分析,结果显示mGRIm⁃Score、LDH、ALB和 NLR 的敏感度分别为0.585、0.585、0.447 和 0.766;特异度分别为 0.661、0.643、0.821和0.464;AUC分别为0.618、0.605、0.634和0.610(均P<0.05),但各指标的AUC差异无统计意义(均P>0.05),见图3。
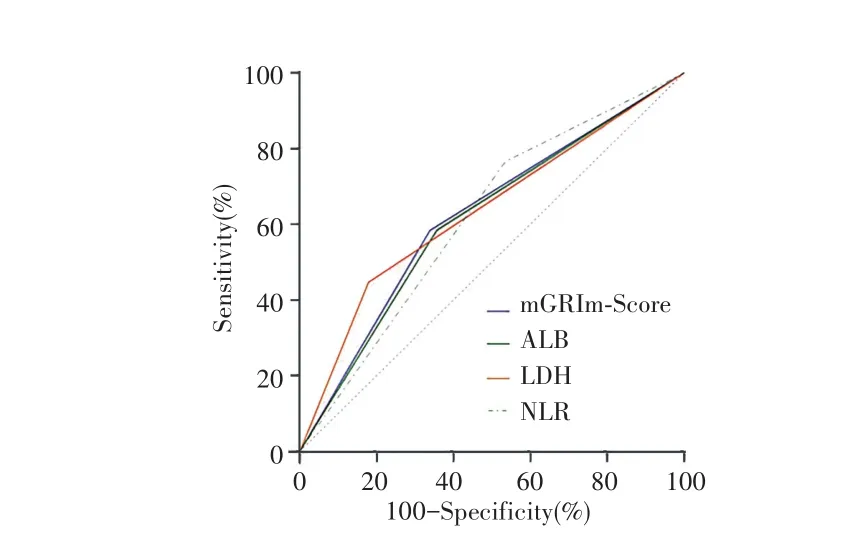
图3 mGRIm‐Score、LDH、ALB及NLR的ROC曲线Fig.3 ROC curves for the mGRIm‐Score,LDH,ALB,and NLR
3 讨论
ALB可以反映机体营养状况,伴营养不良或慢性持续炎症反应时,肝脏合成ALB能力下降,血清ALB降低,甚至导致低蛋白血症[13]。ALB还可作为一种抗氧化剂和转运蛋白而影响药物疗效,有研究报道低蛋白血症患者化疗疗效欠佳[14]。目前基于ALB也已构建了营养风险指数(NRI)或预后营养指数(PNI)等评估EC患者预后的指标[15⁃16]。 NLR可间接反映机体的抗肿瘤能力[17]。同样,LDH被认为可能通过乳酸分泌、调节转移相关蛋白以及活性氧(ROS)和激活上皮间质转化(EMT)途径等参与肿瘤发生、侵袭和转移[18]。在食管癌方面,一项纳入6个研究中心的针对进展期EC的前瞻性研究结果显示PS评分、LDH和化疗方案为独立预后因素[19]。亦有研究表明,在ES⁃CC中较高的LDH水平与更差的预后相关[20]。
ALB、LDH和NLR等血液学检查结果在临床工作中均易于获取,但影响因素较多,目前也尚无公认的截断值。关于确定ESCC预后指标截断值的方法,目前主要有ROC曲线计算法、X⁃tile软件分析法、Cut⁃off Finder Application(截断值应用程序)、SAS软件计算法或根据计算中位数取值以及使用研究单位规定的指标正常值范围等[11,20⁃25]。在 ESCC 相关研究中,NLR、LDH和ALB的截断值取值范围分别介于1.89~6.4[11,21,23,26],133.5~361[20,22,24],35~45[22,25,27],从 这一结果可以看出血液学指标波动性较大,但这些研究多以可切除的早期ESCC为主。LI等[26]研究以接受针对性CCRT的局部晚期ESCC患者为研究对象,结果显示治疗前NLR(截断值=2.64)是判断生存的独立预后因素。DAI等[21]研究也发现类似结果,即治疗前NLR(截断值=2.1)与行针对性放化疗的ESCC患者生存相关。本研究采用ROC曲线分析法,NLR,LDH和ALB的截断值取值均在以上研究取值范围内,且发现放化疗前高mGRIm⁃Score患者的OS和PFS均低于低mGRIm⁃Score患者,经多因素Cox回归分析发现mGRIm⁃Score是预测OS和PFS的独立预后因素。虽然评估预测效能时,mGRIm⁃Score的AUC与ALB、LDH和NLR的AUC无统计学差异,但与单一指标相比,mGRIm⁃Score仍具备一定优势。因此,认为基于免疫炎症反应、肿瘤侵袭性和营养状态相关指标,可对患者进行风险分层,综合评估患者的远期预后。
综上所述,本回顾性研究发现基于CCRT前的LDH、ALB和NLR血液学指标构建的mGRIm⁃Score是预测不可手术ESCC患者OS和PFS的独立预后因素,可作为临床工作评估不可手术ESCC患者预后的综合性指标。然而,非常规的截段值可能限制了研究结果的可解释性和外推性,期待大样本的前瞻性研究进一步探索mGRIm⁃Score在ESCC患者预后中的应用价值和临床意义。

