应用远红外线(FIR)治疗乳腺癌相关的淋巴水肿的肿瘤安全性研究
徐宏征 张书诺 章一新 李科 闵沛如
乳腺癌相关的上肢淋巴水肿(BCRL)是公认的与乳腺癌手术,包括腋窝淋巴结清扫及术后放疗相关的并发症[1]。乳腺癌前哨淋巴结活检术后淋巴水肿发病率高达4%~10%,乳腺癌腋下淋巴结清除术后淋巴水肿发病率高达9%~41%[2-3]。其发病机制为受影响的组织液(淋巴液)增多,出现慢性炎症,导致纤维脂肪组织增生和沉积,以及不适性水肿[4-5]。乳腺癌术后淋巴水肿的临床症状包括上肢水肿、皮肤弹性差、关节活动受限以及皮肤淋巴管炎(DLA)[6-7]。上肢过多的组织液会导致疼痛和焦虑,影响患者的日常生活和社交,同时粗大的肢体和增加的体重会降低身体功能,导致身体形象紊乱,对生活质量产生显著影响[8]。
目前,BCRL的常规非手术治疗包括运动和仰卧起坐、手法淋巴引流、热疗、间歇气压波疗法、弹力绷带等。尽管这些方法对各临床阶段都有一定的疗效,但仅利用这些保守措施几乎不可能取得显著的症状改善。对于不能或不想接受外科手术的患者来说,这些保守治疗是重要的辅助工具[9-13],不仅可以促进侧支淋巴流动,还能去除多余的脂肪组织来改善淋巴水肿,从而减缓甚至防止原有淋巴水肿的恶化。
远红外辐射(FIR)治疗通过辐射、振动/共振和热效应3种主要生物效应对组织产生影响,其作用方式与热疗相似。辐射光谱的红外区域位于可见光范围的红端之外,波长在0.01~7.5×10-5cm。红外线又分为近红外线、中红外线和远红外线。在构成红外光谱的不同频率中,远红外线对生物体最为有利[14-15]。由于人类有机体的绝大部分是由55%~60%的水组成,而FIR能够与水分子相互作用,引起热反应,从而提高组织温度,扩张血管;并且,远红外线能够穿透4 cm深的组织层,与水和其他有机分子产生共振作用[16]。这些效果使某些特定的病理情况能得到改善,例如改善淋巴水肿、促进微循环和侧支淋巴流动[17]。目前,FIR疗法已经广泛应用于临床,如血管相关疾病[18]、淋巴水肿[12-13,17]。研究表明,FIR能有效减少末端液体量、周径以及DLA的发生次数[18]。但是,目前还没有关于FIR的肿瘤安全性研究。本研究旨在证明FIR治疗BCRL的肿瘤安全性。
1 资料与方法
1.1 临床资料
如表1所示,本研究共纳入2014年4月至2016年4月期间接收的63例女性BCRL患者,均接受过改良根治性乳房切除术、腋下淋巴结清扫术和放化疗。全部患者随机分为两组,分别使用FIR(n=32)和加压绷带法(n=31)进行治疗。
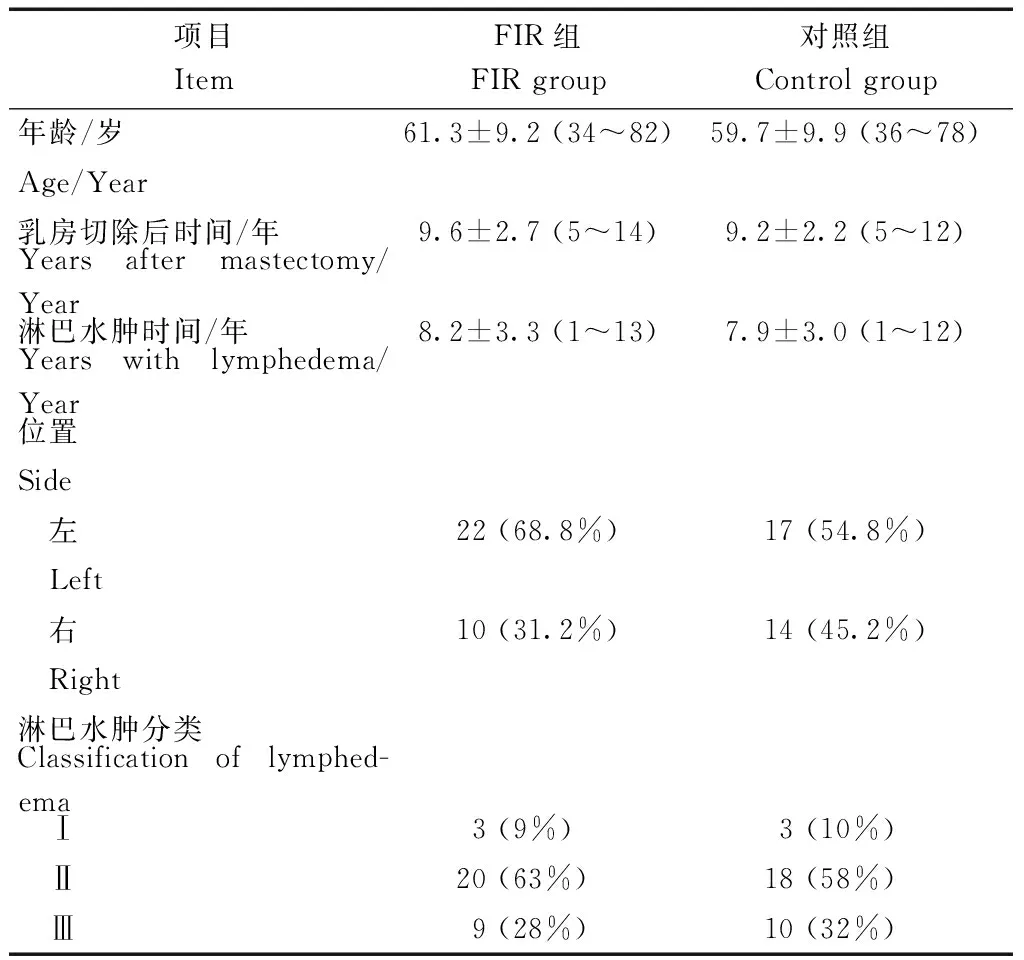
表1 临床资料Table 1 Population demographics
只有乳房切除术后5年,且出现上肢淋巴水肿超过1年的患者才被纳入研究。有癌症复发可能的患者、有可能干扰常规治疗和随访时有严重并发症的患者被排除在外。此外,发生DLA或血管栓塞的患者以及受影响的肢体太大而不能放置在治疗室的患者也被排除在本研究外(图1)。
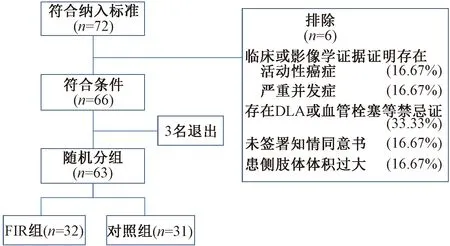
图1 分类图Fig. 1 Consort diagram
1.2 治疗方法
1.2.1 FIR治疗仪
FIR治疗仪由中国上海交通大学附属第九人民医院研发[19],能产生红外辐射的元件被存放在耐高温的不锈钢室内,安装在内环上的8个石英灯能发出6.0~14.0 μm波长的红外线[14]。此外,该设备还配有温度控制装置,可调节不锈钢室内的温度。
1.2.2 FIR治疗方案
本试验纳入的患者开展FIR治疗前均签署书面知情同意书。治疗方式为42 °C下,持续治疗4周(共20 d),每天1 h。并嘱患者注意个人护理,如肢体卫生、预防皮肤损伤以避免发生皮肤真菌病等[19]。
1.2.3 绷带治疗方案
本试验纳入的患者进行压迫绷带治疗前均签署书面知情同意书。患者在每天清醒时用绷带包扎12 h,治疗4周(共20 d)。同样建议患者注意个人护理,同FIR治疗组。
1.2.4 伦理声明
本研究经过上海交通大学医学院附属第九人民医院伦理委员会批准。试验全程遵守所有的相关条例以及《赫尔辛基宣言》的指导方针。
1.2.5 随访观察
治疗后随访1年。随访观察指标:①肿瘤标志物检测。实验室抽取静脉血,检测与乳腺癌相关的肿瘤标志物(CA153和CA125)。正常范围内的结果记录为阴性,高于正常范围的结果为阳性。CA125的正常范围为0~35 U/ml,CA153的正常范围为0~25 U/mL。②超声检查肝、脾、肾、乳腺、腋窝淋巴结、锁骨上和锁骨下淋巴结。如果检查肝、脾、肾或乳腺时发现淋巴结肿大,记录为阳性,反之则为阴性。③不良反应。如治疗过程中有烫伤、局部感染、发热、不适、疼痛等不良反应者为阳性,无不良反应者为阴性。
1.3 体外试验
1.3.1 细胞培养
皮肤二倍体成纤维细胞来源于健康男性捐赠者上臂的2 mm打孔活检标本。人乳腺癌细胞系MCF-7和MDA-MB231购自美国ATCC。常规细胞培养基内添加100 U/mL青霉素、100 mg/mL链霉素、2 mmol/L谷氨酰胺和10%胎牛血清(FBS)。置于37 ℃、5%CO2培养箱中培养。
1.3.2 FIR处理
FIR处理是通过一个释放FIR的装置,发出波长6.0~14.0 μm的光波。将需要照射的细胞(成纤维细胞、MCF-7和MDA-MB231)放入9 cm培养皿中,再置入培养箱中培养(受照组)。细胞与光源的距离为30 cm。用实时温度探测器监测培养箱中的温度,使其保持在37 ℃±0.5 ℃。照射时间为1 h,与本研究临床试验的照射方案相同。未照射的细胞(未受照组)除了不接受FIR处理外,其他条件均与受照组相同。
1.3.3 细胞活力和增殖
将细胞培养在96孔板中,每孔密度为4 000个细胞。受照组用FIR处理,每天1 h,连续7 d,而未受照组放置在同一区域,但不受照射。每天FIR处理后立即使用CCK-8试剂盒评估细胞活力和增殖能力。在试验过程中,细胞在10%CCK-8(Dojindo,日本)中培养。
1.3.4 FACS细胞周期的分析
受照组FIR处理1 h,未受照组不作处理。之后,收集受照组和未受照组的细胞,并将其固定在70%乙醇中,用冰的PBS洗涤2次,重悬,用核糖核酸酶A(50 μg/mL)在37 ℃下孵育30 min,PI(50 μg/mL)染色1 h,最后用流式细胞仪进行分析。每组重复3次。
1.3.5 细胞凋亡的评估
受照组FIR处理1 h,未受照组不作处理。用流式细胞仪对受照组和未受照组的凋亡细胞进行计数。根据说明书,使用Annexin Ⅴ-FITC/PI凋亡检测试剂盒(BD Biosciences,美国)。结果显示,Annexin Ⅴ+/PI-染色的细胞是早期凋亡细胞,而显示Annexin V+/PI+染色的细胞是晚期凋亡细胞。染色后,立即使用BD-FACS Calibur流式细胞仪和细胞检测仪进行分析。每组重复3次。
1.4 统计分析

2 结果
2.1 肿瘤标志物检测
在FIR或压迫绷带治疗1年后,FIR组和对照组的CA125、CA153均在正常范围内。
2.2 超声检测
在FIR或压迫绷带治疗1年后,患者接受了肝脏、脾脏、肾脏、乳腺、腋窝淋巴结、锁骨上淋巴结和锁骨下淋巴结盆的超声检查。FIR组和对照组均未发现淋巴结肿大。
2.3 不良反应
对FIR和加压绷带治疗可能引起的不良反应进行随访调查,如烧伤、局部感染、发热、不适和疼痛等。两组均无不良事件报告。
2.4 体外试验结果
2.4.1 细胞的活力和增殖
评估FIR处理对人原代成纤维细胞和两种不同的人乳腺癌细胞系MDA-MB231和MCF-7的细胞活力和增殖率的影响。FIR处理1 h,每日1次,连续7 d。FIR处理后立即用CCK-8试剂盒检测细胞活力和增殖能力。用细胞生长曲线对CCK-8结果进行分析。结果显示,所有细胞类型中受照组和未受照组之间的细胞活力和增殖能力不存在显著差异(图2)。
2.4.2 细胞周期分析
为了研究FIR处理对细胞周期的影响,我们用流式细胞术对细胞DNA含量进行分析,并在FIR处理后立即测定不同阶段细胞周期的细胞群比例。结果显示,所有细胞类型中受照组和未受照组之间未见显著差异,表明暴露于FIR处理不会影响细胞周期进程(表2)。
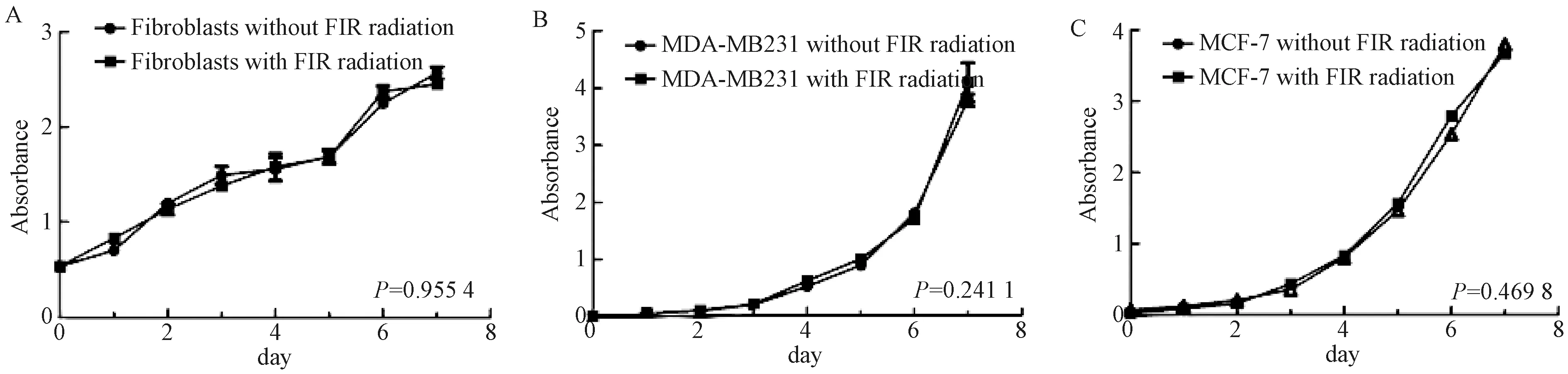
图2 两组成纤维细胞、MBA-MD231细胞和MCF-7细胞的细胞活力和增殖能力Fig. 2 Cell viability and proliferation ability of fibroblasts, MBA-MD231 and MCF-7 cells in the two groups
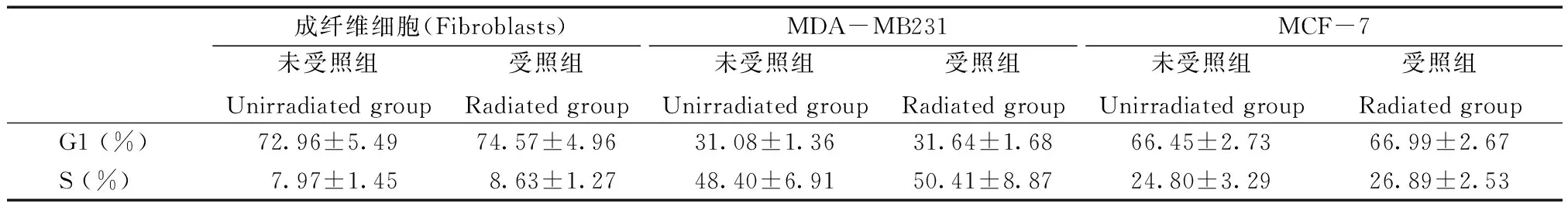
表2 两组成纤维细胞、MBA-MD231细胞和MCF-7细胞的细胞周期分析Table 2 Cell cycle analysis of fibroblasts, MBA-MD231 and MCF-7 cells in the two groups
2.4.3 细胞凋亡评估
通过流式细胞术分析FIR处理对凋亡阈值的影响,并使用Annexin Ⅴ-FITC/PI凋亡检测试剂盒进行评估。结果显示,FIR处理不影响正常成纤维细胞和MCF-7和MDA-MB231细胞的凋亡状态(图3)。

图3 两组成纤维细胞、MBA-MD231细胞和MCF-7细胞的细胞凋亡评估Fig. 3 Apoptosis evaluation of fibroblasts, MBA-MD231 and MCF-7 cells in the two groups
3 讨论
红外辐射是电磁光谱中不可见的部分,波长从750 nm到100 μm,频率从400 THz到3 Hz,光子能量范围为12.4~1.7 MΩ。红外光谱位于可见光谱的长波红边和太赫兹(从3 THz开始)光谱带的短边之间。FIR有3种主要的生物效应:辐射、振动/共振和热效应[18]。在细胞中,辐射和振动促进自由离子的振荡,导致蛋白质等大分子变性,从而增加组织中蛋白质的吸收[14]。热效应可通过扩张血液或淋巴管促进微循环[11-12]。Liu等[12,19-21]发现,局部热疗能激活胰岛细胞、巨噬细胞和内皮细胞,增强免疫功能,促进微循环。活化的巨噬细胞可以水解过多的蛋白质,降低胶体渗透压,促进间质液体回流到淋巴水肿组织的循环系统。有研究证明,局部热疗可以改善微循环,减少慢性炎症,促进组织修复[22-25]。目前,压迫包扎疗法已应用于颈部淋巴结清扫术后淋巴水肿患者,有助于减少淋巴液的积聚[19]。该方法已被证明是治疗乳房切除术后淋巴水肿的一种安全的方法,并被广泛应用。
我们前期的研究表明,FIR治疗能减少水肿肢体的周径和含水量,还会降低DLA的发病率[17,19]。然而,FIR治疗是否会影响乳腺癌复发率,甚至增加其转移风险,目前仍不清楚。患者预后最重要的预测因素是癌细胞的转归,因此目前的研究重点是明确邻近表皮、前哨淋巴结、循环和远处是否存在转移性肿瘤[26-28]。CA125和CA153被认为是乳腺癌复发和转移的特异性生物标志物[29]。其中,CA153是乳腺癌患者的预后、转移和复发的标志[30-32]。众所周知,术前血清中CEA和CA153的水平对乳腺癌的预后有显著影响[33]。在乳腺癌组织中CA125表达上调,但在非肿瘤导管中不表达[34]。在我们的研究中,63例患者在FIR或绷带治疗后,检测了血清中的CA125和CA153,均未发现CA125或CA153。因此,我们认为FIR治疗不太可能引起肿瘤复发或转移。
超声检查是一种简单、廉价、高精度的方法,广泛应用于乳腺癌或转移瘤的早期检测[35-36]。在我们的研究中,经过1年的随访,没有发现用FIR或压迫绷带治疗的患者出现肝、脾、肾或乳腺的病理改变,也没有新证据表明患者出现淋巴结肿大。这似乎进一步证实了FIR治疗BCRL的安全性和可靠性。
在临床随访期间,我们监测了FIR治疗后可能出现的不良反应。没有患者出现烧伤、局部感染、发热、不适或疼痛等治疗肢体的不良反应,表明FIR在BCRL治疗上有良好的耐受性。
尽管大多数乳腺癌患者在进行手术切除、放疗和/或化疗后没有出现临床上可检测到的残留肿瘤迹象,但也可能存在个别残留肿瘤细胞[37-38]。这些肿瘤细胞无法在临床上检测到,可能是因为细胞数量太少或癌细胞处于潜伏期。因此,本研究的目的之一是评估FIR治疗是否能激活乳腺癌术后淋巴水肿患者的残余肿瘤细胞。
体外试验部分,为了模拟FIR治疗期间的体内环境,我们将细胞维持在37 °C±0.5 °C的温度下,每次照射处理后检测MDA-MB231、MCF-7细胞和成纤维细胞的细胞增殖和活力。结果表明,受照组和未受照组之间未发现显著差异(P>0.05),表明FIR不太可能促进乳腺癌细胞的增殖并增加乳腺癌的复发风险。
细胞周期试验结果显示,细胞增殖没有差异(P>0.05),表明FIR不会缩短乳腺癌细胞的细胞周期,进一步证实了FIR治疗不会激活乳腺癌细胞。
Chen等[39]报道FIR照射可减弱培养的角质细胞的细胞凋亡和死亡。在我们的研究中,受照组成纤维细胞、MDA-MB231和MCF-7细胞的凋亡状态与未受照组相同。这提示FIR治疗似乎不能诱导或延缓乳腺癌细胞凋亡。
本研究的局限性在于,所有淋巴水肿的患者都在5年前接受了乳腺切除术,因此这些患者体内残留的乳腺癌细胞可能相对稳定,难以激活。对于乳腺切除术不到5年的患者,FIR治疗是否安全还有待确定。在此研究结果的基础上,还需要进一步的研究来验证FIR对乳腺癌术后早期淋巴水肿治疗的安全性。

