艾拉莫德治疗中轴型脊柱关节炎临床效果观察
白云静 王效影 姚雅娟 徐晓华

【摘要】 目的:探讨艾拉莫德治疗中轴型脊柱关节炎(SpA)的临床效果和安全性。方法:选取2017年1月-2020年1月本院收治的中轴型SpA患者共86例,按照随机数字表法将其分为治疗组和对照组,每组43例。治疗组给予艾拉莫德和塞来昔布治疗,对照组给予柳氮磺吡啶肠溶片和塞来昔布治疗,两组疗程均为12周。比较两组治疗前后的疼痛程度、病情严重程度、炎症指标、骶髂关节骨髓水肿情况及不良反应发生情况。结果:治疗后,两组视觉模拟评分法(visual analogue score,VAS)评分、Bath强直性脊柱炎活动指数(BASDAI)、红细胞沉降率(ESR)、C反应蛋白(CRP)及加拿大脊柱关节研究协会(spondyloarthritis research consortium of canada,SPARCC)评分均低于治疗前,且治疗组均低于对照组(P<0.05)。两组不良反应发生率比较,差异无统计学意义(P>0.05)。结论:艾拉莫德对中轴型SpA的疗效良好,可缓解关节疼痛,改善病情、减轻炎症反应及骶髂关节骨髓水肿,安全性较好,值得临床推广。
【关键词】 艾拉莫德 中轴型脊柱关节炎
[Abstract] Objective: To investigate the clinical efficacy and safety of Iguratimod in the treatment of axial spondyloarthritis (SpA). Method: A total of 86 patients with axial SpA admitted to our hospital from January 2017 to January 2020 were selected and divided into the treatment group and control group according to the random number table method, with 43 patients in each group. The treatment group was treated with Elamud and Celecoxib, while the control group was treated with Salazosulfapyridine Enteric-coated Tablets and Celecoxib, both of which lasted 12 weeks. The pain degree, severity of the disease, inflammatory indicators, bone marrow of tsacroiliac joint edema and adverse reactions before and after treatment were compared between the two groups. Result: After treatment, visual analogue score (VAS), Bath ankylosing spondylitis activity index (BASDAI), erythrocyte sedimentation rate (ESR), C-reactive protein (CRP) and spondyloarthritis research consortium of canada (SPARCC) scores in the two groups were lower than those before treatment, and those of the treatment group were lower than those of the control group (P<0.05). There was no significant difference in the incidence of adverse reactions between the two groups (P>0.05). Conclusion: Iguratimod has a good effect on axial SpA, which can relieve joint pain, improve the condition, reduce inflammatory reaction and bone marrow of sacroiliac joint edema, it is safe and worthy of clinical promotion.
[Key words] Iguratimod Axial spondyloarthritis
脊柱關节炎(spondyloarthritis,SpA)属于炎症性自身免疫性疾病,临床表现以中轴关节肌腱端附着点炎和双侧骶髂关节炎为主,炎性腰背疼痛、僵硬是其主要的临床症状,本病起病隐匿,病程迁延,晚期可逐渐发展至脊柱关节强直畸形[1]。根据主要累及的关节不同,SpA可以分为中轴型和外周型两种,传统改善病情抗风湿药(DMARDs)治疗中轴型SpA效果不确切,生物制剂有效但因价格昂贵以及诸如感染、肿瘤等的不良反应自身限制,很难在临床上广泛应用[2]。艾拉莫德是一种新型小分子靶向改善病情抗风湿药,具有抑制多种致炎因子、抗炎镇痛、改善骨代谢等作用[3-4]。研究表明,其对于类风湿关节炎有很好的疗效[5-6]。也有部分学者尝试将其用于强直性脊柱炎中并取得了初步的疗效,但对中轴型SpA的治疗还缺乏相关的研究[7-8]。笔者尝试对部分治疗效果不佳的中轴型SpA患者给予艾拉莫德治疗后,取得了良好的效果。本研究拟进一步观察艾拉莫德对中轴型SpA的临床疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年1月-2020年1月本院风湿免疫科收治的中轴型SpA患者共86例。纳入标准:符合中国研究型医院学会关节外科学专业委员会制定的中轴型SpA诊断分类标准[9];年龄18~60岁,性别不限。排除标准:合并其他自身免疫性疾病者;合并有严重心、肝、肾以及造血系统疾病或恶性肿瘤患者;过敏体质及对相关试验药物过敏者;妊娠或哺乳期妇女;入组前4周内使用过生物制剂者。采用随机数字表法将患者分为对照组和治疗组,每组43例,所有患者及家属均知情同意并签署知情同意书,本研究已经医院伦理委员会批准。
1.2 方法 对照组给予柳氮磺吡啶肠溶片(生产厂家:上海信谊天平药业有限公司,批准文号:国药准字H31020557,规格:0.25 g)1 g/次,2次/d,口服,塞来昔布胶囊(生产厂家:辉瑞制药有限公司,批准文号:国药准字J20140072,规格:200 mg)200 mg/次,2次/d,口服。治疗组给予艾拉莫德片(生产厂家:先声药业有限公司,批准文号:国药准字H20110084,规格:25 mg)25 mg/次,2次/d,口服;塞来昔布胶囊200 mg/次,2次/d,口服。两组疗程均为12周。
1.3 观察指标与判定标准 (1)比较两组治疗前后疼痛程度。采用视觉模拟评分法(visual analogue score,VAS)评估两组治疗前后的关节疼痛程度,总分0~10分,分值越高,疼痛越严重[10]。(2)比较两组治疗前后的病情严重程度。采用Bath强直性脊柱炎活动指数(BASDAI)进行评分,BASDAI包括疲乏、脊柱疼痛、关节疼痛、肌腱端炎和晨僵持续时间5个项目,每项得分为0~10分,BASDAI=5项得分之和×0.2,分值为0~10分,分数越高说明病情越严重[11]。(3)比较两组治疗前后的炎症指标。采用血沉仪法检测红细胞沉降率(erythrocyte sedimentation rate,ESR),采用比浊法检测C反应蛋白(C-reactive protein,CRP)。(4)比较两组骶髂关节水肿情况。分别于治疗前后行骶髂关节核磁共振(MRI)检查,采用加拿大脊柱关节研究协会(spondyloarthritis research consortium of canada,SPARCC)评分评价两组骶髂关节骨髓水肿情况,总分72分,分数越高骶髂关节骨髓水肿情况越严重[12-13]。(5)比较两组不良反应发生情况,包括皮疹、肝功能异常及胃肠道反应。
1.4 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 治疗组有1例患者在治疗5 d后自行中断治疗,按脱落病例处理,85例完成本次试验。治疗组男33例,女9例;年龄18~48岁,平均(28.52±9.43)岁,病程3~27个月,平均(13.43±7.57)个月;对照组男33例,女10例;年龄19~47岁,平均(27.87±8.05)岁;病程5~29个月,平均(15.04±8.92)个月。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
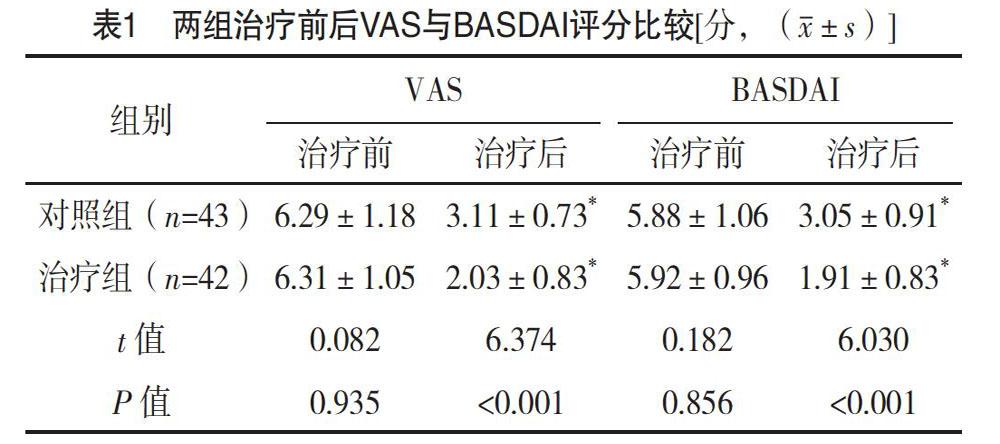
2.2 两组治疗前后VAS与BASDAI评分比较 治疗前,两组VAS与BASDAI评分比较,差异均无统计学意义(P>0.05)。治疗后,两组VAS与BASDAI评分均低于治疗前,且治疗组均低于对照组,差异均有统计学意义(P<0.05)。见表1。
2.3 两组治疗前后ESR、CRP及SPARCC评分比较 治疗前,两组ESR、CRP及SPARCC评分比较,差异均无统计学意义(P>0.05)。治疗后,两组ESR、CRP及SPARCC评分均低于治疗前,且治疗组均低于对照组,差异均有统计学意义(P<0.05)。見表2。
2.4 两组不良反应发生情况比较 两组不良反应发生率比较,差异无统计学意义(字2=0.188 3,P=0.664 4),见表3。
3 讨论
中轴型SpA主要累及骶髂关节和中轴脊柱,临床常有炎性腰背疼痛和僵硬、活动受限,进而逐渐造成结构性和功能性损伤,引起脊柱强直及纤维化,严重影响患者的生活质量。因此,尽早消除炎症,控制或延缓疾病进展是治疗本病的主要目标。传统抗风湿药(DMARDs)可改善SpA患者的外周关节炎病情,但对中轴关节病变的作用尚缺乏证据[14-15]。生物制剂虽有效,但价格较贵,且有增加结核、肿瘤及乙肝感染风险的可能,因我国国情所限难以广泛应用[2]。
SpA发病机制未明,许多学者认为可能与T、B淋巴细胞亚群失衡及肿瘤坏死因子拮抗剂(tumornecrosis factor,TNF-α)、IL-6等多种致炎因子异常表达有关[16-17]。与传统DMARDs相比,艾拉莫德有其独特的作用机制,是一种新型多靶点的小分子抗风湿药物,既具有传统DMARDs药物的免疫抑制作用,能够抑制TNF-α、IL-6等多种致炎因子的表达;同时又可以通过抑制COX-2,进而减轻关节的炎症,起到消肿镇痛的作用[5]。随着多项基础及临床研究的展开,已初步证实艾拉莫德对强直性脊柱炎有一定的疗效,但其对中轴型SpA的疗效仍需进一步探讨[7-8]。
本研究结果显示,治疗后,治疗组VAS评分、BASDAI评分、ESR及CRP均低于对照组(P<0.05)。表明艾拉莫德对于中轴型SpA,可以减轻患者关节疼痛症状、降低炎性指标、消除炎症,控制患者的疾病活动性,其疗效明显优于柳氮磺胺吡啶。分析艾拉莫德对于中轴型SpA有效的可能机制是:通过抑制TNF-α、IL-6等多种致炎因子的生成、降低免疫球蛋白,从而控制了疾病的进展;通过选择性抑制环氧合酶-2(COX-2),起到了抗炎镇痛的目的[18]。另外,核因子(NF)-κB作为炎症反应的关键信号传导因子,是介导许多免疫和炎症反应的中心物质,艾拉莫德可以通过调控NF-κB信号表达,进而抑制NF-κB信号通路的活化,下调TNF-α等细胞因子的水平,从而发挥治疗中轴型SpA的作用[19]。可见,使用艾拉莫德治疗中轴型SpA是合理可行的。同时本研究结果还显示艾拉莫德在观察期间无严重不良反应,安全性较好,值得临床进一步推广应用。
SpA首发的病理改变以骶髂关节为主,随后逐渐累及整个中轴关节,骶髂关节疼痛贯穿脊柱关节炎的始终。临床有许多患者ESR和CRP等血清学炎性活动指标正常,但骶髂关节疼痛明显,此时往往核磁会显示有骨髓水肿,说明核磁检查更能准确客观反映骶髂关节的炎性病变,在评价临床疗效时常用骶髂关节核磁作为评价疗效的客观指标。核磁对骨髓水肿分辨力较高,能够准确反映炎症,并能够对炎症病变进行量化分级,能够准确判断骶髂关节的炎性病变程度。因此,对于骶髂关节核磁的SPARCC评分就成为评估骶髂关节骨髓水肿的重要指标[20]。本研究结果显示,治疗后,对照组SPARCC评分低于治疗前(P<0.05),说明柳氮磺吡啶联合塞来昔布治疗有效,尤其是塞来昔布对缓解SpA炎症、减轻骨髓水肿有一定的疗效,柳氮磺吡啶对于控制疾病的进展也有疗效;但是治疗组治疗后SPARCC评分优于对照组(P<0.05),提示艾拉莫德联合塞来昔布在减轻骨髓水肿方面更具优势,艾拉莫德既有抑制COX-2的抗炎镇痛作用,又有抑制多种炎症因子的免疫抑制作用,从而在消除骶髂关节骨髓水肿方面作用突出。
综上所述,艾拉莫德治疗中轴型SpA,起效较快,短期内可以有效减轻患者关节疼痛症状、缓解炎症,消除骶髂关节骨髓水肿,疗效确切,安全性较高,通过本研究,为临床治疗中轴型SpA提供了新的治疗选择。
参考文献
[1] Macfarlane T V,Abbood H M,Pathan E,et al.Relationship between diet and ankylosing spondylitis:A systematic review[J].Eur J Rheumatol,2018,5(1):45-52.
[2]周林光,江濱.用于强直性脊柱炎的抗肿瘤坏死因子(TNF-α)抑制剂的临床应用进展[J].中国药学,2018,27(1):59-63.
[3] Mimori T,Harigai M,Atsumi T,et al.Safety and effectiveness of 24week treatment with iguratimod,a new oral disease-modifying antirheumatic drug,for patients with rheumatoid arthritis:interim analysis of a post-marketing surveillance study of 2679 patients in Japan[J].Mod Rheumatol,2017,27(5):755-765.
[4]刘丹,陈妤,丁汉飞,等.艾拉莫德(T-614)在类风湿关节炎基础实验与临床疗效的研究进展[J].中国新药杂志,2013,22(9):1052-1055.
[5]尚可,姜丽丽,王友莲.艾拉莫德片单药治疗活动性类风湿关节炎的疗效及其对骨代谢的影响[J].江西医药,2019,54(6):593-595,619.
[6]李学荣,张榜硕,陈永平.艾拉莫德联合依那西普治疗难治性类风湿性关节炎的临床疗效研究[J].安徽医药,2019,23(8):1674-1677.
[7]徐卫东.中轴型脊柱关节炎诊断和治疗的专家共识(2019年版)[J].中华关节外科杂志,2019,13(3):261-266.
[8]路峰.ASDAS、RAPID3及BASDAI病情活动性指标判断强直性脊柱炎患者活动度效果比较研究[J].中国实用医药,2017,12(32):68-69.
[9] de Andrade K R,de Castro G R,Vicente G,et al.Evaluation of circulating levels of inflammatory and bone formation markers in axial spondyloarthritis[J].Int Immunopharmacol,2014,21(2):481-486.
[10]来东升.磁共振成像SPARCC评分在强直性脊柱炎中的临床应用[J].全科医学临床与教育,2014,12(3):269-270,279.
[11]文政,陆伟,龚春柱,等.补肾强督法联合西药对强直性脊柱炎骶髂关节骨髓水肿及关节功能状态的影响[J].颈腰痛杂志,2019,40(5):639-641,644.
[12] Allouch H,Shousha M,B?hm H.Surgical management of ankylosingspondylitis(Bechterews disease)[J].Zeitschrift Fur Rheumatologie,2017,76(10):848-859.
[13]杜志峰,李振彬.强直性脊柱炎疾病活动相关细胞因子分析[J].河北医学,2019,25(11):1929-1932.
[14]陈俊岚,周时高.强直性脊柱炎相关细胞因子的研究进展[J].江西中医药,2019,50(439):64-68.
[15].高焱,李勇锋.益赛普与传统DMARDs药物治疗早期强直性脊柱炎的短期对比观察[J].中国医学创新,2015,12(22):12-14.
[16]林玉萍,刘红,高锦团.艾拉莫德治疗强直性脊柱炎的初步观察[J].临床合理用药,2019,12(5):9-13.
[17]许百洁,莫守崎,薛晓倩,等.艾拉莫德治疗强直性脊柱炎的疗效和安全性研究[J].新医学,2019,50(12):915-918.
[18]黄帮君,马进兴.艾拉莫德治疗强直性脊柱炎短期疗效观察[J].中国社区医师,2018,34(13):92-93.
[19]黄颖,姚血明,马武开,等.艾拉莫德对II型胶原诱导性关节炎大鼠关节滑膜细胞核因子-κB信号的影响[J].中国老年学杂志,2017,37(20):4964-4966.
[20]杨阳,沈逸,程鹏,等.全脊柱加骶髂关节SPARCC评分对益赛普治疗强直性脊柱炎疗效的评估与预测价值[J].中国医学计算机成像杂志,2020,26(1):55-59.
(收稿日期:2020-08-19) (本文编辑:田婧)

