超高效液相色谱-串联质谱法测定 硝磺草酮在稻田中的残留
郭明程,聂东兴,汤 涛,李贤宾
(1.农业农村部农药检定所,北京 100125;2.浙江省农业科学院农产品质量标准研究所,浙江杭州 310021)
硝磺草酮(mesotrione),化学名称为2-(4-甲磺酰基-2-硝基苯甲酰基)环己烷-1,3-二酮,是一种三酮类羟基苯基丙酮酸酯双氧化酶(HPPD)抑制剂类芽前、苗后除草剂,可用于大多阔叶草和一些禾本科杂草[1-2]的有效防治,特别是对稻田低龄稗草和对磺酰脲类除草剂产生抗性的阔叶杂草及莎草等有效。目前已有多个产品在我国水稻上取得登记,广泛应用于移栽水稻田防治一年生杂草[3-4]。然而,硝磺草酮在稻田中残留检测方法却少有报道[5]。
本研究开发了利用超高效液相色谱-串联质谱法测定硝磺草酮在糙米、谷壳、植株、土壤和稻田水中残留的分析方法。该方法快速、简便,重现性好,适用于硝磺草酮在大量样品中的残留检测。
1 材料与方法
1.1 仪器与试剂
UPLC-XEVO TQ/MS超高效液相色谱-串联质谱联用仪(美国Waters公司);AB135-S电子天平(精确至0.0001 g,梅特勒-托利多公司);SPS402F 电子天平(精确至0.01 g,奥豪斯公司);VTX-3000L涡旋仪(杭州雷琪试验器材公司);TYZD-IIA振荡器(天仪电子仪器有限公司);R-210旋转蒸发仪(瑞士Buchi公司);V-700真空泵(瑞士Buchi公司)。
硝磺草酮标准品(纯度99.0%,Dr.Ehrenstorfer公司);乙腈和甲醇(色谱纯,德国Merck);甲酸(色谱纯,上海凌峰化学试剂有限公司);氯化钠、石油醚、乙酸乙酯和1,2-丙二醇(分析纯,国药集团化学试剂有限公司);Wondasep HLB固相萃取小柱(500 mg/6 mL,岛津(上海)实验器材有限公司);试验用水都为用Milli-Q超纯水器纯化处理得到的超纯水。
1.2 样品前处理
1.2.1 提取
糙米、土壤:称取糙米10 g、水稻田土壤20 g(精确到0.01 g,下同),分别置于具塞三角烧瓶中,加入10 mL水,30 mL乙腈振荡提取30 min,经布氏漏斗减压抽滤,滤液转入装有10 g氯化钠的100 mL具塞量筒中。滤渣加入10 mL水,30 mL乙腈继续振荡提取30 min,同样条件下抽滤,合并滤液,充分摇匀1 min,静置15 min,取上清液30 mL到250 mL平底烧瓶中,加3~4滴1,2-丙二醇,在40 ℃水浴条件下浓缩近干,待净化。
谷壳、植株:称取谷壳、植株样品各5 g,放入250 mL锥形瓶中,加入20 mL水,70 mL乙腈振荡提取30 min,经布氏漏斗减压抽滤,滤液转入装有10 g氯化钠的100 mL具塞量筒中,充分摇匀1 min,静置15 min,取上清液35 mL到250 mL平底烧瓶中,加5~6滴1,2-丙二醇,在40 ℃水浴条件下浓缩近干,待净化。
稻田水:量取过滤后的稻田水100 mL于500 mL分液漏斗中,先后分别加入30 mL乙酸乙酯萃取2次,收集乙酸乙酯相,在旋转蒸发器上减压浓缩至干,加3~4滴1,2-丙二醇,在40 ℃水浴条件下浓缩近干,待净化。
1.2.2 净化
Wondasep HLB小柱(500 mg,6 mL),依次用10 mL甲醇、10 mL去离子水溶液平衡活化小柱。用5 mL石油醚/乙酸乙酯(95/5,体积比)将以上提取物转入小柱,用石油醚/乙酸乙酯(95/5,体积比) 5 mL、水1 mL淋洗,弃去淋出液,用乙腈/水(20/80,体积比)10 mL洗脱,收集洗脱液于平底烧瓶中,40 ℃水浴条件下减压浓缩干,用甲醇定容至10 mL过0.22 μm滤膜,待测。对于高浓度添加水平(糙米1.0 mg/kg、谷壳2.0 mg/kg、植株2.0 mg/kg、土壤0.5 mg/kg、稻田水0.1 mg/L)处理,过滤膜后用色谱甲醇稀释10倍再测定。
1.3 仪器检测条件
1.3.1 色谱条件
流动相:乙腈和0.1%甲酸水;色谱柱:waters acquity UPLCTM BEH C18(1.7 μm,2.1 mm×50 mm);流速为0.20 mL/min;柱温:40 ℃;进样量:1.0 μL;保留时间:约2.91 min;采用梯度洗脱,洗脱条件见表1。
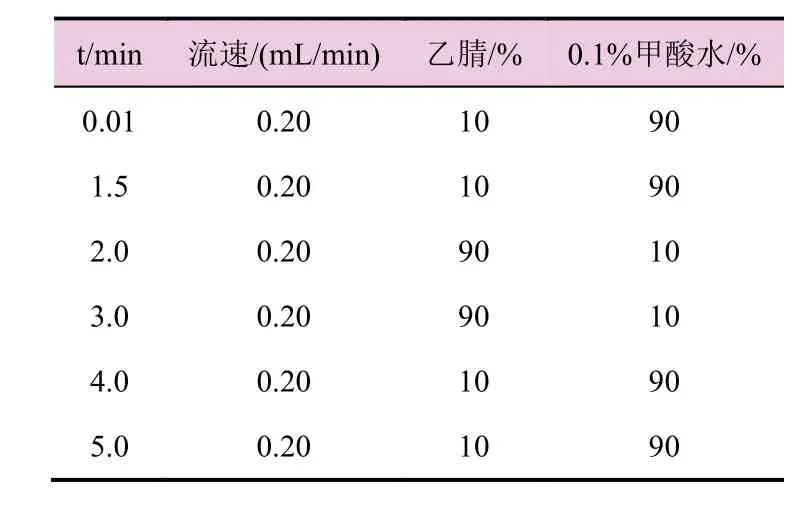
表1 液相色谱梯度洗脱条件
1.3.2 质谱仪器条件
离子源:正离子(ESI+);毛细管电压:3.5 kV;脱溶剂气流量:800 L/h;一级锥孔电压:40 V;脱溶剂温度:400℃;硝磺草酮定量定性离子对:m/z340.1(228.1*,104)。
1.4 标准曲线制作
用甲醇溶液配制0.005、0.010、0.020、0.050、0.10、0.20 mg/L的硝磺草酮标准溶液,在上述仪器检测条件下进行测定,以定量离子峰面积与硝磺草酮标准溶液浓度作标准曲线。
1.5 添加回收率测定
分别在空白稻田水、土壤、糙米、植株和谷壳样品中添加3档不同浓度的硝磺草酮标准溶液,每档添加水平浓度重复5次,用上述检测方法测定添加回收率和相对标准偏差。
2 结果与分析
2.1 质谱条件的选择
在流动相为乙腈和水(10/90,体积比),进样体积为1 μL,流速0.2 mL/min的条件下,将质量浓度为1.0 mg/L硝磺草酮标准溶液,通过蠕动泵进样,分别在电喷雾电离负离子模式(ESI-)和正离子模式(ESI+)下,m/z 100~500范围内对母离子进行全扫描。结果表明,硝磺草酮在ESI+下电离效果最好,信号强度比在ESI-下高,得到了m/z340.1的[M+H]+准分子离子峰。二级质谱扫描[M+H]+准分子离子峰,获得了碎片离子,碎片离子m/z228.1的响应值较高且稳定,故选定m/z228.1为定量离子。
2.2 净化剂的选择
基质中的其他杂质会干扰硝磺草酮的检测,为去除干扰,选择PSA和HLB固相萃取小柱作为净化剂,并比较各自净化效果。结果表明,以PSA作为糙米、谷壳、植株、土壤和稻田水提取液的净化剂时,硝磺草酮在这5种基质中的回收率均不达标,而以HLB固相萃取小柱作为净化剂,回收率达到80%~110%。因此选择HLB固相萃取小柱作为糙米、谷壳、植株、土壤和稻田水提取液的净化剂。
2.3 方法线性范围、检出限与定量限
在0.005~0.2 mg/L范围内,硝磺草酮的峰面积与质量浓度表现出良好的线性关系,其标准曲线方程为y=137340x+114.77,相关系数R2=0.9996。按信噪比(S/N)为3计,硝磺草酮的检出限为5.0×10-12g,以低档添加浓度为准,硝磺草酮在糙米中的定量限为0.01 mg/kg,在谷壳和植株中的定量限均为0.02 mg/kg,在土壤中的定量限为0.005 mg/kg,在稻田水中的定量限为0.001 mg/L。
2.4 添加回收率和精密度
在优化的样品前处理条件和仪器条件下,进行空白基质加标回收试验,在各自添加浓度下,结果见表2。硝磺草酮在糙米中添加浓度为0.01~1.0 mg/kg时,平均添加回收率为87%~93%,相对标准偏差(RSD) 为3.5%~9.5%;在谷壳中添加浓度为0.020~2.0 mg/kg 时,平均添加回收率为85%~91%,相对标准偏差(RSD)为3.5%~8.9%;在植株中添加浓度为0.020~2.0 mg/kg时,平均添加回收率为91%~96%,相对标准偏差(RSD) 为3.1%~13.3%;在土壤中添加浓度为0.005~0.50 mg/kg时,平均添加回收率为92%~105%,相对标准偏差(RSD)为3.9%~9.7%;在稻田水中添加浓度为0.001~ 0.10 mg/kg时,平均添加回收率为90%~93%,相对标准偏差(RSD)为5.7%~11.5%。图2~6为硝磺草酮标样、土壤基质空白、土壤添加、谷壳基质空白、谷壳添加硝磺草酮的典型谱图。
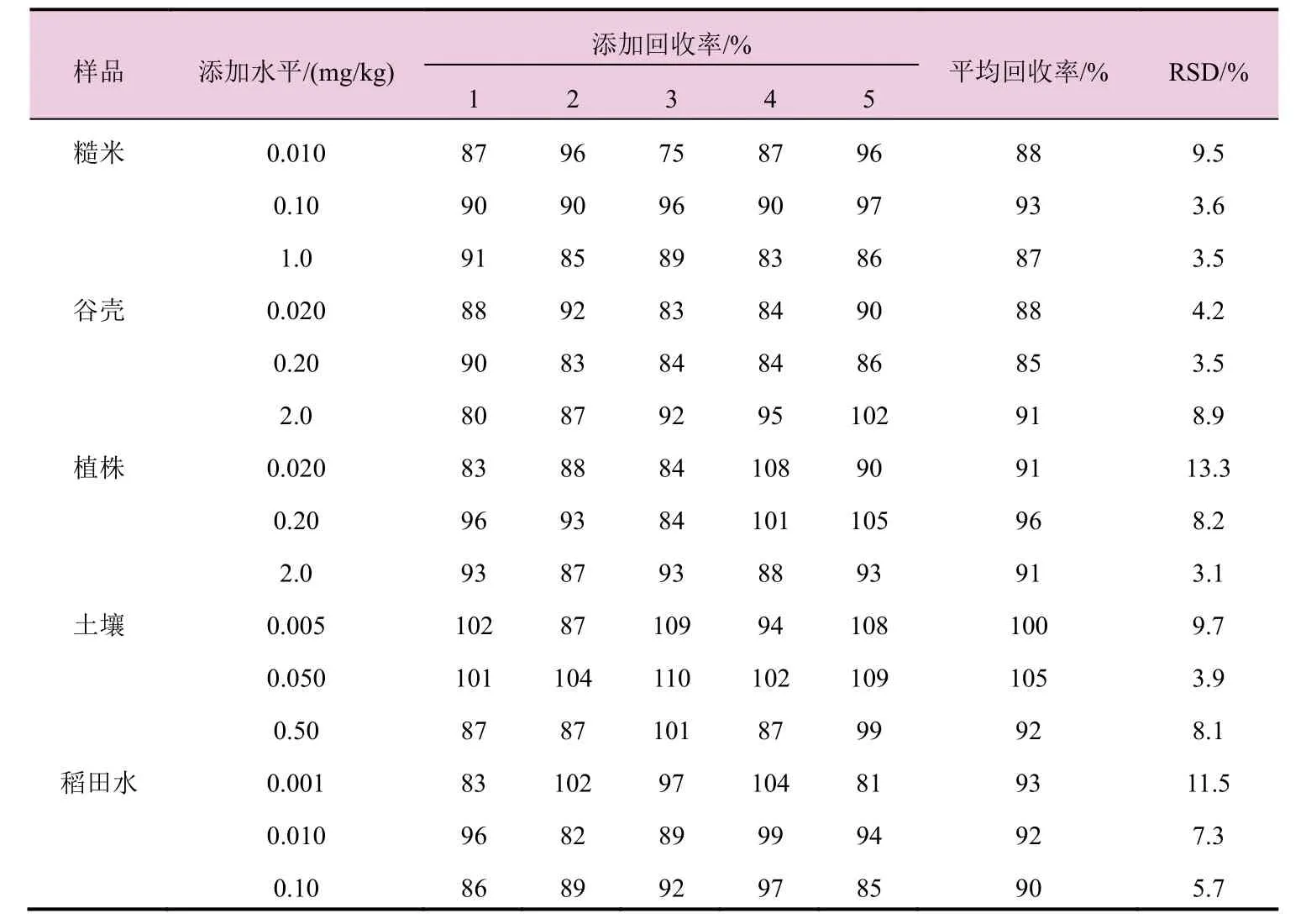
表2 硝磺草酮在糙米、谷壳、植株、土壤和稻田水中的添加回收率及相对标准偏差
3 结论
稻田样品用乙腈和水(或乙酸乙酯)提取,HLB固相萃取小柱净化,以正离子和多反应监测模式,通过超高效液相色谱-串联质谱测定,开发并验证了糙米、稻壳、稻秆、土壤和稻田水中硝磺草酮残留量的分析方法。在优化条件下,硝磺草酮在各基质中的添加回收率为85%~105%,相对标准偏差为3.1%~ 11.5%,硝磺草酮在糙米中的定量限为0.01 mg/kg,在谷壳和植株中的定量限均为0.02 mg/kg,在土壤中的定量限为0.005 mg/kg,在稻田水中的定量限为0.001 mg/L。方法的灵敏度高、重现性好,达到农药残留分析要求,适用于硝磺草酮在稻田样品中的残留抽检监测和残留登记试验。

