肺肉瘤样癌分子病理学与靶向治疗的研究进展
丁雨薇,唐秀珺,程 怡,朱 柠,翁姗姗,袁 瑛
1. 浙江大学医学院附属第二医院肿瘤内科(杭州 310000)
2. 浙江大学医学院附属第二医院肿瘤研究所(杭州 310000)
3. 恶性肿瘤预警与干预教育部重点实验室(杭州 310000)
肺肉瘤样癌是一组罕见、分化极差、高度侵袭性的肿瘤。WHO把它定义为一类含有肉瘤或肉瘤样分化成分的非小细胞肺癌,其发病率占非小细胞肺癌总数的2%~3%,占原发性肺癌的0.1%~0.4%[1-2]。目前研究认为,肺肉瘤样癌起源于单克隆原始上皮组织,经上皮间质转化致肉瘤样和(或)肉瘤的分化[3]。可能是因为上皮间质转化机制的存在,肺肉瘤样癌对铂类为基础的化疗不敏感[4-6]。同样,放疗对肺肉瘤样癌的预后也无明显改善[4]。一项纳入127例肺肉瘤样癌病例的临床研究发现其中位生存期约为10个月,5年生存率仅为15%[7],因此如何改善其预后是目前亟待攻克的难关。由于传统化疗和手术治疗效果不佳,目前有很多研究分析了肺肉瘤样癌的分子特征,有望为其治疗带来新的思路。本文着重对肺肉瘤样癌目前的分子病理学研究及治疗进展进行综述。
1 分子病理学特点
WHO根据形态学将肺肉瘤样癌分为五个亚型:梭形细胞癌、巨细胞癌、多形性癌、癌肉瘤、肺母细胞瘤。目前有文献报告的肺肉瘤样癌相关基因有TP53、EGFR、KRAS、MET和ALK等,这些基因改变可单独存在,也可同时发生,并且在不同的人群中有不同结果的突变谱[8]。梭形细胞癌和多形性癌常发生TP53、EGFR、KRAS、MET的突变。癌肉瘤中最常见的是TP53突变,很少出现EGFR和KRAS突变[9]。考虑到该疾病遗传背景的差异,全面的基因谱分析显得至关重要。
1.1 TP53基因
TP53基因又称为P53,是一种涉及细胞周期控制和基因组完整保存的抑癌基因,在人类各种类型的恶性肿瘤(包括其他类型的肺癌)中常见。有学者对32例中国肺肉瘤样癌患者进行了基因检测,发现其中突变率最高的基因是TP53(69%)。TP53突变一般发生在5号到8号外显子之间,肺腺癌和鳞癌一般突变在8号外显子上,而肺肉瘤样癌大多数突变在7号外显子上[10-12]。在肺肉瘤样癌中,TP53突变与吸烟密切相关,可能发生G:A到T:A或A:T到G:C的转化。TP53常见的突变类型为V157F和R273L,可伴有其他基因的突变,如与EGFR和PI3KCA发生共同突变[6]。研究者认为TP53突变不是肺肉瘤样癌的驱动基因,而可能是遗传不稳定性增加的副作用[13]。此外,TP53突变状态也影响肺肉瘤样癌的预后,高表达TP53患者的无进展生存期和总生存期较低表达的长[14]。
1.2 EGFR基因
肺肉瘤样癌中EGFR突变频率存在争议。有18%的日本肺肉瘤样癌患者携带EGFR突变[15],而在美国30%的肺肉瘤样癌检测出KRAS突变,却未检测出EGFR突变,同样在欧洲患者中也未发现EGFR突变[16]。在一些小样本研究中,肺肉瘤样癌的EGFR突变频率在5%~28%之间不等[6,9,17-18],低于非小细胞肺癌。其突变类型主要为19号外显子缺失、21号外显子L858R突变、20号外显子插入、21号外显子K860I突变、19号外显子I759T突变等[19]。目前也有报道D1014G、G485S、K757R、G724S和L861Q等罕见突变[12]。
1.3 KRAS基因
KRAS基因突变在非小细胞肺癌里常见,肺腺癌KRAS突变频率约为25%,肺鳞癌KRAS突变频率约为5%,其中长期吸烟的非亚裔患者KRAS突变频率则更高,这是由于烟草可引发包含KRAS在内的RAS基因突变,与肿瘤的发生发展有密不可分的关系[20]。同样,KRAS突变也是肺肉瘤样癌的常见突变之一。有研究报道,肺肉瘤样癌中KRAS 突变频率高达34%[19]。Fallet等对81例肺肉瘤样癌患者进行基因检测,发现KRAS突变大多存在于含有腺癌成分的肉瘤样癌中,其中KRAS G12C为最常见的突变类型[6]。有研究发现,在含有腺癌成分的肺肉瘤样癌患者中,KRAS突变与较低的生存率显著相关[21],提示KRAS突变状态可作为评估肺肉瘤样癌预后的指标。
1.4 MET基因
MET基因表达在上皮细胞中显著上调,而在肉瘤样细胞中表达下降,证明了MET基因在肺癌上皮间质转化机制中发挥重要的作用[22]。c-MET通路异常激活主要包括MET 14外显子跳跃突变、MET扩增和MET过表达3种类型,最常见的是MET 14外显子跳跃突变。尽管所分析的癌种病理类型不同,但MET 14外显子跳跃突变似乎特别常见于肺肉瘤样癌中,研究发现MET 14外显子跳跃突变在大约3%~4%的腺癌患者和22%的肉瘤样癌患者中出现[5]。有研究用免疫荧光原位杂交技术检测出98例肺肉瘤样癌患者中25例存在MET基因的突变,频率高达25.6%,并且此研究发现ALK伴有MET突变的频率有20%,提示ALK基因和MET基因可能存在协同作用[22]。还有研究通过基因功能试验猜测MET基因和PIK3CA基因存在共同突变[5],但仍需进一步的验证。最近一项研究在9%(4/46)的中国肺肉瘤样癌患者中检测到MET 14外显子跳跃突变,而没有其他常见的靶点突变[23]。携带MET 14外显子跳跃突变的患者往往比其他患者年龄更大,同时在未经任何酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗下,MET 14外显子跳跃突变患者的无进展生存期较其他患者短[24]。
1.5 ALK基因
ALK基因重排是肺肉瘤样癌发生发展过程中的事件之一,而且和7号染色体、17号染色体密切相关。有研究发现,在141例中国肺肉瘤样癌患者中,ALK基因发生重排的概率为3.5%[25]。ALK基因和MET基因常常发生共同突变,影响如SRC和FAK等信号通路的非随机活化,导致肿瘤的扩增甚至转移,同时靶向这两个基因的药物或许疗效更佳[22]。
1.6 PD-L1
PD-1是近年发现的一种负性共刺激分子。PD-L1是PD-1的配体,PD-1与PD-L1结合后可提供抑制性信号,诱导T细胞凋亡,抑制T细胞的活化和增殖。PD-L1/PD-1抗体属于免疫检查点抑制剂,帮助T细胞恢复对肿瘤细胞的识别和杀伤能力。免疫检查点抑制剂已证实可显著改善非小细胞肺癌患者的无进展生存期和总生存期[26]。一项比较肺肉瘤样癌和其他类型非小细胞肺癌PD-L1表达水平的研究中,69.2%的肺肉瘤样癌PD-L1表达阳性,另有27.4%的其他类型非小细胞肺癌PD-L1表达阳性[27]。甚至有报道肺肉瘤样癌PD-L1阳性率高达90%,同时有研究指出高表达的PD-L1是其预后不良的独立危险因素[28-29]。
PD-L1表达上调是肿瘤细胞为了逃过免疫监视而发生的变化,上调后可能发生了PTEN的缺失或者MEK/ERK信号通路的激活[30]。研究表明PD-L1表达与总的基因突变负荷呈正相关,尤其与KRAS突变状态相关[31],而与 EGFR、APC、PTEN、PIK3CA、TP53和STK11基因的突变无明显关联。多项研究发现肺肉瘤样癌基因突变率高,总体突变负荷大,易引起强烈免疫反应,从而提高免疫治疗的有效率[31-33]。
1.7 其他基因
BRCA1和BRCA2基因与肾透明细胞癌转化成肉瘤样癌相关[34],在肺肉瘤样癌中也有发现,可能成为PARP抑制剂药物的靶点[20]。Ge等研究发现仅在复发肺肉瘤样癌患者中观察到罕见的PHF20-NTRK1融合,很可能是在疾病进展期间新获得的,这类患者或许能从TRK抑制剂治疗中获益[35]。此外,BRAF、HER2、RET、AKT1、JAK3、NRAS、PIK3CA、STK11、IDH1、NOTCH1等基因也被陆续发现[10]。
2 靶向治疗进展
2.1 TP53基因
一种称为PRIMA-1的小分子物质可作为靶向TP53基因突变的治疗希望,已有相关实验证明其对骨肉瘤细胞及结肠癌细胞有抑制作用[36],但在肺癌中暂无TP53靶向药物研究。
2.2 EGFR基因
EGFR基因的第19号及21号外显子在肺腺癌中是常见突变位点,推荐使用表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI) 类药物靶向治疗。在肺肉瘤样癌患者中已发现使用EGFR-TKI类药物的案例:1例EGFR基因19号外显子缺失的肺肉瘤样癌患者在接受EGFR-TKI类药物作为一线治疗后,获得了疾病完全缓解,并持续了35个月[37]。另有1例EGFR野生型肺肉瘤样癌患者在一线放化疗后出现了疾病进展,转移灶重新基因检测显示EGFR 基因21号外显子L858R突变,口服厄洛替尼后获得了6个月的无进展生存期[38]。目前针对EGFR基因敏感突变的肺肉瘤样癌患者使用EGFR-TKI类药物治疗的临床获益尚不明确,需要更大规模的随机对照试验提供充足证据,为患者提供更多靶向治疗的选择机会。
2.3 KRAS基因
目前有一种仅针对KRAS G12C突变的抑制剂AMG510,I期临床结果显示AMG510治疗KRAS G12C突变的非小细胞肺癌患者的客观缓解率为48%,疾病控制率为96%[39],未来同样有望应用于肺肉瘤样癌。另外,肺肉瘤样癌与肺腺癌在分子基础上有一定的相似性,也有研究提出KRAS突变的非小细胞肺癌可使用MEK抑制剂进行靶向治疗[40]。在1例KRAS突变的肺巨细胞癌患者中发现KRAS基因突变可能对CDK 4/6 抑制剂(阿贝西利)或MEK抑制剂(曲美替尼)敏感[41]。
2.4 MET基因
克唑替尼能有效抑制MET外显子14跳跃突变细胞株的生长,很多个案也报道了MET突变的肺肉瘤样癌患者在使用克唑替尼后获得了部分缓解[5,42-43]。同时,2019年美国癌症研究协会年会上报告了沃利替尼治疗MET外显子14跳跃突变肺癌的研究结果,其中11例肺肉瘤样癌患者中,6例获得部分缓解,4例获得疾病稳定,1例出现疾病进展,证明沃利替尼存在一定疗效。因此MET也是肺肉瘤样癌有效靶向治疗的重要预测生物标志物,临床上应鼓励对肺肉瘤样癌患者进行MET基因的筛查。
2.5 ALK基因
对ALK基因重排的肺腺癌,ALK抑制剂克唑替尼和色瑞替尼等靶向药物已被FDA认可。1例ALK重排的晚期肺肉瘤样癌患者,接受克唑替尼治疗后获得了7个月的部分缓解[44]。但也有1例KRAS突变和ALK重排共存的晚期肺肉瘤样癌患者,在含铂两药化疗失败后口服克唑替尼,疾病仍快速进展[45]。由于目前案例较少,针对ALK基因的靶向药物在肺肉瘤样癌中的价值仍需进一步的探讨。另外,目前缺乏ALK基因与肺肉瘤样癌预后相关的研究。
2.6 PD-L1
KEYNOTE-024研究已证明,对于PD-L1表达水平≥50%的非小细胞肺癌,帕博利珠单抗单药与含铂类两药化疗相比,显著延长了中位无进展生存期(10.3个月VS. 6.0个月)和中位总生存期(26.3个月VS. 14.2个月)[46]。目前也有帕博利珠单抗治疗PD-L1高表达肺肉瘤样癌患者成功案例的报道:1例PD-L1表达水平>50%的III期肺肉瘤样癌患者,由于基础疾病原因,存在手术禁忌,选择尝试帕博利珠单抗,治疗5个周期后肿瘤缩小了80%以上,无进展生存期长达14个月[47]。一项纳入了37例晚期肺肉瘤样癌患者的研究显示,中位PD-L1表达水平为70%(表达区间为0%~100%),在接受纳武利尤单抗为主要免疫药物治疗后获得了40.5%(15/37)的客观缓解率、64.9%(24/37)的疾病控制率和12.7个月的中位总生存期[48]。另一项汇总分析显示,即使PD-L1表达水平<1.0%,仍有28.6%(2/7)的肺肉瘤样癌患者在使用免疫检查点抑制剂后观察到了部分或完全缓解[49]。因此,肺肉瘤样癌患者可尝试使用抗PD-L1/PD-1药物靶向治疗。
另外,CD47也是目前正在研究的新型免疫检查点。现经证实应用抗CD47抗体等方式阻断CD47 /SIRPα轴可引起体内抗肿瘤免疫反应[50],并与靶向适应性免疫系统的免疫检查点抑制剂产生协同作用[51]。有研究发现在肺肉瘤样癌中,PD-L1与CD47处于共表达状态,且与更差的预后相关[52]。未来PD-L1/CD47有望成为肺肉瘤样癌患者双重靶向治疗的新型预测标记物。肺肉瘤样癌的基因改变及相应靶向治疗详见表1。
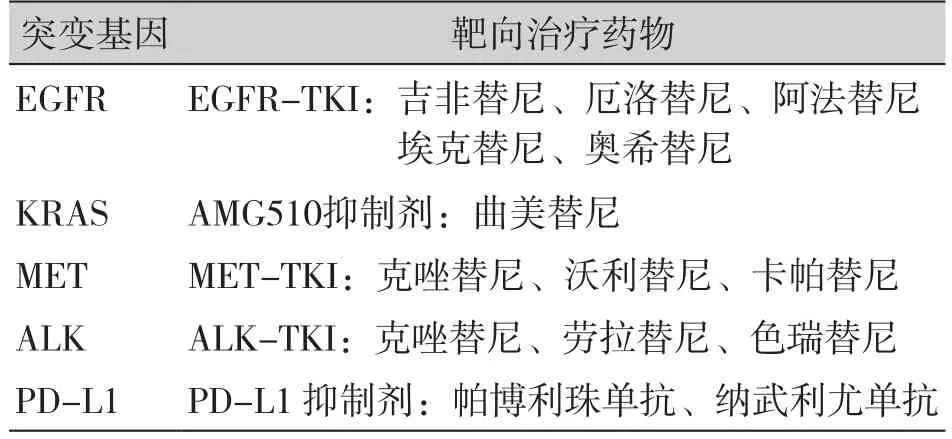
表1 肺肉瘤样癌中基因改变及相应靶向治疗Table 1. Gene mutation and corresponding targeted therapy in pulmonary sarcomatoid carcinoma
3 结语
靶向治疗及免疫治疗是肺肉瘤样癌治疗领域的新方向,需要更成熟的体内外实验及临床研究继续进行深入的探索和验证。总体来说,建议肺肉瘤样癌患者在条件可及的情况下进行基因检测,尤其是对于治疗选择有限的晚期患者,这或将为他们提供生的希望。如患者存在EGFR、KRAS、MET、ALK等有意义的基因突变,在符合临床药物适应证的前提下,可以选择尝试相应抑制剂,相较于常规效果不佳的化疗方案,或将获益更大。同样的,对于PD-L1高表达的患者,早期尝试抗PD-L1/PD-1药物靶向治疗能够很大程度上提升患者的生存质量。肺肉瘤样癌的突变基因以及作用机制的研究有待进一步深入探讨。

