基于指纹图谱和网络药理学的南柴胡质量标志物预测分析
曲中原,吴 双,郑 岩,罗龙坦,邴一凡,邹 翔,李 雪,李文兰, 2
基于指纹图谱和网络药理学的南柴胡质量标志物预测分析
曲中原1,吴 双1,郑 岩1,罗龙坦1,邴一凡1,邹 翔2*,李 雪1,李文兰1, 2
1. 哈尔滨商业大学药学院 中药学专业教研室,黑龙江 哈尔滨 150076 2. 哈尔滨商业大学药学院 药物工程技术研究中心,黑龙江 哈尔滨 150076
基于指纹图谱和网络药理学分析南柴胡中潜在的质量标志物(quality marker,Q-Marker)并测定其含量。运用高效液相色谱法建立南柴胡药材指纹图谱,确认共有峰并进行指认,再运用网络药理学方法构建“活性成分-靶点-通路”网络,预测Q-Marker,并测定其含量。建立了12批南柴胡药材指纹图谱,确认了13个共有峰,通过柴胡皂苷对照品指认5个色谱峰,分别为柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f;经网络药理学确认以上5种成分为活性成分,可作用于14个核心靶点、20条关键通路发挥抗炎、抗抑郁、抗肿瘤作用,初步预测柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f为南柴胡潜在的Q-Marker,南柴胡药材中其总质量分数不低于0.10%。南柴胡Q-Marker预测分析为药材质量评价提供参考,为阐明其药效物质基础的作用机制奠定基础。
南柴胡;质量标志物;指纹图谱;网络药理学;柴胡皂苷a;柴胡皂苷b2;柴胡皂苷c;柴胡皂苷d;柴胡皂苷f
柴胡始载于《神农本草经》,被列为上品[1],因其药用价值和良好的临床疗效,一直被广泛应用。柴胡为常用解表药,能入少阳经,长于疏解半表半里之邪,在抗击新冠冠状病毒肺炎的良方清肺排毒汤、清肺达原颗粒和柴胡达胸合剂中,对外感发热、寒热往来等症起到了关键的治疗作用。此外,柴胡疏肝解郁,以其为君药的逍遥丸、柴胡舒肝丸等在临床疗效显著。我国含柴胡的中成药品种超过500个,原药材年需量在6000 t左右[2]。柴胡基原为伞形科植物柴胡DC.和狭叶柴胡Willd.,以根入药,分别习称“北柴胡”和“南柴胡”[3]。上世纪90年代柴胡野生品资源已濒临枯竭,目前市场以北柴胡为主流商品,家种和野生并存,且以家种为主。随着黑龙江省大庆林甸种植技术的推广,南柴胡家种品种植区域扩大,市场流通逐渐增多。《中国药典》2020年版柴胡的质量标准主要体现在对北柴胡药材质量的评价,尚无南柴胡质量优劣评价[3]。柴胡皂苷成分是柴胡主要药效物质基础[4-5],但南柴胡与北柴胡在柴胡皂苷的种类和含量上有较大差异[6]。针对日渐增多的南柴胡家种品流入市场,急需确定药效相关成分评价南柴胡的质量。
刘昌孝院士[7]于2016年提出的中药质量标志物(quality marker,Q-Marker)概念,将中药有效性-物质基础-质量控制标志性成分相关联,为中药的质量控制研究指明了方向[8]。基于中药是依靠其所含的多种化学成分发挥药效作用,本研究建立能体现南柴胡化学成分整体性的指纹图谱,对药效明确的皂苷类成分进行指认[9-10],再运用网络药理学方法确定活性成分,发现潜在的Q-Marker,并预测其治疗疾病的作用靶点及机制[11-12],进一步测定Q-Marker的含量,为建立南柴胡家种品优劣评价标准提供参考。
1 材料
1.1 药材
南柴胡(批号S1、S2)采自黑龙江省黑河市嫩江县种植点,南柴胡(批号S3、S4)采自内蒙古自治区呼和浩特市兴安盟种植点,南柴胡(批号S5、S6)采自黑龙江省齐齐哈尔市龙江县种植点,南柴胡(批号S7、S8、S9、S12)采自黑龙江省大庆市林甸县种植点,栽培药材均为3年生,于9月份采集。南柴胡(批号S10、S11,产地分别为黑龙江省大庆市泰康县、大同区)为野生品,购自黑龙江省哈尔滨三棵树中药材专业市场。以上药材经哈尔滨商业大学药学院金哲雄教授鉴定均为伞形科植物狭叶柴胡Willd.的干燥根,标本保存于哈尔滨商业大学中药标本馆。
1.2 药品与试剂
柴胡皂苷a对照品(批号110777-201711)、柴胡皂苷d对照品(批号110778-201711)购自中国食品药品检定研究院,质量分数≥98%;柴胡皂苷b2对照品(批号AB213S)、柴胡皂苷c对照品(批号AB214S)购自天津一方科技有限公司,质量分数≥98%;柴胡皂苷f对照品(批号P14N7F24838,质量分数≥98%)购自上海源叶生物科技有限公司;乙腈、甲醇(色谱纯)购自德国Merck公司;纯净水购自广州屈臣氏有限公司。
1.3 仪器
U3000高效液相色谱仪(美国Thermo Fisher Scientific公司);万分之一电子天平(北京赛多利斯科学仪器有限公司);JM电子天平(诸暨市超泽衡器设备有限公司);SK3310HP型超声波清洗器(上海科导超声仪器有限公司);FW100型高速万能粉碎机(天津市泰斯特仪器有限公司)。
2 方法与结果
2.1 南柴胡高效液相色谱(HPLC)指纹图谱的建立
2.1.1 色谱条件 Waters Sun fire C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱:0~5 min,25%~37% A;5~10 min,37% A;10~50 min,37%~90% A;50~55 min,90% A;55~60 min,90%~25% A;检测波长为210 nm;体积流量为1 mL/min;柱温为30 ℃;进样量为10 μL。
2.1.2 供试品溶液的制备 取12批南柴胡药材,粉碎后过4号筛,精密称定5.0 g南柴胡粉末,置具塞锥形瓶中,加入50 mL含5%浓氨试液的甲醇溶液,密塞,30 ℃超声30 min,滤过,用20 mL甲醇分2次洗涤容器及药渣,洗液与滤液合并,回收溶剂;残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇定容至刻度,摇匀后滤过,取续滤液,即得供试品溶液。
2.1.3 混合对照品溶液的制备 精密称定柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f对照品,置于25 mL量瓶中,加甲醇振摇溶解,定容,制得混合对照品溶液,柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d和柴胡皂苷f的质量分数分别为0.92、2.40、0.86、1.38、1.96 mg/mL。
2.1.4 方法学考察
(1)参照峰选择:柴胡皂苷d是南柴胡的主要成分,其峰面积适中,色谱峰保留时间(R)稳定,因此选择柴胡皂苷d作为参照峰,计算各共有峰的相对峰面积和相对保留时间。
(2)精密度试验:取南柴胡S9批次供试品溶液,按“2.1.1”项下色谱条件连续进样6次,记录色谱图。各共有峰的相对保留时间RSD小于0.75%,相对峰面积RSD小于3.55%,表明仪器精密度良好。
(3)重复性试验:平行制备6份南柴胡S9批次供试品溶液,按“2.1.1”项下色谱条件进样,记录色谱图。各共有峰的相对保留时间RSD小于0.62%,相对峰面积RSD小于3.60%,表明该方法重复性良好。
(4)稳定性试验:取南柴胡S9批次供试品溶液,按“2.1.1”项下色谱条件分别于0、2、4、8、12、24 h进样分析,记录色谱图。各共有峰的相对峰面积和相对保留时间的RSD均小于2.00%,表明供试品在24 h内稳定性良好。
2.1.5 指纹图谱的建立与评价 将12批南柴胡的色谱图依次导入国家药典委员会研制的《中药色谱指纹图谱相似度评价系统》(2012.130723版本)中,进行全谱峰匹配,确定共有峰并进行分析,建立指纹图谱见图1,其相似度分析结果见表1,除野生品S11与对照指纹图谱相似度较低外,其余各批次南柴胡与对照指纹图谱相似度为0.803~0.962。
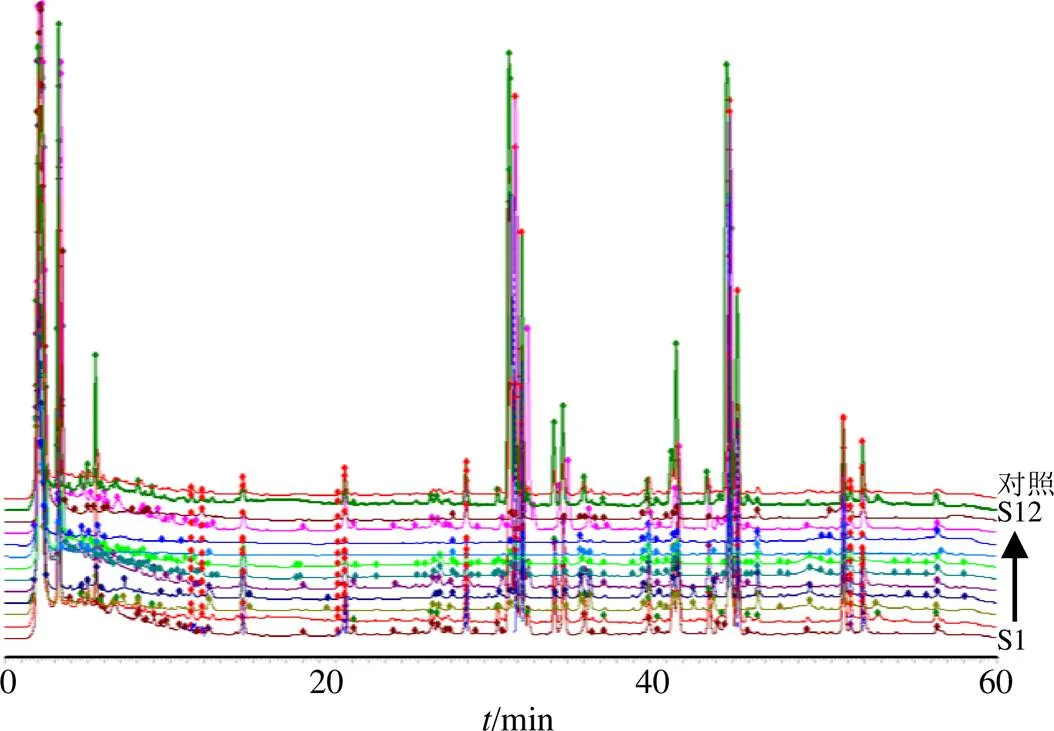
图1 12批南柴胡药材指纹图谱
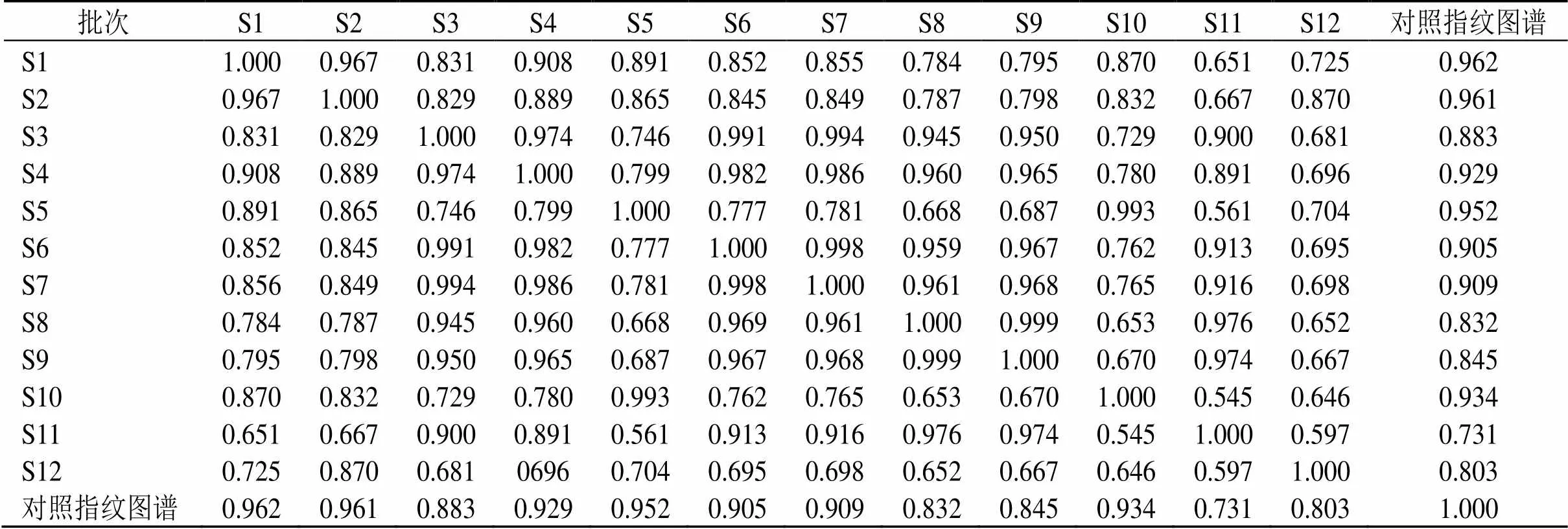
表1 12批南柴胡药材指纹图谱相似度分析
2.1.6 指纹图谱共有峰指认 对12批南柴胡药材指纹图谱进行分析,通过各色谱峰R以及色谱行为的比较,确认13个共有峰,采用R对照法共指认了5个共有峰,见图2。
2.2 基于网络药理学预测南柴胡Q-Marker
2.2.1 “活性成分-靶点”网络的构建 将“2.1.6”项下指认的柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f作为南柴胡潜在质量标志物候选活性成分,通过检索中药系统药理数据库TCMSP(http://tcmspw.com/tcmsp.php)、PubChem数据库(https://www.ncbi.nlm.nih.gov/pubmed/)、Pharm Mapper 数据库(http://lilab.ecust.edu.cn/ pharmmapper/index.php)查找5个活性成分的作用靶点;通过Uniprot数据库(http://www.uniprot.org/)将预测出的靶点名称转换为对应的基因名。将各数据库筛选出的靶点合并,除去重复靶点,最终得到与5个活性成分相关的75个靶点;将5个候选活性成分和75个靶点通过Cytoscape 3.2.1构建网络图,如图3所示。
2.2.2 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建与分析 将“2.2.1”项下筛选出的75个靶点导入STRING 11.0数据库(https://string-db.org/cgi/input.pl)进行PPI分析,物种设置为“Homo sapiens”,蛋白交互参数评分值设置为“high confidence>0.7”,隐藏网络中无联系的节点,其余参数设置不变,获得核心靶点PPI网络图见图4,将度值大于2倍中位数值作为筛选条件,筛选得到14个核心靶点,分别为丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、半胱氨酸天冬氨酸蛋白酶3(caspase 3,CASP3)、MAPK8、B淋巴细胞瘤2(B-cell lymphoma 2,BCL2)、BCL2L1、信号传导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)、蛋白磷酸酶2催化亚基α(protein phosphatase2 catalytic subunit alpha,PPP2CA)、原癌基因蛋白MYC、细胞周期蛋白依赖性激酶1(cyclin dependent kinase 1,CDK1)、CDK2、血管内皮生长因子(vascular endothelial growth factor A,VEGFA)、视网膜母细胞瘤基因1(retinoblastoma 1,RB1)、表皮生长因子受体(epidermal growth factor receptor,EGFR)。
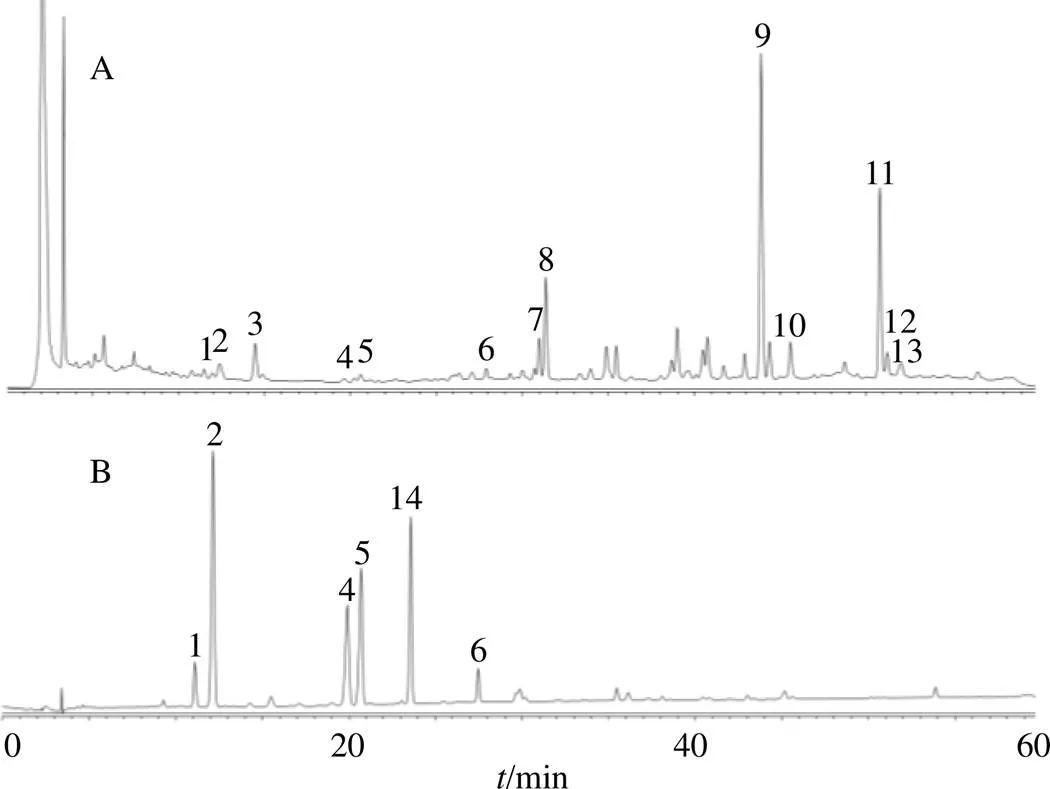
1-柴胡皂苷c 2-柴胡皂苷f 4-柴胡皂苷a 5-柴胡皂苷b2 6-柴胡皂苷d 14-柴胡皂苷b1
2.2.3 基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析 GO分析分为生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)3个部分,使用David数据库对14个核心靶点进行GO功能分析,以<0.05为筛选条件,共获得125条结果,其中96条与BP有关、9条与CC有关、19条与MF有关。根据值由大到小排序,取前20条结果,进行可视化分析,如图5所示,BP主要与细胞凋亡、细胞增殖、线粒体膜通透性、RNA聚合酶II启动子转录等有关;CC主要涉及细胞核、细胞质、线粒体等;MF主要涉及蛋白质结合、转录因子结合、蛋白丝氨酸/苏氨酸激酶活性、组蛋白激酶活性等。使用David数据库对14个核心靶点进行KEGG分析,共得到51条结果,根据值由大到小排序,取前20条通路,进行可视化分析,如图6所示,南柴胡主要通过作用于癌症、胰腺癌、磷脂酰肌醇3-激酶-蛋白激酶B(phosphatidylinositol 3-kinase-protein kinase B,PI3K-Akt)等信号通路发挥药效作用。
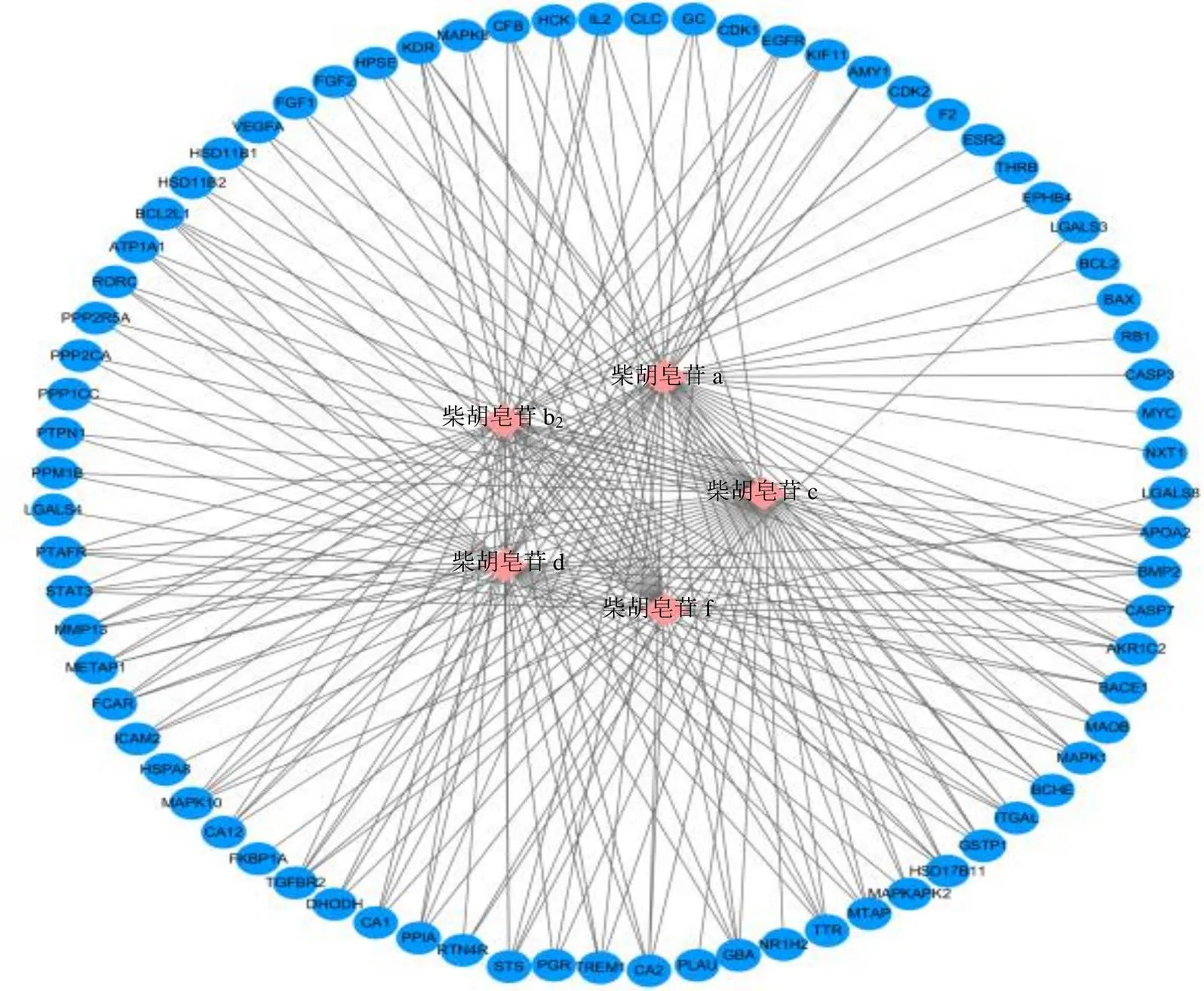
图3 “活性成分-靶点”网络图
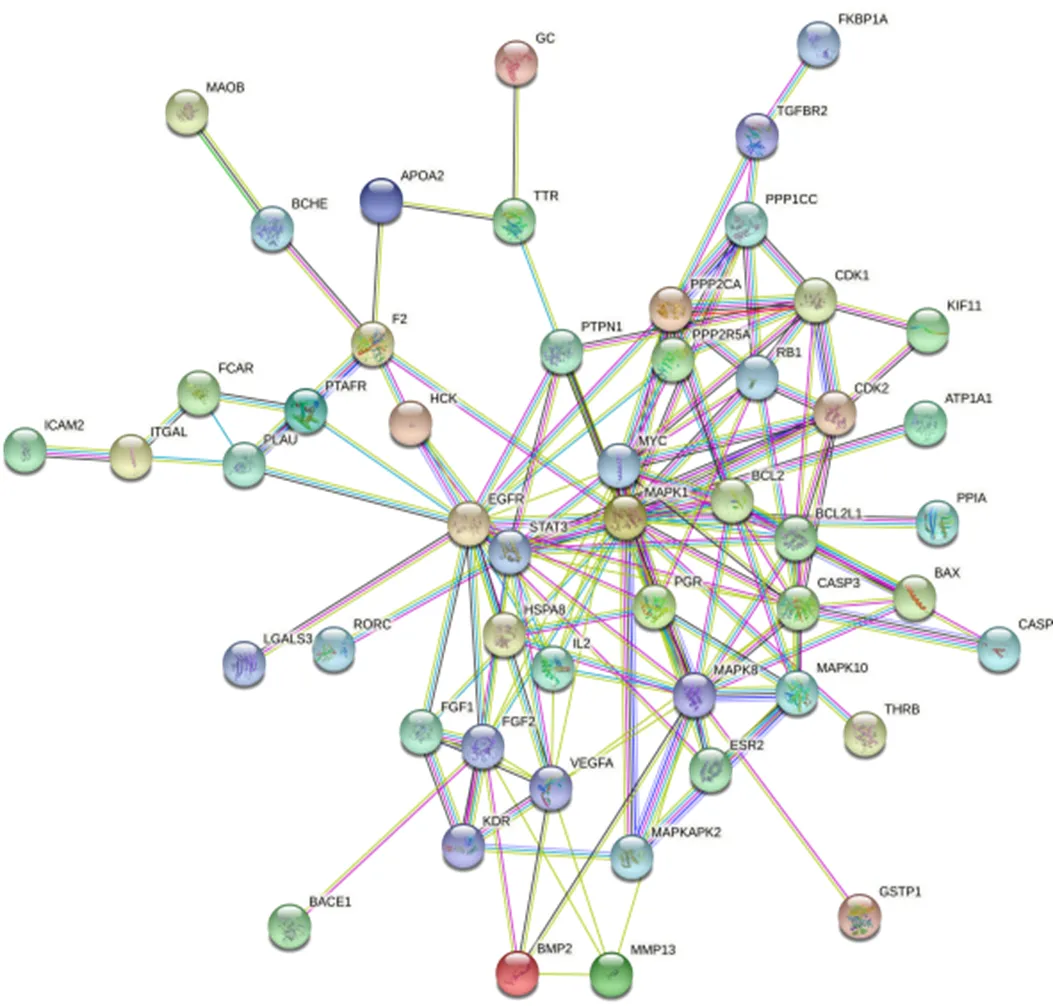
图4 PPI网络
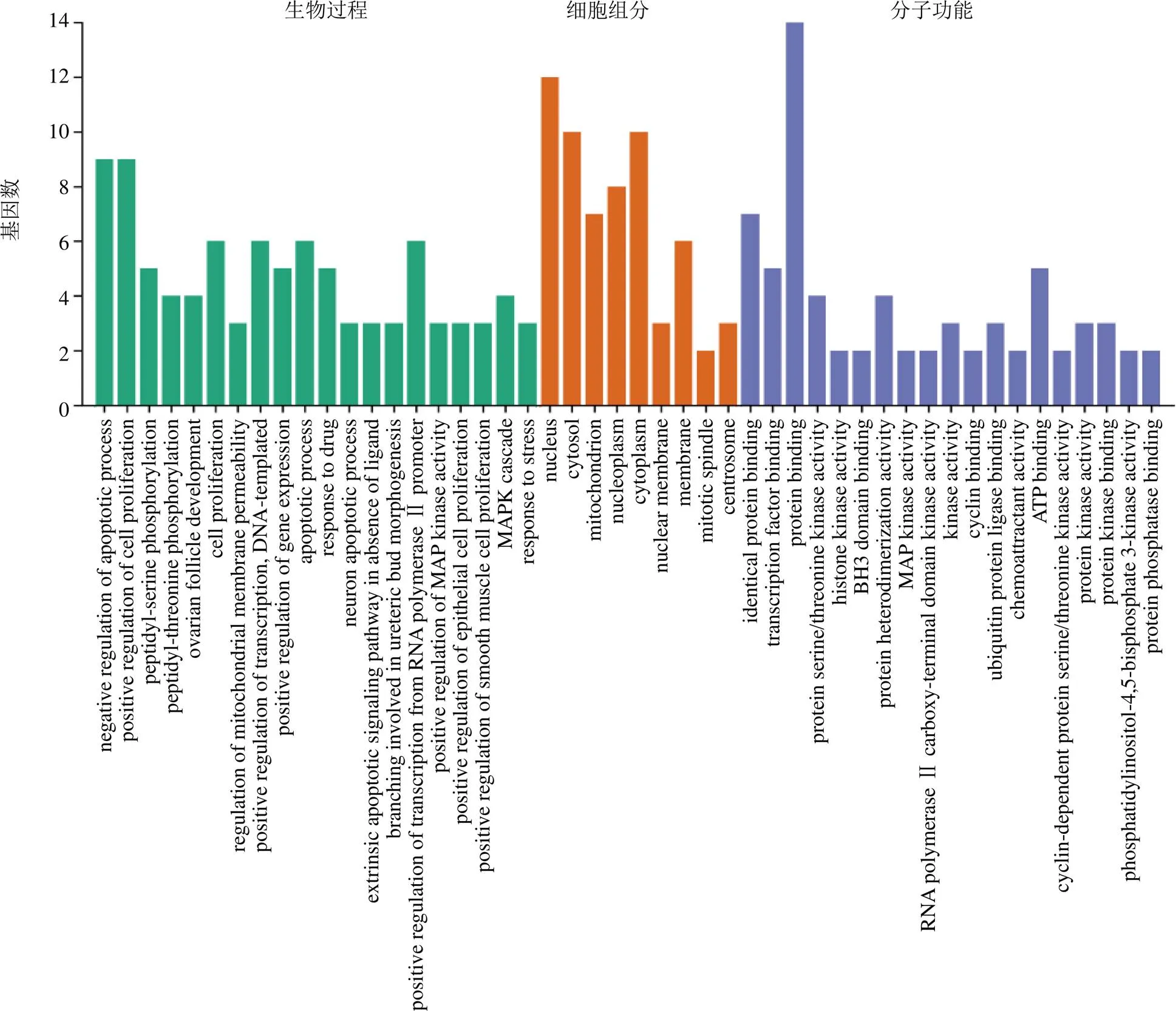
图5 GO功能分析
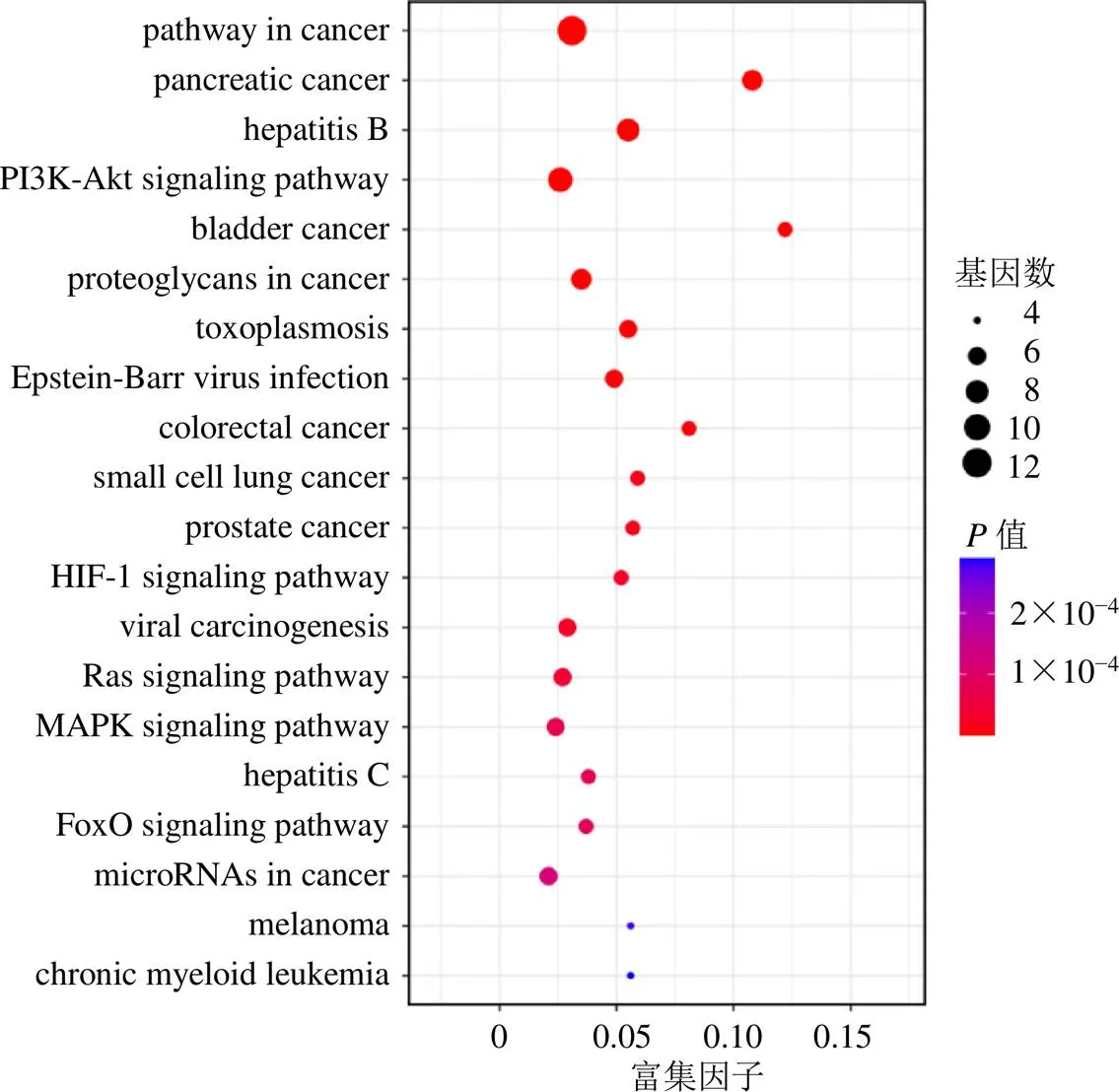
图6 前20条KEGG分析
2.2.4 “活性成分-靶点-通路”网络构建与分析 根据查找得到的5个活性成分、14个核心靶点和20条通路相互关系,运用Cytoscape 3.2.1软件构建“活性成分-靶点-通路”网络图,见图7。
2.3 南柴胡中柴胡皂苷类成分的含量测定
2.3.1 线性关系考察 分别精密量取“2.1.3”项下的混合对照品溶液0.2、1.0、2.0、4.0、6.0、10.0 mL置10 mL量瓶中,加甲醇定容至刻度,摇匀,静置,得到一系列不同质量浓度的混合对照品稀释液,按“2.1.1”项下色谱条件进样,记录色谱图。以进样质量为横坐标(),峰面积为纵坐标(),绘制标准曲线,计算回归方程,结果见表2。
2.3.2 方法学考察
(1)精密度试验:取南柴胡S9批次供试品溶液,按“2.1.1”项下色谱条件连续进样6次,记录色谱图。柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f保留时间的RSD分别为0.42%、0.35%、0.88%、0.28%、0.37%;峰面积RSD分别为2.24%、3.11%、2.51%、3.13%、1.98%,表明仪器精密度良好。
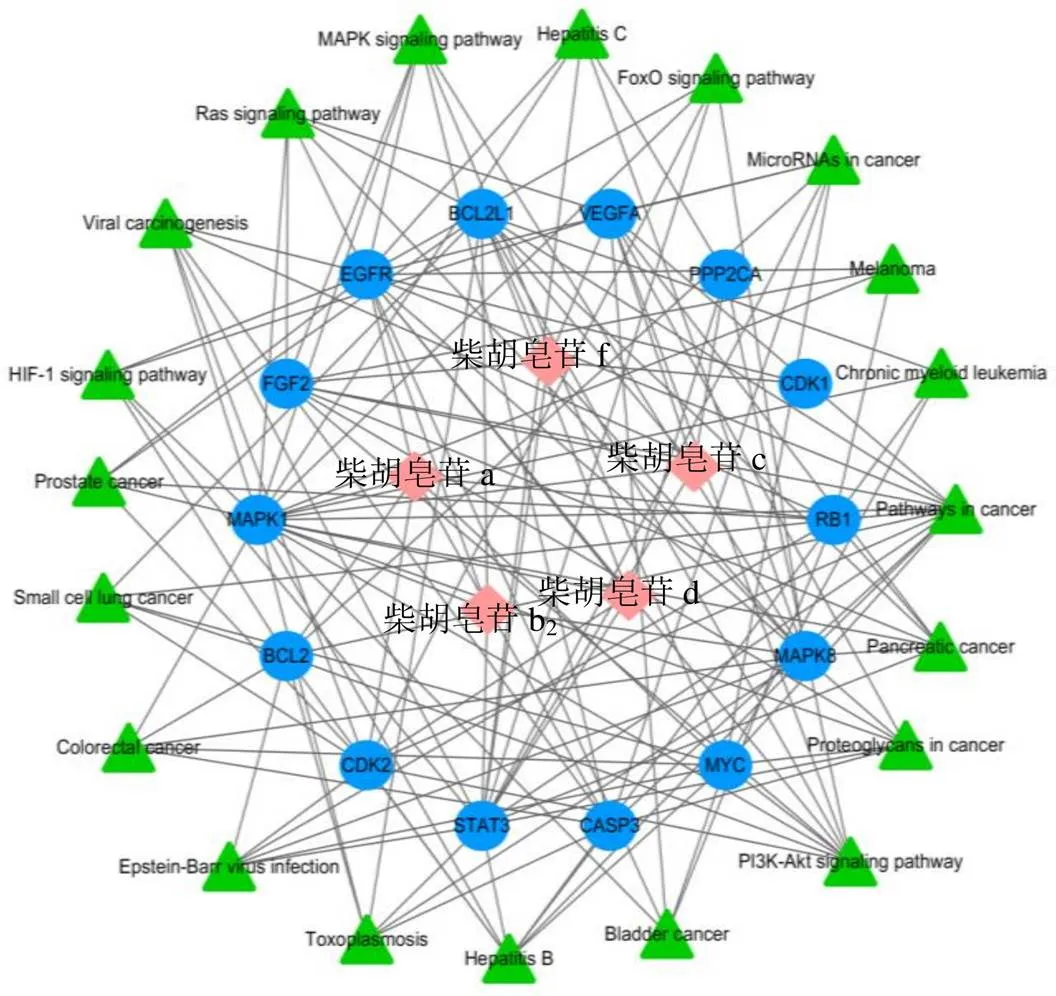
菱形为活性成分,圆形为靶点,三角形为通路
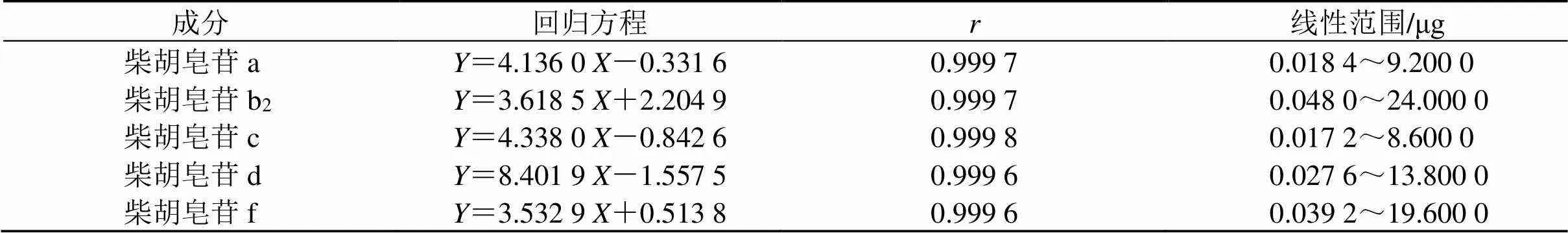
表2 线性关系考察结果
(2)稳定性试验:取南柴胡S9批次供试品溶液,按“2.1.1”项下色谱条件分别于0、2、4、8、12、24 h进样分析,柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f保留时间的RSD分别为0.26%、0.35%、1.18%、0.37%、0.68%;峰面积的RSD分别为2.18%、1.67%、2.36%、2.46%、1.66%,表明供试品溶液在24 h内稳定。
(3)重复性试验:平行制备6份南柴胡S9批次供试品溶液,按“2.1.1”项下色谱条件进行测定。柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f保留时间的RSD分别为0.58%、0.22%、0.53%、0.28%、0.39%;平均质量分数为196.41、129.41、172.51、108.92、623.18 μg/g,RSD分别为2.09%、1.77%、1.88%、1.79%、2.02%,表明该方法重复性良好。
(4)加样回收率试验:精密称定6份已知5种成分含量的南柴胡S9批次粉末,每份约2.5 g,根据样品中各成分含量,按1∶1比例精密加入相应对照品,按“2.1.2”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进行测定。柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f的加样回收率分别为98.50%、98.47%、99.83%、97.53%、97.17%,RSD分别为3.47%、4.32%、3.65%、3.87%、3.98%,表明实验结果准确。
2.3.3 样品测定 分别精密称取12批南柴胡药材粉末,按“2.1.2”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样,测定峰面积,计算样品中柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f的质量分数。结果见表3,12批南柴胡药材中5种柴胡皂苷总质量分数为0.10%~0.44%。
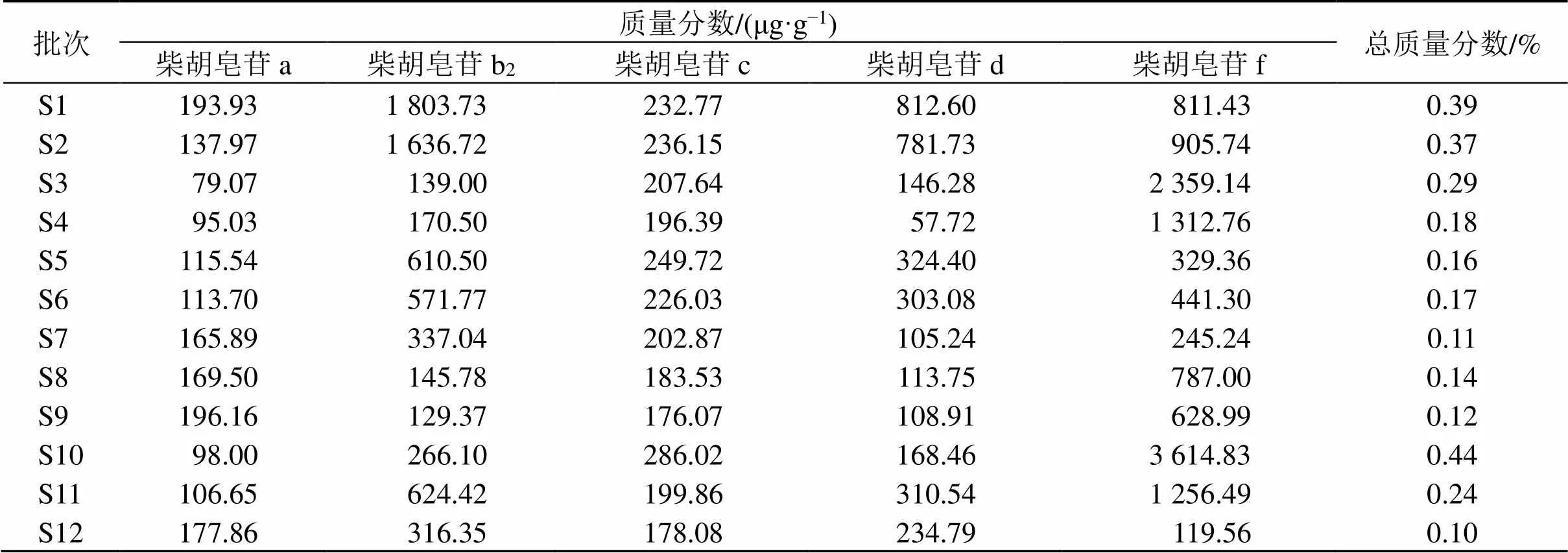
表3 12批南柴胡药材中柴胡皂苷类成分的含量
3 讨论
中药质量关乎中医临床的疗效,更关乎中药行业高质量发展,因此需要不断对中药质量评价体系进行完善,使其具有科学性、先进性和实用性。中药成分复杂、疗效多样,单一化学对照难以体现中药的特点和优势。中药Q-Marker研究方法的提出,为整合现有化学和药理研究基础,厘清中药与临床作用密切相关的化学物质提供了新思路[7]。目前,不同中药的Q-Marker和同一中药不同功效的Q-Marker研究均取得了新的进展。不同基原的中药在化学成分上存在较大差异,开展多基原药材的Q-Marker研究是一项系统工程。本研究对柴胡的基原之一狭叶柴胡的Q-Marker进行研究,为建立南柴胡质量标准奠定基础。
柴胡和狭叶柴胡的根分别习称为北柴胡和南柴胡,北柴胡的称谓在明朝时出现,南柴胡性状与北柴胡不同,其产区与北柴胡基本相同,在我国大部分地区均有分布,主产于东北、华北、华东及西北地区,以黑龙江省、内蒙古自治区、河北省产量较大[13-15]。《东北植物志》第3分册最早将南柴胡的中文学名定为狭叶柴胡[16]。肖培根在《东北植物药图志》详细描述了南柴胡的形态特征[17]。新中国成立后,由于中医药事业的发展,柴胡需求量连年增长,人类生产活动对柴胡生境的破坏以及过度采挖,导致柴胡野生资源逐渐枯竭。20世纪80年代,北柴胡变野生为家种取得成功,逐渐成为柴胡的主流商品,而南柴胡在市场上逐渐销声匿迹[18]。近年黑龙江省大庆市林甸县南柴胡仿野生栽培获得成功,3年生柴胡家种品表面呈红棕色或红褐色,近根头部有许多细而紧密的环纹,有显著败油气,具有柴胡野生品的性状特征,受到市场的认可。该种植技术已在我国东北地区、内蒙古自治区进行推广种植,目前已有大量的柴胡家种品进入药材市场。针对目前南柴胡质量评价标准中优劣评价方法尚未建立,本研究采集了黑龙江省大庆市林甸县、齐齐哈尔市龙江县、黑河市嫩江县产区以及内蒙古自治区呼和浩特市兴安盟产区10份柴胡家种品及2份野生品开展鉴定与评价研究,预测南柴胡的Q-Marker。
本研究首先建立12批南柴胡药材指纹图谱,对其化学成分进行表征。南柴胡主要有效成分柴胡皂苷均为五环三萜皂苷,位于较低波长的紫外吸收区,紫外吸收较差,色谱图上吸收峰较低。虽然HPLC采用蒸发光散射检测器(ELSD)可对柴胡皂苷类成分有更高的响应值[19],但由于ELSD检测器灵敏度低,易丢失很多指纹峰,因此本研究采用HPLC-二极管阵列检测器(PDA)法建立了南柴胡色谱指纹图谱,确定了13个共有峰,通过对照品指认出5个色谱峰,分别为柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f,北柴胡色谱图与栽培南柴胡有较大差异,表明本研究建立的以5种柴胡皂苷为代表的药效物质基础化合物群所表征的指纹图谱可用于南柴胡的定性鉴别。进一步采用网络药理学方法对指认出的5种柴胡皂苷进行药效成分筛选与靶点预测,发现柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f主要作用于MAPK1、FGF2、CASP3、MAPK8等14个关键靶点,通过PI3K-Akt、Ras、MAPK和缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)等信号通路发挥抗抑郁、抗炎、抗肿瘤作用。PI3K-Akt信号通路是治疗抑郁症的重要信号通路[20-22]。Seo等[23]发现柴胡皂苷能够通过激活PI3K/Akt/糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)信号通路发挥抗抑郁作用。大脑前额叶皮质中树突棘是神经元接收来自通信输入的突起,树突棘消除增加、形成减少与抑郁相关行为的产生有关[24]。Ras信号通路介导并调节成人大脑中树突棘形成,柴胡皂苷能否通过Ras信号通路促进树突棘再生仍需后续研究。炎症是一种机体应对感染、组织损伤或细胞应激的反应,会激活PI3K-Akt、MAPK等多条信号通路[25]。柴胡皂苷d能够通过调控PI3K-Akt信号通路,上调BCL2蛋白表达,从而减轻胃黏膜炎性损伤[26];柴胡皂苷a能够抑制脂多糖诱导的RAW264.7巨噬细胞中MAPK和核因子-κB(nuclear factor-κB,NF-κB)信号通路活化及炎症介质产生,从而发挥抗炎作用[27-28]。PI3K/Akt、Ras和MAPK信号通路与癌症密切相关[29-30]。柴胡皂苷d能够抑制NF-κB/MAPK信号转导通路激活,抑制骨肉瘤SAOS-2细胞增殖、迁移和侵袭,并促进SAOS-2细胞凋亡[31];柴胡皂苷d可激活人乳腺癌MDA-MB-231细胞MAPK信号通路,从而诱导细胞凋亡[32];柴胡皂苷d可通过调控PI3K/Akt/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路抑制胰腺星状细胞自噬,改善胰腺纤维化[33]。HIF-1α是肿瘤细胞低氧反应的重要媒介,可上调VEGF表达。柴胡皂苷d可通过抑制STAT3激活,下调HIF-1α和COX-2表达,从而抑制肝癌SMMC-7721细胞增殖[34];柴胡皂苷d能够通过抑制HIF-1α表达,对缺氧状态下的肝癌细胞起到放射增敏作用[35]。
综上,本研究基于指纹图谱和网络药理学,确定柴胡皂苷a、柴胡皂苷b2、柴胡皂苷c、柴胡皂苷d、柴胡皂苷f为南柴胡潜在Q-Marker,为南柴胡质量评价标准的提升及其相关制剂的质量控制提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 尚志钧校注. 神农本草经 [M]. 北京: 学苑出版社, 2002: 54-55.
[2] 刘潇潇, 陈馥, 林锦锋, 等. 含柴胡中成药的质量控制方法探讨 [J]. 中国药学杂志, 2019, 54(17): 1452-1456.
[3] 中国药典[S]. 一部. 2020: 293-295.
[4] 林飞武, 王自善, 戎珍, 等. 柴胡的药理作用、化学成分及开发利用研究 [J]. 亚太传统医药, 2020, 16(10): 202-205.
[5] 宋登鹏, 王雪芹, 王永慧, 等. 柴胡皂苷类化合物体内代谢途径及其代谢产物的研究进展 [J]. 药物评价研究, 2019, 42(7): 1460-1466.
[6] 冒兴建, 周云中. 南、北柴胡根与茎叶主要成分的比较 [J]. 江苏药学与临床研究, 1999, 7(1): 42-44.
[7] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[8] 张铁军, 白钢, 陈常青, 等. 基于“五原则”的复方中药质量标志物(Q-Marker)研究路径 [J]. 中草药, 2018, 49(1): 1-13.
[9] 谢培山. 中药色谱指纹图谱鉴别的概念、属性、技术与应用 [J]. 中国中药杂志, 2001, 26(10): 653-655.
[10] 张慧, 陈燕, 汪佳楠, 等. 指纹图谱技术在中药配方颗粒质量评价及过程控制中的应用 [J]. 中国中药杂志, 2018, 43(19): 3822-3827.
[11] 周文霞, 程肖蕊, 张永祥. 网络药理学: 认识药物及发现药物的新理念 [J]. 中国药理学与毒理学杂志, 2012, 26(1): 4-9.
[12] Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[13] 王晖, 张改霞, 杨成民, 等. 历代本草所用柴胡物种辨析 [J]. 中草药, 2018, 49(20): 4928-4934.
[14] 谢宗万. 中药材品种论述 [M]. 上海: 上海科学技术出版社, 1964: 185-186.
[15] 杨林林, 赵钰, 韩梅, 等. 北柴胡和狭叶柴胡中黄酮类成分及其关键酶基因表达的组织差异分析 [J]. 中草药, 2019, 50(1): 188-194.
[16] 中国医学科学院林业土壤研究所植物组. 东北植物志(第3分册)[M]. 哈尔滨: 力行誊写印刷社, 1955: 492-493.
[17] 肖培根. 东北植物药图誌 [M]. 北京: 人民卫生出版社, 1959: 52.
[18] 金世元. 金世元中药材传统鉴别经验 [M]. 北京: 中国中医药出版社, 2012: 22-24.
[19] 丛梦雨, 龚彦溶, 梁莎碧, 等. HPLC-ELSD指纹图谱分析提取与炮制对柴胡中化学成分的影响 [J]. 中国实验方剂学杂志, 2018, 24(7): 13-17.
[20] Tao W W, Dong Y, Su Q,. Liquiritigenin reverses depression-like behavior in unpredictable chronic mild stress-induced mice by regulating PI3K/Akt/mTOR mediated BDNF/TrkB pathway [J]., 2016, 308: 177-186.
[21] Wu Z T, Wang G H, Wei Y Y,. PI3K/AKT/GSK3β/ CRMP-2-mediated neuroplasticity in depression induced by stress [J]., 2018, 29(15): 1256-1263.
[22] 刘敏, 孙亚南, 于春月, 等. 柴胡皂苷a抗抑郁作用机制的研究进展[J]. 现代药物与临床, 2019, 34(3): 867-871.
[23] Seo M K, Song J C, Lee S J,. Antidepressant-like effects ofextract [J]., 2012, 4(4): 392-399.
[24] Moda-Sava R N, Murdock M H, Parekh P K,. Sustained rescue of prefrontal circuit dysfunction by antidepressant-induced spine formation [J]., 2019, 364(6436): eaat8078.
[25] 嵇莹莹, 龚国清. PI3K/Akt/mTOR通路在炎症相关疾病中分子机制研究进展 [J]. 药学研究, 2018, 37(4): 226-229.
[26] 沈珊. 柴胡皂苷d对顺铂导致大鼠胃粘膜炎性损伤的保护作用机制研究 [D]. 沈阳: 辽宁中医药大学, 2018.
[27] 程海飞, 陈艳琳, 范绍辉, 等. MAPK信号通路在急性肺损伤进程中的研究进展 [J]. 医学综述, 2020, 26(13): 2523-2528.
[28] Zhu J, Luo C Q, Wang P,. Saikosaponin A mediates the inflammatory response by inhibiting the MAPK and NF-κB pathways in LPS-stimulated RAW 264.7 cells [J]., 2013, 5(5): 1345-1350.
[29] Asati V, Mahapatra D K, Bharti S K. PI3K/Akt/mTOR and Ras/Raf/MEK/ERK signaling pathways inhibitors as anticancer agents: Structural and pharmacological perspectives [J]., 2016, 109: 314-341.
[30] Santarpia L, Lippman S M, El-Naggar A K. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy [J]., 2012, 16(1): 103-119.
[31] 庄怡富, 干耀恺, 汤亭亭. 柴胡皂苷-d促进骨肉瘤细胞凋亡的研究 [J]. 国际骨科学杂志, 2017, 38(2): 115-120.
[32] Fu R Q, Zhang L, Li Y Y,. Saikosaponin D inhibits autophagosome‑lysosome fusion and induces autophagy‑ independent apoptosis in MDA‑MB‑231 breast cancer cells [J]., 2020, 22(2): 1026-1034.
[33] Cui L H, Li C X, Zhuo Y Z,. Saikosaponin d ameliorates pancreatic fibrosis by inhibiting autophagy of pancreatic stellate cells via PI3K/Akt/mTOR pathway [J]., 2019, 300: 18-26.
[34] He S X, Lu G F, Hou H L,. Saikosaponin‑d suppresses the expression of cyclooxygenase‑2 through the phospho‑signal transducer and activator of transcription 3/hypoxia‑inducible factor‑1α pathway in hepatocellular carcinoma cells [J]., 2014, 10(5): 2556-2562.
[35] Wang B F, Wang X J, Kang H F,. Saikosaponin-D enhances radiosensitivity of hepatoma cells under hypoxic conditions by inhibiting hypoxia-inducible factor-1α [J]., 2014, 33(1): 37-51.
Predictive analysis of quality markers ofbased on fingerprint and network pharmacology
QU Zhong-yuan1, WU Shuang1, ZHENG Yan1, LUO Long-tan1, BING Yi-fan2, ZOU Xiang2, LI Xue1, LI Wen-lan1, 2
1. Department of Traditional Chinese Medicine, College of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Pharmaceutical Engineering Technology Research Center, College of Pharmacy, Harbin University of Commerce, Harbin 150076, China
To predict potential quality marker (Q-Marker) ofbased on fingerprint detection and network pharmacology analysis, and determine the contents of Q-Marker.Fingerprint ofwas established by HPLC, common peaks were confirmed and identified. “Active component-target-pathway” network was constructed by network pharmacology method. Q-Marker were predicted and their contents were determined.Fingerprints of 12 batches ofwere established, 13 common peaks were identified, and 5 peaks (saikosaponin a, saikosaponin b2, saikosaponin c, saikosaponin d, and saikosaponin f) were identified by saikosaponin reference substances. According to network pharmacology, above five components were identified as active components of, which showed anti-inflammatory, antidepressant, and anti-tumor effects through acting on 14 core targets and 20 key pathways. Saikosaponin a, saikosaponin b2, saikosaponin c, saikosaponin d, and saikosaponin f were preliminarily predicted as potential Q-Marker of, total content of which were not less than 0.10%.Prediction and analysis of Q-Marker ofcan provide references for quality evaluation of medicinal materials and lay a foundation for elucidation of action mechanism of pharmacodynamic substance basis.
Willd; quality marker; fingerprint; network pharmacology; saikosaponin a; saikosaponin b2; saikosaponin c; saikosaponin d; saikosaponin f
R284.1;285.5
A
0253 - 2670(2021)09 - 2678 - 09
10.7501/j.issn.0253-2670.2021.09.018
2021-02-20
哈尔滨商业大学青年创新人才支持计划项目(2020CX11)
曲中原(1980—),女,博士,教授,博士生导师,从事中药药效物质基础与中药炮制研究。
邹 翔(1978—),男,研究员,博士,博士生导师。Tel: (0451)84800297 E-mail: zou8663202@163.com
[责任编辑 李亚楠]

