基于化学成分特有性的质量标志物发现策略及应用
刘耀晨,许 浚,张洪兵,韩彦琪,张铁军*,刘昌孝
基于化学成分特有性的质量标志物发现策略及应用
刘耀晨1, 2,许 浚2, 3,张洪兵2, 3,韩彦琪2, 3,张铁军2, 3*,刘昌孝3, 4*
1. 天津医科大学,天津 300070 2. 天津药物研究院 中药现代制剂与质量控制技术国家地方联合工程实验室,天津 300462 3. 天津药物研究院 天津市中药质量标志物重点实验室,天津 300462 4. 天津药物研究院 释药技术与药代动力学国家重点实验室,天津 300462
中药质量标志物(quality marker,Q-Marker)是中药质量控制的新概念。按照中药质量标志物确定的“五原则”,其中的“特有性”是确定中药Q-Marker的重要依据之一。目前的中药质量评价方法或质量标准存在质量控制指标专属性差、常见以同一指标成分评价不同药材的质量而难以反映不同药材的质量特质的问题。以Q-Marker核心概念为统领,结合化学成分特有性的理论依据,提出基于成分“特有性”的中药Q-Marker研究路径,有利于提升中药质量,为中药标准化建设提供新的思路,促进中药产业的健康发展。
中药;质量标志物;五原则;成分特有性;研究路径
中药质量是保证产品内在质量和中药临床疗效的基础,是中药产业发展的生命线。近年来,我国中药科技工作者为中药质量控制做了大量的工作,中药质量研究水平有了长足的进步,但仍不能满足日益提高的质量控制要求。刘昌孝院士[1]提出中药质量标志物(quality marker,Q-Marker)的新概念,Q-Marker的研究和确定应基于有效、特有、传递与溯源、可测和处方配伍的“五原则”[2]。中药Q-Marker概念的提出,针对中药自身医药体系的特点,整合多学科知识,提出核心质量概念,以此统领中药质量研究,有利于建立中药全程质量控制及质量溯源体系。由此引起学术界、产业界的重视,并纷纷在质量标志物核心概念统领下开展相关研究[3-11]。但尚未有针对“五原则”中的“特有性”角度探讨Q-Marker研究的思路和方法的提出。本文基于Q-Marker的核心概念,提出基于成分“特有性”的中药Q-Marker发现策略,并对其具体应用进行了探讨,以期从中药Q-Marker的“特有性”视角提供可参考的研究路径和方法。
1 Q-Marker的“特有性”内涵
Q-Marker的“特有性”内涵有2个不同层次的内容:(1)能代表和反映同一类药材的共有性并区别于其他类药材的特征性成分;(2)能反映同一类、不同种药材之间的差异性成分。由于很多中药基原亲缘接近,成分类似,药效和药性等方面差异和倾向可能反映在成分的种类、含量或不同成分之间的相对比例等方面[2]。如陈皮中不含香豆素类成分,枳实、枳壳含有香豆素类成分;陈皮、枳实和枳壳中的橙皮苷、柚皮苷及辛弗林的含量存在较大差异[12]。
2 Q-Marker“特有性”的意义
中药种类繁多、成分复杂,往往不同药材含有同一成分。例如,黄酮类化合物中的橙皮苷、新橙皮苷、柚皮苷、异柚皮苷、陈皮素和柚皮素等成分在常用柑橘属药材枳实、枳壳、陈皮、青皮、化橘红中均有发现[13];皂苷类成分是人参属植物主要活性成分之一,人参属植物地上部位存在共有的皂苷成分,如人参皂苷Rg1、Re、Rb1等[14];生物碱是石斛属植物中主要药效成分之一,而不同植物来源的石斛属植物存在相同的生物碱成分,如石斛碱、对羟基苯丙酰酪胺、石斛宁等[15]。
“特有性”是中药鉴别、质量评价和质量控制的重要条件,物质的特有性是决定药材品质功效差异的内在依据。科学的质量评价方法或质量标准应具有对特定药材的“针对性”和“专属性”,若以普遍存在的成分作为含量测定指标,不能准确评价不同药材各自特有的质量特点。成分的“特有性”是中药质量控制方法“专属性”的基本条件,其重要价值在于可对不同药材进行有效的鉴别、评价和质量控制。因此,中药质量控制应基于中药成分的“特有性”。
3 Q-Marker“特有性”的理论依据
化学物质组的辨识和表征研究是成分“特有性”确定的前提。要想获得理想的Q-Marker,物质基础的系统辨识和比较研究是重要的基础和先决条件,但针对“特有性”的内涵,不但要有实验研究的证据,还需要具有植物亲缘学及其次生代谢生源途径、采收时间与植物物候期、药用部位的显微组织化学、炮制加工成分转化和化学性状环境饰变等理论依据。中药特有成分发现研究策略的技术路线见图1。
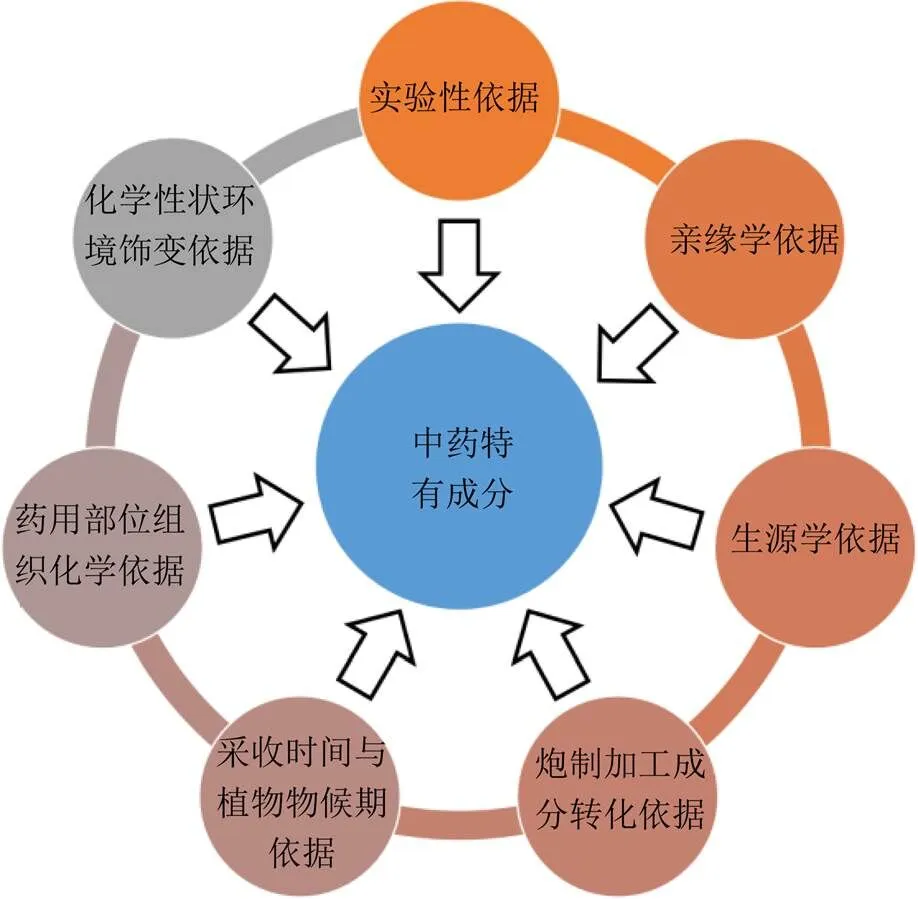
图1 中药特有成分发现研究策略的技术路线
3.1 植物亲缘学及其次生代谢产物生源途径依据
中药大部分来源于植物,在植物的漫长演化过程中,形成了或远或近的亲缘关系。亲缘近的种往往有着相似的形态和生理生化特性,因此所含的化学成分往往也比较相似。植物次生代谢物是指植物体在释放能量过程中所产生的物质,如生物碱类、萜类、黄酮类等,它们的生成受基因控制,并有明显的种属特异性,有的与植物生长发育存在一定关系[16-17]。在对中药进行亲缘学分析的基础上,通过对中药中次生代谢产物生源途径的分析有助于发现中药中特异性化学成分。
人参属内化学成分类型和存在规律与其种系发生、起源与演化、地理分布等相关。与人参属祖种亲缘关系近的类群含有该属的原始化学成分,分布于属的原始种保存地;与祖种亲缘关系较远的类群含有该属的新生(进化)化学成分,分布于属的进化中心或多样中心[2]。应当注意的是,原始种保存地与进化中心或多样中心可能是一致的[18]。人参属植物始发中心位于太行山脉及辽南山地,属东亚-北美间断分布的植物区系,中国横断山脉和中部、云南东南部及其相邻地区为该属的进化中心和多样性中心[19-20]。人参属植物于第4纪前从始发中心迁移至我国各地及分别通过白令海峡与朝鲜海峡迁移至现北美与日本等地,后由于冰河时期环境剧变,导致大部分地区人参属植物灭绝,仅现存人参属植物生存区存活,其中迁至我国西南地区的类群保持祖先原有倍性,并经过不断地选择和进化,形成现在多个物种,如三七(Burk.) F. H. Chen、珠子参C. A. Mey. var.(Burk.) C. Y. Wu et K. M. Frng、竹节参(T. Nees) C. A. Mey.等;迁至长白山山脉、西伯利亚地区等地的类群由于纬度较高,为适应环境的变化,导致倍性加倍,并由于地域间隔,各自形成现有物种,如人参C. A. Mey.、西洋参L.等[21-23]。三七与人参为生长在天然避难所的孑遗物种,且三七可能比人参更加古老。结合地下部分形态特征,人参属划分为两大类群:第1类群被认为是古老类群,典型植物有人参、西洋参、三七;第2类群被认为是进化的类群,典型植物有竹节参、珠子参等[24]。
人参属古老类群的特征性成分组包括:①氨基酸-三七素;②以达玛烷型四环三萜皂苷为主的皂苷成分[24]。三七不含齐墩果烷型五环三萜皂苷,这与人参、西洋参有所区别,且三七含有特有的皂苷类成分三七皂苷R1等[25]。古老类群共有皂苷成分(人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1)比例存在明显差异,Rg1、Re与Rb13者比例在人参中约为1.7︰1︰1.5,西洋参中约为0.2︰1︰1.2,三七中约为8︰1︰7[26]。
三七中皂苷主要成分为人参皂苷Rb1、人参皂苷Rg1、三七皂苷R1等达玛烷型四环三萜皂苷。目前,对植物达玛烷型四环三萜皂苷的生物合成途径已有初步的认识,研究认为植物达玛烷型四环三萜皂苷主要通过乙酸/甲羟戊酸途径[27](mevalonate pathway)合成,见图2。一般可分为3个阶段:①合成异戊烯基焦磷酸(isopentenyldiphosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallylpyrophosphate,DMAPP);②由异戊烯基转移酶和萜类环化酶催化IPP和DMAPP形成2,3-氧化鲨烯;③2,3-氧化鲨烯依次经过环化、羟基化、糖基化修饰后最终形成三萜类皂苷,但糖基化步骤仍有待鉴定。目前已鉴定出三七中8种参与皂苷类成分生物合成途径的糖基转移酶(3-29、3-31、3-32、3-32-i5等)[28]。三七素主要分布于山黧豆属、人参属等植物中,前期研究表明,山黧豆L.中三七素由β-异唑啉-5-酮丙氨酸合成。而在三七中未检测到β-异唑啉-5-酮丙氨酸的前体物质异唑-5-酮,表明三七中三七素生物合成可能有别于山黧豆[29]。三七中潜在的三七素合成路径见图3。可以看出,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1及三七素处于生源途径的下游位置,特有性较强。
3.2 采收时间与植物物候期的特有性依据
药用植物从发芽、展叶、开花、结实到根系的膨大和地上部分的凋萎等均是生物适应季节性环境周期变化而形成的生长发育节律,其实质是植物生长发育与环境条件的关系表征。物候期的变化体现了植物体内初生和次生代谢产物对环境变化的适应,因此,处于不同物候期的药用植物其药用部位的化学物质的积累是动态的、有节律的[30-31]。在不同物候期对药材进行采收,采收到的药材化学成分必定存在差异,这时成分的特有性主要反映在成分含量方面。
3.2.1 青皮与陈皮 青皮与陈皮均为芸香科植物橘Blanco及其栽培变种的干燥果皮。青皮包括自落幼果及未成熟果实的果皮,陈皮则是其干燥的成熟果皮[32]。青皮与陈皮性味相同,但归经与功效则不完全相同。
3.2.2 枳实与枳壳 枳实与枳壳均来源于芸香科植物酸橙L.及其栽培变种,收集5至6月自落的果实,自中部横切为两半或直接干燥的果实即为枳实;而7月果皮尚绿时采收,自中部横切为两半,所得的干燥未成熟果实则是枳壳[32]。枳实与枳壳皆能调理气机,治疗气分疾病,但其药效与临床应用有所区别[35]。
枳实和枳壳所含化学成分种类大致相同,主要为挥发油、黄酮类、生物碱类等成分。黄酮类成分主要为橙皮苷、柚皮苷和新橙皮苷等;生物碱类成分有辛弗林、乙酰去甲辛弗林等。其中最能体现枳实的特征成分是生物碱成分辛弗林;枳壳的特征成分是黄酮类成分,如柚皮苷、新橙皮苷等[12]。研究发现,随着酸橙果实成熟度的增加,总黄酮、总生物碱的含量均呈现下降的趋势[36]。枳实中总黄酮、橙皮苷、芸香柚皮苷含量较高,而枳壳中以新橙皮苷和柚皮苷含量较高[37]。此外,枳实中辛弗林及柠檬苦素的含量也高于枳壳[38-39]。
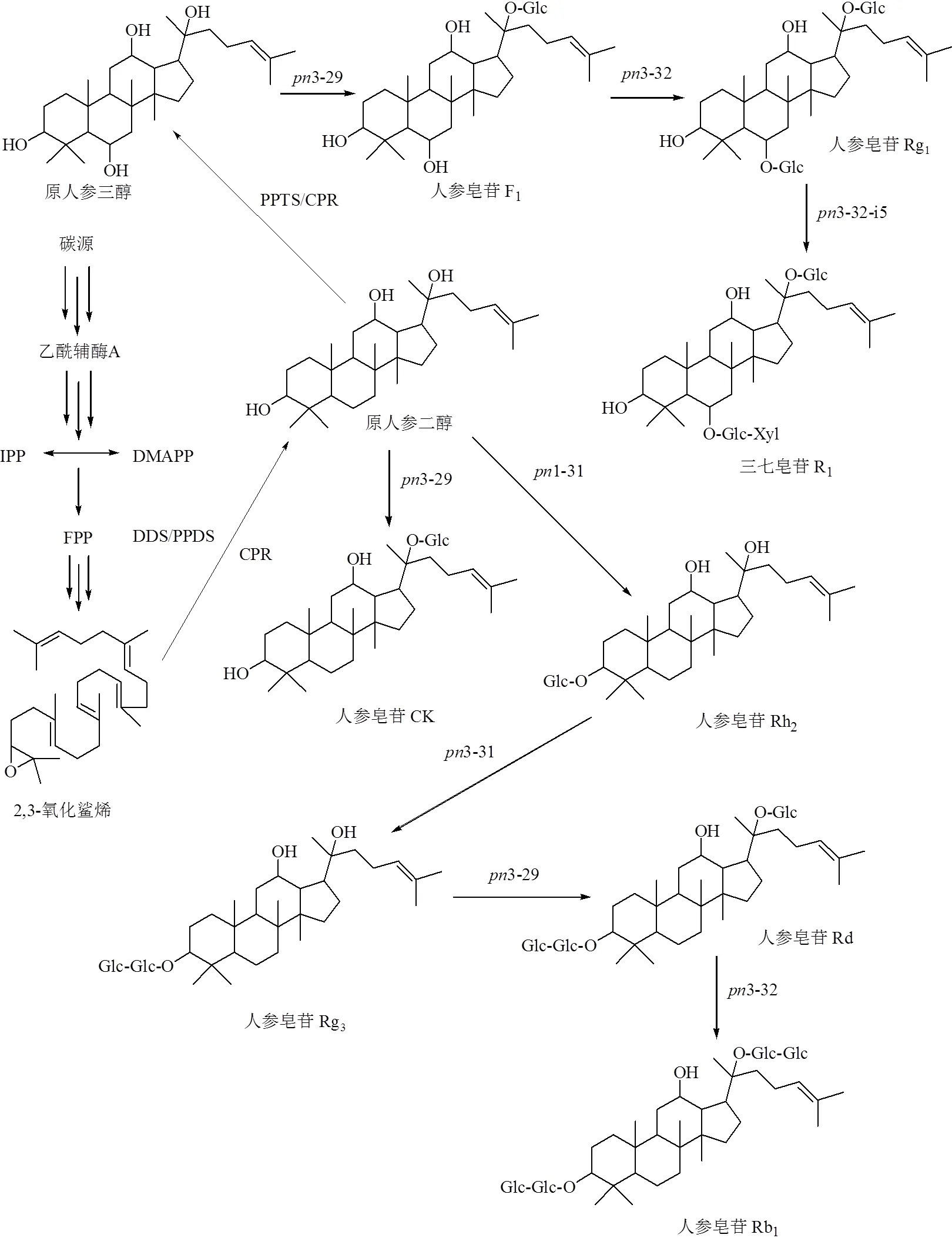
FPP-法呢基二磷酸酯 CPR-细胞色素P450还原酶 DDS-达玛烯二醇合成酶 PPDS-原人参二醇合成酶 PPTS-原人参三醇合成酶
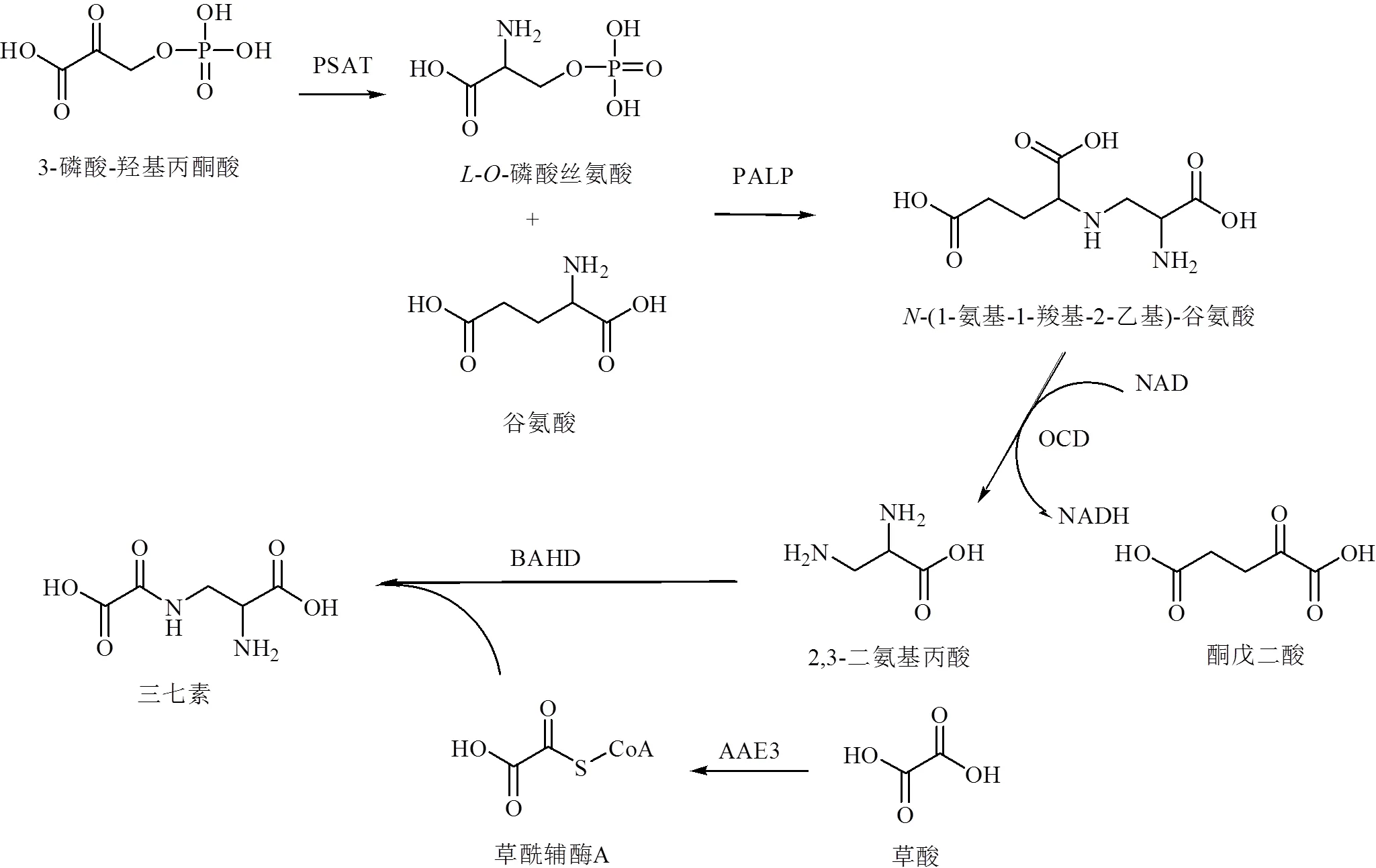
PSAT-3-磷酸丝氨酸氨基转移酶 PALP-II类PLP依赖性酶 OCD-鸟氨酸环脱氨酶 AAE3-酰基活化酶3 BAHD-BAHD酰基转移酶家族
3.2.3 青翘与老翘 青翘与老翘均来源于木犀科植物连翘(Thunb.) Vahl。其秋季果实初熟尚带绿色时采收的为青翘,果实熟透时采收的为老翘[32]。
研究表明,连翘果实中含有木脂素类、苯乙醇苷类、黄酮类、挥发油及萜类、生物碱类和有机酸类等成分,其中苯乙醇苷类、木脂素类为其主要特征性成分[40]。因采收时间和后期加工方式的不同,青翘和老翘的化学成分有一定差异,青翘中连翘苷含量高于老翘,另外,连翘酯苷A作为连翘的主要特征性成分,在青翘中的含量也明显高于老翘[41-42]。
3.2.4 西青果与诃子 西青果与诃子均为使君子科榄仁树属植物诃子Retz.的干燥果实。西青果为其干燥未成熟幼果,而秋、冬二季采收的成熟果实为诃子[32]。西青果与诃子性味归经相同,但二者功效存在差异。
研究表明,诃子和西青果中所含化学成分相似,主要为鞣质、三萜、酚酸和脂肪酸等,其中鞣质是榄仁树属植物的重要化学标志物以及主要的次生代谢产物[43]。诃子和西青果化学成分的差异主要体现在鞣质和酚酸类成分的含量上,西青果中的鞣质和没食子酸含量高于诃子,说明诃子中鞣质和没食子酸含量的高低与果实的成熟程度有关[44]。
3.3 药用部位的显微组织化学特有性依据
同一植物的不同器官作为不同药材非常普遍,对于这种情况,分析成分的特有性就尤为重要。药用植物次生代谢产物生物合成具有组织和器官的特异性,在细胞水平上,植物在细胞不同区室中合成不同种类的次生代谢产物。在特定的器官组织内合成或积累特异的化合物是次生代谢的一个特点。次生代谢途径中关键酶基因的表达,也往往具有组织器官的特异性,次生代谢产物的合成也相应地具有组织器官特异性[2]。
不同药用部位药材化学成分特有性同样主要反映在成分含量方面,本文以不同药材(槟榔与大腹皮、茯苓与茯苓皮)、不同品质规格药材(当归、三七)为例进行说明。
3.3.1 槟榔与大腹皮 槟榔为棕榈科植物槟榔L.的干燥成熟种子,大腹皮为槟榔的干燥果皮,槟榔味苦、辛,大腹皮味辛[32]。
槟榔是棕榈科植物中唯一含有生物碱的植物,生物碱是其代表性成分,主要的生物碱有槟榔碱、槟榔次碱、去甲槟榔碱、去甲槟榔次碱[45]。研究表明槟榔中的槟榔碱类成分含量远高于大腹皮,从成分分布来看,槟榔以槟榔碱类为主,槟榔次碱类含量略低;但大腹皮以槟榔次碱类为主,几乎不含槟榔碱类成分[46]。
3.3.2 茯苓与茯苓皮 茯苓为多孔菌科真菌茯苓(Schw.) Wolf的干燥菌核,茯苓皮为茯苓的干燥外皮。茯苓可利水渗湿、健脾、宁心;茯苓皮长于利水消肿[32]。茯苓药材在加工过程中可细分为白茯苓、赤茯苓、茯神,白茯苓为茯苓菌核白色部分,赤茯苓为菌核近外皮部淡红色部分,茯苓中间抱有松根称为茯神。茯苓药材的化学成分主要包括茯苓多糖、三萜等,三萜类是茯苓的重要次生代谢产物,也是茯苓药效的物质基础,并以茯苓酸为代表[47]。研究表明,茯苓不同药用部位所含茯苓酸含量大小顺序为赤茯苓>茯苓皮>白茯苓≈茯神,由此看出,茯苓不同药用部位的化学成分含量存在差异[48]。
3.3.3 当归 当归为伞形科植物当归(Oliv.) Diels的根,味苷、辛,性温,具有补血、活血、调经等功效[32]。当归所含化学成分主要包括挥发油、有机酸类等[49]。当归药材的不同部位具有不同功效,当归头、当归身、当归尾、全当归均可入药。研究表明,当归头与全当归相比,阿魏酸、6,7-环氧藁本内酯、阿魏酸松柏酯、洋川芎内酯A、丁基苯酞、-丁烯基苯酞、-藁本内酯、-丁烯基苯酞的含量明显降低,洋川芎内酯I、-藁本内酯的含量明显上升;当归身与全当归相比,洋川芎内酯H含量明显降低,阿魏酸、6,7-环氧藁本内酯、阿魏酸松柏酯、洋川芎内酯A、-藁本内酯、-丁烯基苯酞、-藁本内酯、-丁烯基苯酞含量明显上升;当归尾与全当归相比,阿魏酸、6,7-环氧藁本内酯、洋川芎内酯F、洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、洋川芎内酯A、-藁本内酯、-丁烯基苯酞、-藁本内酯、-丁烯基苯酞含量明显上升。与全当归相比,当归不同药用部位的化学成分含量不同,当归尾的挥发油、阿魏酸的含量最高,归身次之,归头最低[50]。
3.3.4 三七 三七为五加科植物三七的干燥根及根茎[32]。三七药材的主要化学成分包括皂苷类、黄酮类、氨基酸等,其中以三七皂苷R1为代表的皂苷类成分和非蛋白质氨基酸三七素为三七的特有性成分。研究表明,三七药材中不同部位的化学成分含量的差异性较为显著,其中剪口部位三七皂苷R1和人参皂苷Rg1、Re、Rb1、Rd的含量最高,而主根、绒根和侧根部位的含量则较低[51]。
3.4 炮制加工成分转化的特有性依据
中药炮制是依据中医学理论,结合中药本身的性质特点对其进行加工处理的一种方法,炮制可提高或降低药材中化学成分的含量,甚至可使某些化学成分消失或产生新物质,所以中药材经炮制后,在药物成分方面会发生较大变化[52]。
人参为五加科植物人参的干燥根[32],化学成分包括皂苷、多糖、微量元素、挥发油以及氨基酸等。红参为人参经蒸制后的干燥根和根茎,与人参对比,红参中产生了特有成分。人参中的皂苷类成分受热一方面会发生糖苷键断裂,导致大相对分子质量皂苷转化为小相对分子质量皂苷,另一方面发生构型转变,生成一些特有皂苷,如人参皂苷Rg3、Rh1、Rf2、Rk1、F4、Rs4等[53]。
除上述皂苷,红参中还存在其他特有成分。在红参加工过程中存在一种重要反应——梅拉德反应,红参中特有成分精氨酸单糖苷和麦芽酚的产生与其有关[54];人参含有挥发性成分,以β-榄香烯和人参炔醇为代表,而红参中存在特有的挥发油类成分——人参炔三醇和人参炔二醇[55]。
3.5 化学性状环境饰变的特有性依据
植物生长在复杂的环境中,为了适应变化的环境,植物的新陈代谢机制、形态等发生了变异,这种特殊的生态条件引发的“环境饰变”会导致特殊的生态型和化学型,进而决定化学成分的特有性[2]。“化学型”是指同种植物由于所含化学成分的差异可分为多种类型,但它们在形态上的差异不明显,是植物种内生物多样性的一种表现。“环境饰变”是“化学型”形成的原因之一,包括植物生长的生态环境中的盐度、温度、气候、光照、营养元素等的变化[56-57]。
3.5.1 盐度的影响 盐度是影响植物次生代谢产物积累的最重要环境因子之一,研究表明,盐胁迫除了导致渗透胁迫,还会产生活性氧导致氧化胁迫,这促使植物合成更多具有还原性的化合物,如类异戊二烯类化合物、酚类化合物和生物碱[58]。另外,盐胁迫会使鞣酸的含量增加,还会促进车前子中总酚、皂苷类、黄酮类的合成[59]。
3.5.2 温度的影响 温度是调节植物代谢水平的主要环境因子,研究表明,温度对苯丙烷类、黄酮类、生物碱类成分合成途径有重要影响。在高温、干旱条件下,颠茄、金鸡纳等植物中生物碱的含量较高;欧乌头在高温条件下含有毒性较大的乌头碱,在寒冷低温时则毒性降低;高温会造成甘草中甘草素、异甘草素含量增加。在低温条件下,苯丙烷类代谢途径所涉及的苯丙氨酸解氨酶、查耳酮合成酶及其他分支酶相关基因转录增加[60]。干旱胁迫会对药用植物次生代谢产生显著影响,会使植物体内酚类、萜类、皂苷类、有机酸等成分的含量增加[61],如在干旱胁迫对银杏叶片中槲皮素含量的提高有一定的促进作用;干旱胁迫条件下薄荷叶中,萜类物质含量升高,水分较多时薄荷油的含量则下降。然而,当干旱胁迫程度超过药用植物的承受能力,次生代谢产物的分泌量会大大降低,银杏叶中黄酮类化合物的含量会随着干旱时间的延长而下降[62]。
3.5.3 光照的影响 光照的强度、时间以及光质都对药用植物的活性物质代谢产生影响。如生于阳坡的灯盏花叶片中黄芩苷的含量高于阴坡;生于阳坡的金银花中绿原酸的含量高于阴坡。大量研究表明,紫外辐射增强可增加植物叶片中酚类和烯萜类成分的含量,黄酮类成分含量增加最为明显[63]。紫外辐射还能影响生物碱类、蒽醌类等物质的生物合成[64]。不同光质对毛地黄组织中强心苷的积累有影响,蓝光条件下,对强心苷的积累具有明显促进作用,绿光、黄光次之,红光则为抑制作用。
3.5.4 二氧化碳和臭氧浓度的影响 大气中的二氧化碳和臭氧浓度一直在增加,这对植物的初生代谢和次生代谢均产生影响。研究发现,当二氧化碳浓度升高时,人参根部的总酚和黄酮含量增加[65],灯盏花茎部的黄酮类化合物灯盏乙素含量增加[66]。用高浓度臭氧处理银杏时,叶片中萜类物质的浓度增加,而酚类物质的浓度降低[67]。
3.5.5 营养元素的影响 土壤提供植物次生代谢产物合成的初始原料,土壤中的养分和无机元素能够影响植物代谢,是影响药用植物成分的重要因素。碳素/营养平衡假说认为植物体内以碳为基础的次生代谢产物如萜类物质,与植物体内碳/氮比呈正相关,而以氮为基础的次生代谢物质如生物碱,与植物体内的碳/氮比呈负相关。研究表明土壤碱解氮与雷公藤中雷公藤红素含量呈负相关,此研究结果与上述假说相符[68]。另外,中药道地产区与非道地产区的土壤成分存在差异,当归道地产区土壤中锶、钙、铅、汞含量高于均值[69]。
4 结语
基于成分“特有性”的Q-Marker研究应在明确中药的化学物质组的前提下,以植物亲缘关系学、系统与进化植物学、植物化学分类学等理论为基础,分析各原料药材的植物学分类地位、系统位置和起源演化规律;基于原料药材化学物质组和植物亲缘学分析结果,提炼各药材的特有性成分和特征性成分,对各成分进行次生代谢产物生源途径分析,明确成分特有性的生源学依据;结合化学成分的入药部位及显微组织特有性、采收期和生物生长时期的特有性以及生态环境及化学性状环境饰变特点,分析不同基原、不同入药部位、不同炮制方法以及不同采收时间的化学成分差异性证据,主要包括:(1)同一类药材区别于其他药材的特征性成分;(2)同一类药材中不同种药材间差异成分;(3)同一药材不同基原之间的差异性成分;(4)成分的生源途径及亲缘学依据。进一步明确成分的特有性及其生源学依据,为聚焦Q-Marker提供理论和研究证据。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[2] 张铁军, 白钢, 刘昌孝. 中药质量标志物的概念、核心理论与研究方法 [J]. 药学学报, 2019, 54(2): 187-196.
[3] Liu C X, Cheng Y Y, Guo D A,. A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[4] Guo D A. Quality marker concept inspires the quality research of traditional Chinese medicines [J]., 2017, 9(1): 1-2.
[5] Ding G Y, Wang Y S, Liu A N,. From chemical markers to quality markers: An integrated approach of UPLC/Q-TOF, NIRS, and chemometrics for the quality assessment of honeysuckle buds [J]., 2017, 7(36): 22034-22044.
[6] 张铁军, 许浚, 申秀萍, 等. 基于中药质量标志物(Q-Marker)的元胡止痛滴丸的“性-效-物”三元关系和作用机制研究 [J]. 中草药, 2016, 47(13): 2199-2211.
[7] 孙蓉, 李晓宇, 王亮, 等. 基于“效-毒”相关的Q-marker合理辨识与科学控制 [J]. 世界科学技术—中医药现代化, 2016, 18(8): 1224-1231.
[8] 周秀娟, 李燕芳, 陈莹, 等. 基于UPLC-Q Exactive四级杆-轨道阱液质联用法快速建立清热灵颗粒中潜在中药质量标志物(Q-Marker)成分库 [J]. 中草药, 2017, 48(1): 67-74.
[9] 肖佳妹, 杨岩, 周晋, 等. 基于总量统计矩理论的中药质量标志物研究策略 [J]. 中草药, 2019, 50(19): 4589-4594.
[10] 侯小涛, 郝二伟, 杜正彩, 等. 基于反向功效差异性特点的中药质量标志物研究思路: 以三七为例 [J]. 药学学报, 2019, 54(2): 211-221.
[11] 许海玉, 侯文彬, 李珂, 等. 基于整合药理学的中药质量标志物发现与应用 [J]. 中国实验方剂学杂志, 2019, 25(6): 1-8.
[12] 许姗姗, 许浚, 张笑敏, 等. 常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析 [J]. 中草药, 2018, 49(1): 35-44.
[13] 陈海芳, 张武岗, 杨武亮, 等. 柑橘属常用中药黄酮类成分的研究进展 [J]. 时珍国医国药, 2008, 19(12): 2863-2865.
[14] 白敏, 毛茜, 徐金娣, 等. 人参属药用植物地上部位皂苷类成分的化学和分析研究进展 [J]. 中国中药杂志, 2014, 39(3): 412-422.
[15] 李振坚, 王元成, 韩彬, 等. 石斛属植物生物碱成分研究进展 [J]. 中草药, 2019, 50(13): 3246-3254.
[16] 肖培根. 植物亲缘关系、化学成分和疗效间的联系性 [J]. 中国药学杂志, 1978, 13(1): 1-5.
[17] 陈四保, 彭勇, 陈士林, 等. 药用植物亲缘学 [J]. 世界科学技术—中医药现代化, 2005, 7(6): 97-103.
[18] 王荷生. 植物区系地理 [M]. 北京: 科学出版社, 1992: 23.
[19] 鲁歧, 富力, 李向高. 人参属植物的生物学演变 [J]. 人参研究, 1992, 4(4): 1-5.
[20] Zuo Y J, Wen J, Zhou S L. Intercontinental and intracontinental biogeography of the eastern Asian - Eastern North American disjunct(the ginseng genus, Araliaceae), emphasizing its diversification processes in eastern Asia [J]., 2017, 117: 60-74.
[21] 梁韶, 宋娟, 雷秀娟, 等. 四种人参属药用植物的核型分析 [J]. 人参研究, 2017, 29(2): 6-10.
[22] 刘常坤. 人参属系统发育基因组学及超级条形码研究 [D]. 昆明: 云南大学, 2018.
[23] 史凤雪. 人参属系统发育与多倍化研究 [D]. 长春: 东北师范大学, 2016.
[24] 鲁歧, 富力, 李向高. 人参属植物分类学的研究进展 [J]. 吉林农业大学学报, 1992, 14(4): 107-111.
[25] 鲍建才, 刘刚, 丛登立, 等. 三七的化学成分研究进展[J]. 中成药, 2006(2): 246-253.
[26] 刘永利, 雷蓉, 王晓蕾, 等. 基于中药质量标志物的人参、西洋参、三七及相关中成药质量控制方法研究 [J]. 中国药学杂志, 2019, 54(17): 1402-1410.
[27] Jung J D, Park H W, Hahn Y,. Discovery of genes for ginsenoside biosynthesis by analysis of ginseng expressed sequence tags [J]., 2003, 22(3): 224-230.
[28] Wang D, Wang J H, Shi Y S,. Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products ofusing a synthetic biology platform [J]., 2020, 61: 131-140.
[29] Yang Z J, Liu G Z, Zhang G H,. The chromosome-scale high-quality genome assembly ofprovides insight into dencichine biosynthesis [J]., 2021, doi: 10.1111/pbi.13558.
[30] 王连喜, 陈怀亮, 李琪, 等. 植物物候与气候研究进展 [J]. 生态学报, 2010, 30(2): 447-454.
[31] 李化, 黄璐琦, 杨滨. 论植物物候学指导中药材采收期的研究 [J]. 中国药学杂志, 2008, 43(19): 1441-1444.
[32] 中国药典 [S]. 一部. 2020: 199-135.
[33] 邱蓉丽, 吴玉兰, 乐巍. 陈皮、青皮中4种黄酮成分的比较研究 [J]. 中成药, 2015, 37(1): 149-153.
[34] 赵祎姗, 黄伟, 王晓宇, 等. 陈皮及青皮药材中辛弗林含量比较研究 [J]. 时珍国医国药, 2011, 22(4): 900-901.
[35] 李琳, 滕佳林, 王加锋. 枳实、枳壳本草考证 [J]. 西部中医药, 2015, 28(6): 36-38.
[36] 施学骄. 酸橙果实不同采收期化学成分动态变化及枳实、枳壳药材质量评价研究 [D]. 成都: 成都中医药大学, 2012.
[37] 王青, 袁丹. 不同产地枳实与枳壳中黄酮类成分的含量测定 [J]. 黑龙江医药, 2008, 21(3): 1-3.
[38] 施学骄, 黄伟, 刘友平. 不同物候期枳实、枳壳化学成分动态变化研究 [J]. 时珍国医国药, 2012, 23(1): 146-148.
[39] 施学骄, 刘友平. 不同产地枳实、枳壳中柠檬苦素含量比较研究 [J]. 中国食品添加剂, 2011(5): 126-129.
[40] 夏伟, 董诚明, 杨朝帆, 等. 连翘化学成分及其药理学研究进展 [J]. 中国现代中药, 2016, 18(12): 1670-1674.
[41] 李书渊, 施玉旋, 罗婷. 青翘与青翘种子及老翘中连翘苷的含量测定 [J]. 时珍国医国药, 2006, 17(9): 1720.
[42] 闫瑞, 杨印军, 刘红卫, 等. “抢青”采摘对青翘中连翘酯苷A和连翘苷含量的影响 [J]. 中国现代中药, 2016, 18(5): 579-582.
[43] 赵鹿, 廖翠萍, 杨秀娟, 等. 诃子的研究进展及质量标志物的预测 [J]. 中草药, 2020, 51(10): 2732-2744.
[44] 黄耀广, 陈小雪, 陈秀英. 诃子、西青果和毛诃子的含量比较研究 [J]. 西北药学杂志, 2017, 32(2): 154-157.
[45] 易攀, 汤嫣然, 周芳, 等. 槟榔的化学成分和药理活性研究进展 [J]. 中草药, 2019, 50(10): 2498-2504.
[46] 田莲超, 秦少荣, 易红, 等. 同源中药大腹皮与槟榔中4种生物碱的含量比较研究 [J]. 中国中药杂志, 2018, 43(14): 2850-2856.
[47] 邓桃妹, 彭代银, 俞年军, 等. 茯苓化学成分和药理作用研究进展及质量标志物的预测分析 [J]. 中草药, 2020, 51(10): 2703-2717.
[48] 许甜甜, 金传山, 吴德玲, 等. 茯苓不同药用部位化学成分分析 [J]. 安徽中医学院学报, 2013, 32(1): 77-79.
[49] 赵静, 夏晓培. 当归的化学成分及药理作用研究现状 [J]. 临床合理用药杂志, 2020, 13(6): 172-174.
[50] 薛文新, 华永丽, 郭延生, 等. 当归不同药用部位化学成分变化规律研究 [J]. 甘肃农业大学学报, 2012, 47(1): 149-154.
[51] 沙孟晨, 周永峰, 张海珠, 等. 三七不同部位化学成分的差异性研究 [J]. 中国现代中药, 2018, 20(7): 832-836.
[52] 崔兵兵, 辛义周, 马传江. 中药炮制对中药化学成分及药效影响的研究进展 [J]. 药学研究, 2019, 38(7): 403-406.
[53] Wang C Z, Aung H H, Ni M,. Red American ginseng: Ginsenoside constituents and antiproliferative activities of heat-processedroots [J]., 2007, 73(7): 669-674.
[54] Park I H, Piao L Z, Kwon S W,. Cytotoxic dammarane glycosides from processed ginseng [J]., 2002, 50(4): 538-540.
[55] 陈燕. 鲜人参、生晒参和红参的比较研究 [J]. 海峡药学, 2006(4): 137-139.
[56] 华永丽, 黄璐琦, 陈美兰, 等. 论药用植物化学型的分类意义、地位及其分类标准 [J]. 中国中药杂志, 2009, 34(7): 924-928
[57] 陈美兰. 药用植物樟化学型形成机理的基础研究 [D]. 北京: 中国中医科学院, 2007.
[58] Hussein E A, Aqlan E M. Effect of mannitol and sodium chloride on some total secondary metabolites of fenugreek calli cultured[J]., 2012, 21(1): 35-43.
[59] Li Y Q, Kong D X, Fu Y,. The effect of developmental and environmental factors on secondary metabolites in medicinal plants [J]., 2020, 148: 80-89.
[60] Christie P J, Alfenito M R, Walbot V. Impact of low-temperature stress on general phenylpropanoid and anthocyanin pathways: Enhancement of transcript abundance and anthocyanin pigmentation in maize seedlings [J]., 1994, 194(4): 541-549.
[61] Yang L, Wen K S, Ruan X,. Response of plant secondary metabolites to environmental factors [J]., 2018, 23(4): E762.
[62] 陈雷, 常丽, 曹福亮, 等. 银杏叶黄酮类化合物含量及相关酶活性对温度和干旱胁迫的响应 [J]. 西北植物学报, 2013, 33(4): 755-762.
[63] Indrajith A, Ravindran K C. Antioxidant potential of Indian medicinal plantI. under supplementary UV-B radiation [J]., 2009, 1(1): 34.
[64] Zhang W J, Björn L O. The effect of ultraviolet radiation on the accumulation of medicinal compounds in plants [J]., 2009, 80(4): 207-218.
[65] Ali M B, Hahn E J, Paek K Y. CO2-induced total phenolics in suspension cultures ofC. A. Mayer roots: Role of antioxidants and enzymes [J]., 2005, 43(5): 449-457.
[66] Zhou R, Su W H, Zhang G F,. Relationship between flavonoids and photoprotection in shade-developedtransferred to sunlight [J]., 2016, 54(2): 201-209.
[67] He X Y, Huang W, Chen W,. Changes of main secondary metabolites in leaves ofin response to ozone fumigation [J]., 2009, 21(2): 199-203.
[68] 杜玮炜, 姚小洪, 黄宏文. 环境胁迫对雷公藤中雷公藤红素含量的影响 [J]. 植物生态学报, 2009, 33(1): 180-185.
[69] 宋平顺, 张明童, 王捷, 等. 土壤中的无机元素对当归药材道地性的影响 [J]. 甘肃农业大学学报, 2013, 48(1): 91-96.
Discovery strategy and application of quality markers of traditional Chinese medicine based on component specificity
LIU Yao-chen1, 2, XU Jun2, 3, ZHANG Hong-bing2, 3, HAN Yan-qi2, 3, ZHANG Tie-jun2, 3, LIU Chang-xiao3, 4
1. Tianjin Medical University, Tianjin 300070, China 2. National & Local United Engineering Laboratory of Modern Preparation and Quality Control Technology of Traditional Chinese Medicine, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 3. Tianjin Key Laboratory of Quality Marker of Traditional Chinese Medicine, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 4. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China
Q-Marker is a new concept of quality control of traditional Chinese medicine (TCM). According to the “five principles” for the determination of Q-marker of TCM, “specificity” is one of the vital basis for confirming the Q-marker of TCM. Nowadays, the poor specificity of the quality control and the evaluation by identical index components for diverse herbs existed in the current quality evaluation method of TCM, which is difficult to embody the qualitative characteristics of different herbs. Focused on the core concept of Q-marker, this paper puts forward a research thought for Q-marker based on component specificity combined with the theoretical basis of chemical component specificity, which is beneficial for the quality enhancement of TCM and provides a new idea for the standardized construction of TCM, so as to promote the healthy development of TCM industry.
traditional Chinese medicine; quality marker; five principles; component specificity; research pathway
R284
A
0253 - 2670(2021)09 - 2548 - 09
10.7501/j.issn.0253-2670.2021.09.006
2021-03-22
国家自然科学基金重点项目(81830111);国家重大新药创制计划课题(2018ZX09721004-006);“中医药现代化研究”重点专项(2019YFC1711201);中央引导地方科技发展专项(20ZYCGSN00200);广西创新驱动发展专项资金项目(桂科AA18118049-3);中医药国际合作专项(0610-2040NF020928)
刘耀晨(1995—),男,硕士研究生,从事中药质量标志物的研究。Tel: 17634114592 E-mail: 644632544@qq.com
张铁军,研究员。Tel: (022)23006848 E-mail: zhangtj@tjipr.com
刘昌孝,中国工程院院士。Tel: (022)23006860 E-mail: liuchangxiao@tjipr.com
[责任编辑 潘明佳]