UPLC-MS/MS同时测定大鼠血浆中热毒宁注射液13个潜在质量标志物及其药动学研究
王 璨,王保和,黄宇虹,李自强,张 涵
UPLC-MS/MS同时测定大鼠血浆中热毒宁注射液13个潜在质量标志物及其药动学研究
王 璨1,王保和2*,黄宇虹2,李自强2*,张 涵1
1. 天津中医药大学,天津 301617 2. 天津中医药大学第二附属医院,天津 300250
基于中药质量标志物(quality marker,Q-Marker)概念,采用超高效液相色谱-串联质谱(UPLC-MS/MS)方法建立同时测定血浆中热毒宁注射液13个潜在Q-Marker含量的方法,并用于大鼠体内血药浓度测定及药动学研究,以证明其体外-体内传递过程的可测性。采用Waters AQUITY UPLC C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水-乙腈梯度洗脱,体积流量0.3 mL/min;柱温为35 ℃,自动进样器温度为4 ℃;进样量为2 μL。以氯霉素为内标,采用电喷雾离子源(ESI),负离子源,多反应离子检测(multiple reaction monitoring,MRM)模式,同时定量血浆中13个Q-Marker(栀子苷、京尼平苷酸、京尼平龙胆双糖苷、山栀苷、绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、4,5-二--咖啡酰奎宁酸、裂环氧化马钱子苷、裂环马钱子酸、獐牙菜苷)含量。采用Phoenix WinNonlin8.1软件非房室模型计算药动学参数。13个化合物在检测范围内线性关系良好。大鼠血浆中内源性物质不干扰测定,该方法回收率、基质效应、精密度、准确度和稳定性均符合生物样品的测定要求。尾iv热毒宁注射液后在大鼠血浆中可检测到上述13个化合物,裂环马钱子酸在血浆中暴露量最大,栀子苷和绿原酸次之。各化合物在体内半衰期较短,消除速率快;表观分布容积提示所有化合物呈广泛组织分布。该方法可以同时定量血浆中热毒宁注射液的13个成分,证明了上述成分体外-体内传递过程的可测性;药动学研究表明上述成分还具有血浆-组织/靶器官传递性,可作为热毒宁注射液安全性和有效性评价的潜在Q-Marker。
质量标志物;热毒宁注射液;UPLC-MS/MS;药动学;栀子苷;京尼平苷酸;京尼平龙胆双糖苷;山栀苷;绿原酸;新绿原酸;隐绿原酸;异绿原酸A;异绿原酸B;4,5-二--咖啡酰奎宁酸;裂环氧化马钱子苷;裂环马钱子酸;獐牙菜苷
中药注射液的质量保障是临床用药疗效及其安全性的根本,其化学成分复杂,仅对化合物浓度单一指标进行中药注射剂质量控制的体系尚不完善。随着中药代谢动力学的研究发展,形成了“基于体内过程的中药有效成分和有效效应物质的发现策略”[1-2]。近年来,刘昌孝院士[3-4]提出中药质量标志物(quality marker,Q-Marker)概念,将注射剂中固有的、与其功能属性密切相关的化学物质作为反映该注射剂有效性和安全性的标示性物质进行质控,为中药注射剂质量控制体系提供了新思路。
热毒宁注射液是由金银花、栀子和青蒿组方制成的复方制剂,具有清热、疏风、解毒之功效,临床上广泛用于治疗以高热畏寒、头身痛、咳嗽咳痰为主症的急性上呼吸道感染[5–10],还被用于治疗及辅助治疗手足口病[11–13]、病毒性肠炎[14-15]、新型冠状病毒肺炎[16]、社区获得性肺炎[17]、支原体肺炎[18]、慢性阻塞性肺疾病[19]等。每毫升注射液由0.6 g栀子、0.75 g金银花和1.25 g青蒿提取制备而成[20],主要活性成分为环烯醚萜类和有机酚酸类化合物。Cheng等[20]采用超高效液相色谱-质谱联用(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)法鉴定出热毒宁注射液中含有19个环烯醚萜类(0.01~27.93 mmol/L)、16个有机酸类(0.04~19.06 mmol/L)和11个黄酮类(<0.08 mmol/L)化合物,并测定了其中11个成分在大鼠体内的血药浓度;吴莎等[21]应用UPLC测定热毒宁注射液中11个成分含量,并绘制指纹图谱;Wang等[22-23]采用UPLC-MS/MS技术对大鼠血浆中绿原酸、新绿原酸、隐绿原酸、京尼平苷及3个二咖啡酰奎宁酸分别进行含量测定。崔小弟等[24]建立一测多评法(quantitative analysis multi- components by single marker,QAMS),以绿原酸和栀子苷为参照物,同时测定热毒宁注射液中有机酸类和环烯醚萜苷类共9个活性成分。
基于Q-Marker筛选的“五原则”[25],根据网络药理学[26-28]及指纹图谱测定[21,29]认为热毒宁注射液中栀子苷(geniposide,GP)、京尼平苷酸(geniposidic acid,GPA)、京尼平龙胆双糖苷(genipin-1-β-- gentiobioside,GPGS)、山栀苷(shanzhiside,SZS)、绿原酸(chlorogenic acid,CGA)、新绿原酸(neochlorogenic acid,NCGA)、隐绿原酸(cryptochlorogenic acid,CCGA)、异绿原酸A(isochlorogenic acid A,ICGAa)、异绿原酸B(isochlorogenic acid B,ICGAb)、4, 5-二--咖啡酰奎宁酸(4, 5-dicaffeoylquinic acid,ICGAc)、裂环氧化马钱子苷(secoxyloganin,SL)、裂环马钱子酸(secologanic acid,SLA)、獐牙菜苷(sweroside,SWS)与其抗炎、抗氧化、抗菌作用相关,且与栀子[30]和金银花[29]的预测Q-Marker重合,可成为热毒宁注射液潜在的Q-Marker。前期研究中尚无同时测定上述13种化合物(图1)的方法,为进一步对热毒宁注射液的Q-Marker进行深入探索,本研究采用UPLC-MS/MS技术建立同时测定大鼠血浆中上述13种化合物定量分析方法,并以尾iv热毒宁在大鼠血浆中的药动学研究验证潜在Q-marker在其体外-体内传递过程的可测性。
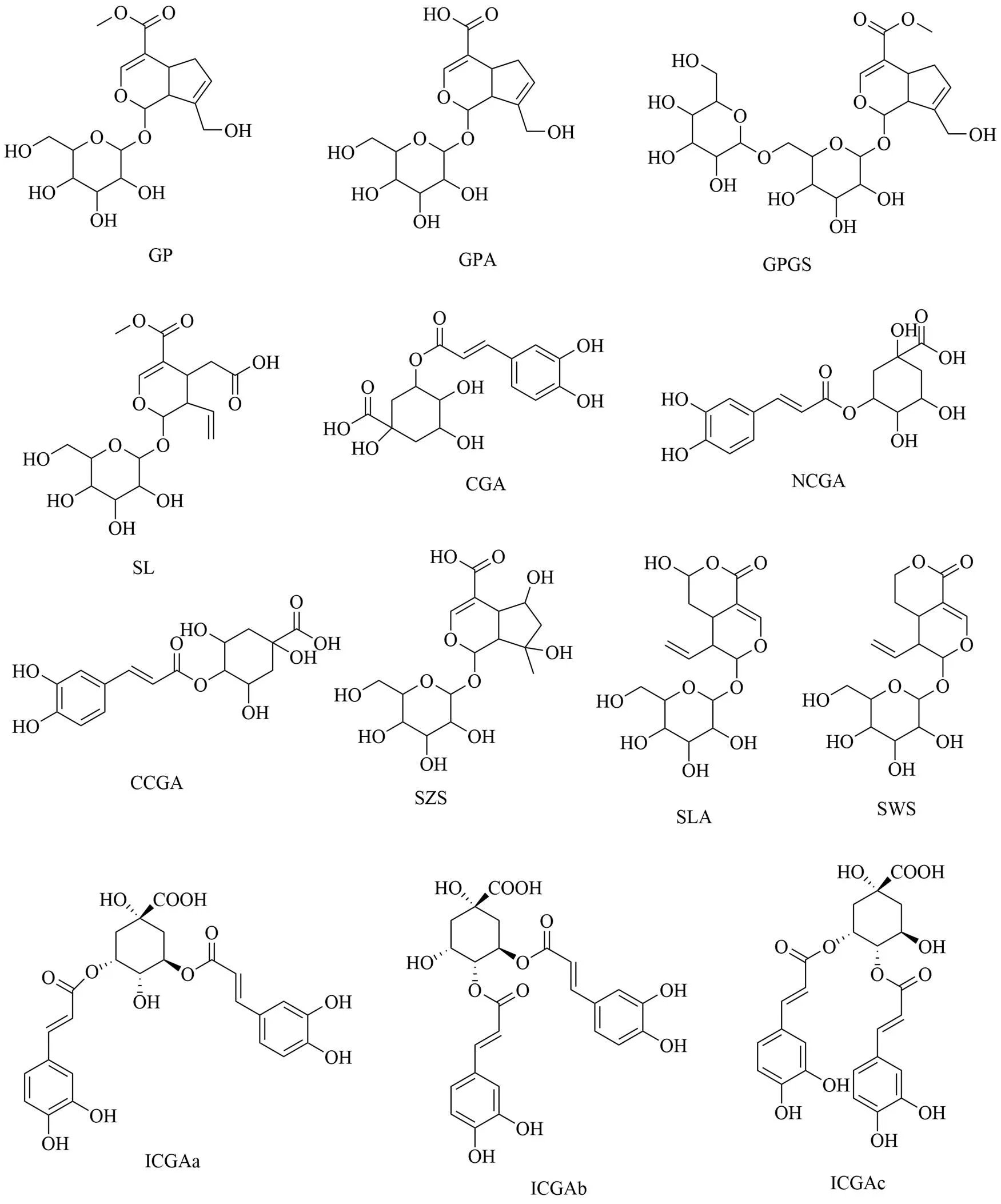
图1 热毒宁注射液13个潜在Q-Marker
1 材料与仪器
1.1 试剂及药品
对照品GP(质量分数97.1%,批号110749- 201919)、GPA(质量分数98.1%,批号111828- 201805)、CGA(96.8%,批号110753-201817)、SWS(质量分数97.1%,批号111742-200501)购于中国食品药品检定研究院;对照品GPGS(质量分数≥98.0%,批号7382)、NCGA(质量分数≥98.0%,批号7864)、CCGA(质量分数≥98.0%,批号3208)、ICGAa(质量分数≥98.0%,批号7867)、ICGAb(质量分数≥98.0%,批号3089)、ICGAc(质量分数≥98.0%,批号3001)、SLA(质量分数≥98.0%,批号6719)购于上海诗丹德标准技术服务有限公司;对照品SZS(质量分数≥95%,批号P30J9F64637)购自上海源叶生物科技有限公司;SL(质量分数≥98%,批号19050905)购自成都普菲德生物技术有限公司;内标物(IS)采用氯霉素(质量分数98.0%,批号56757)购自TRC公司;色谱级乙腈和甲醇购自美国Fisher公司,色谱纯甲酸购自美国TEDIA公司,分析纯-(+)-抗坏血酸(批号20200526)购自国药集团化学试剂有限公司。热毒宁注射液(批号190805)为江苏康缘药业股份有限公司产品(经UPLC-MS/MS测定含GP 10.59 mg/mL、GPA 0.71 mg/mL、GPGS 5.25 mg/mL、SZS 0.31 mg/mL、CGA 6.53 mg/mL、NCGA 2.72 mg/mL、CCGA 3.06 mg/mL、ICGAa 0.25 mg/mL、ICGAb 0.45 mg/mL、ICGAc 0.29 mg/mL、SL 1.01 mg/mL、SLA 46.70 mg/mL、SWS 0.71 mg/mL)。
1.2 仪器
Waters AQUITY UPLC™超高效液相色谱仪(美国Waters公司),配置自动进样器和柱温箱冷却系统;AB Triple Quad 5500质谱仪(美国AB公司),配置电喷雾电离源(Electron Spray Ionization,ESI)接口;用AB程序Analyst 1.6.2软件进行仪器控制和数据采集。Synergy UV超纯水机(美国Millipore公司);XPE26型分析天平(万分之一,瑞士Mettler Toledo仪器有限公司)。KQ-400KDE超声波清洗机(昆山超声仪器有限公司);Centrifuge 5418高速台式离心机(德国Eppendorf公司);V-32涡旋混合器(英国Grant bio公司);DW-86L388J超低温冰箱(青岛海尔集团);5804R高速台式离心机(德国eppendorf公司)。药动学参数分析采用Phoenix WinNonlin软件。
1.3 实验动物
SPF级健康雄性SD大鼠,体质量200~250 g,北京华阜康,生产许可证号SCXK(京)2019-0008。大鼠饲养环境温度为(25±2)℃,湿度为(50±10)%,12 h光照,昼夜交替,正常进食饮水,适应性饲养1周。实验方案经天津中医药大学实验动物伦理委员会审核通过(编号TCM-LAEC2020073),实验过程符合动物实验的伦理要求。
2 方法
2.1 对照品溶液的配制
2.1.1 对照品储备液的配制 分别精密称量“1.1”项的13个化合物和内标氯霉素对照品,置于10 mL棕色样品瓶中,用甲醇溶解。GP、SLA储备液质量浓度为2 mg/mL,GPA、GPGS、SZS、CGA、CCGA、NCGA、ICGAa、ICGAb、ICGAc、SL、SWS、氯霉素储备液质量浓度为1 mg/mL。4 ℃环境避光储存,使用前恢复至室温。
2.1.2 混合对照品溶液的配制 按比例精密移取各对照品储备液至20 mL棕色样品瓶中,其中GPA、SZS、ICGAb、ICGAc、SWS为300 μL,GPGS、SL、ICGAa为750 μL,CGA、CCGA、NCGA为1000 μL,GP为1500 μL,SLA为2250 μL,用甲醇定容至15 000 μL。4 ℃环境避光储存,使用前恢复至室温。
2.1.3 标准曲线和质控工作液的配制 取上述混合对照品溶液1 mL置于EP管中,以甲醇-水(50∶50)稀释制备标准曲线(100%、50%、25%、10%、5%、2.5%、1%、0.25%、0.1% A)和质控工作液(75%、7.5%、0.3% A)。4 ℃避光储存,使用前恢复至室温。
2.1.4 内标工作液的配制 取氯霉素储备液20 μL,以甲醇-水(50∶50)稀释至500 ng/mL。分装后4 ℃环境避光储存,使用前恢复至室温。
2.2 样品处理
2.2.1 标准血浆样品制备 取45 μL空白大鼠血浆[含2%甲酸、0.2%-(+)-抗坏血酸],加入5 μL混合对照品溶液,各化合物在标准血浆样品中质量浓度见表1。
2.2.2 血浆样品处理方法 取50 μL血浆样品加入5 μL内标工作液,加入150 μL甲醇沉淀蛋白,涡旋振荡3 min,在10 000 r/min离心10 min,取上清液,以过0.22 μm有机滤膜后的含0.2%抗坏血酸(11.3 mmol/L)及0.5%甲酸的甲醇-水(50∶50)作为稀释液(1∶3),稀释后供UPLC-MS/MS分析。
2.3 色谱条件
采用Waters AQUITY UPLC C18色谱柱(100 mm×2.1 mm,1.7 μm),AQUITY UPLC BEH C18,VanGuardTM pre-Column3/PK保护住(5 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~1.40 min,95% A;1.40~3.00 min,95%~90%A;3.00~5.50 min,90%~80%A;5.50~7.50 min,80%~78%A;7.50~9.00 min,78%~70%A;9.00~11.00 min,70%~95%A;采集时间11.00 min,体积流量0.3 mL/min;柱温35 ℃,自动进样器保持4 ℃,进样量2 μL。
2.4 质谱条件
本研究中13个化合物易脱H+而形成[M-H]−,采用电喷雾负离子(ESI−)、多反应监测模式(multi reaction minitoring,MRM)。干燥气为氮气;气帘气压力为241.3 kPa,离子源雾化气压力为379.21 kPa,离子源加热辅助气压力310.2 kPa,碰撞气压力为48.3 kPa,喷雾电压为–4500 V,加热器温度为500 ℃。
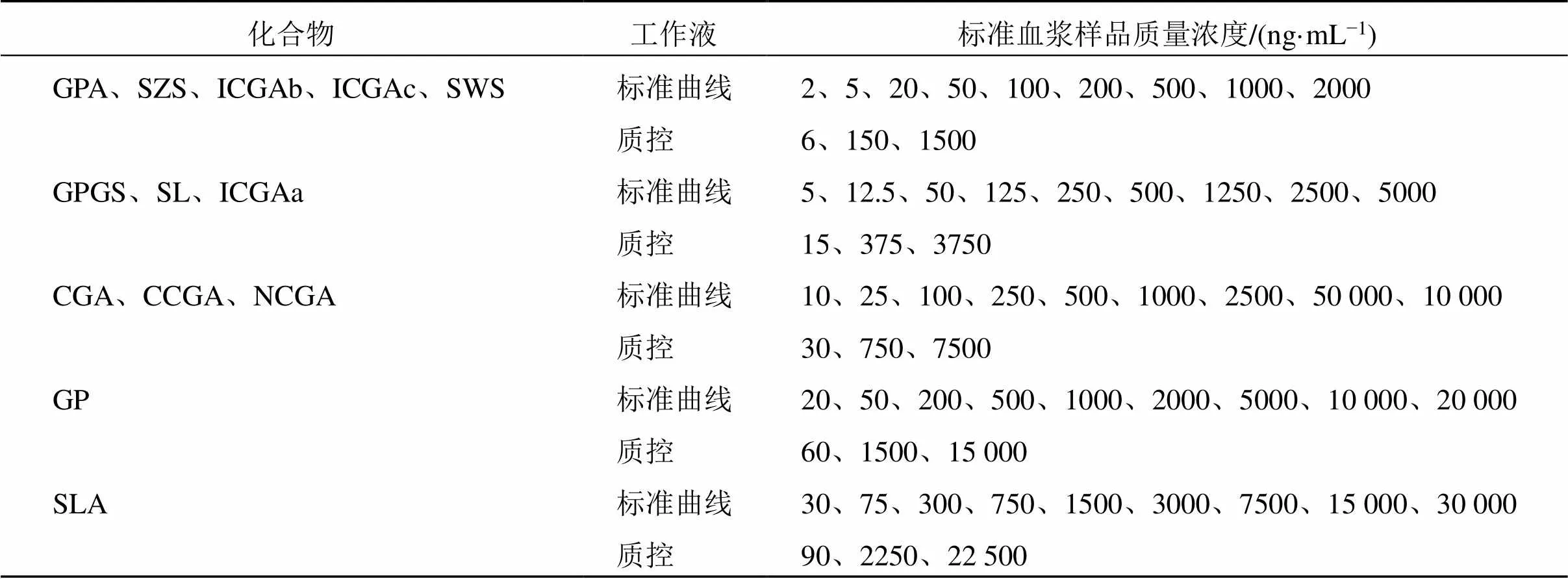
表1 13个化合物的标准曲线和质控血浆样品的质量浓度
针泵直接进样以确定目标物的母离子,采用子离子扫描方式进行二级质谱扫描,按照相应强度由高到低的原则选取2个以上碎片作为子离子,并优化其电压参数后,择优作为定量离子对。质谱参数见表2。
2.5 方法学验证
2.5.1 专属性 取6只不同大鼠混合空白血浆,按“2.2.2”项方法处理,采用UPLC-MS/MS分析,观察大鼠血浆中内源性物质对上述13个化合物的检测是否存在干扰。
2.5.2 标准曲线及定量下限(lower limit of quantification,LLOQ) 按“2.2”项方法制备并处理标准曲线样本,进样后根据每个分析物与内标物的峰面积比为纵坐标(),分析物的血浆浓度(,ng/mL)为横坐标,并使用(1/2)作为加权因子进行加权法运算,并进行线性回归分析。
2.5.3 残留 取空白大鼠血浆,按“2.2.2”项方法处理后置于标准曲线最高点后进空白样品以预估残留,重复6次。

表2 13个化合物及内标物的质谱参数
2.5.4 精密度和准确度 按“2.2”项方法制备并处理低、中、高浓度质控样品(=6),进样后记录目标化合物峰面积与内标物峰面积,根据随行标准曲线计算实测各化合物浓度以及批内准确度(ACw)和精密度(RSDw);平行测定3批,计算批间准确度(ACb)和精密度(RSDb)。准确度(AC)为实测浓度均值与真实浓度的比值;精密度以实测浓度RSD表示。
2.5.5 提取回收率(extraction rate,ER)和基质效应 (1)按“2.2”项方法制备并处理低、中、高浓度质控样品(=6),进样后记录待测物峰面积QC;(2)取空白血浆,按“2.2.2”项沉淀蛋白后取上清液,每195 μL上清液中加入混合对照品工作液5 μL,制备低、中、高浓度质控样品(=6),进样后记录待测物峰面积Asd;(3)取空白去离子水制备低、中、高质控浓度溶液(=6),进样后记录待测物峰面积Am再按照公式计算ER、基质效应因子(matrix factor,MF)和内标归一化的MF。
ER=QCAm
MF=AsdAm
内标归一化的MF=MF待测物/MFIS
2.5.6 稳定性 按“2.2.1”项方法制备低、中、高浓度QC样品(=18),分别对处理前样品室温放置24 h、–80 ℃反复冻融3次,–80 ℃冷冻保存60天,处理后样本室温放置24 h,自动进样器内24 h稳定性考察。按“2.2.2”项处理后进样,记录待测物在0 h峰面积积分值0及其稳定性考察样品峰面积积分值S,计算S/0值。
2.6 药动学研究
6只健康SD雄性大鼠,给药前禁食12 h,自由饮水。给药前(0 h)经眼眶静脉取血500 μL/只。大鼠的等效剂量换算后,按2 mL/kg剂量经尾iv热毒宁注射液,并于给药后0.083、0.25、0.5、0.75、1、1.5、2、4、6、9、12、24 h经眼眶静脉丛取血200 μL于含肝素钠的EP管中,3000 r/min离心15 min,分离血浆至含少量-(+)-抗坏血酸及甲酸的EP管中,血浆样品中含有2% FA及0.2%-(+)-抗坏血酸(11.3 mmol/L),–80 ℃冻存待测。大鼠给药后2 h ig予0.9%氯化钠溶液3 mL,4 h后进食饮水。按“2.2.2”项方法处理样品后进样,测定各个时间点13个化合物的血药浓度,绘制药-时曲线。
2.7 药动学参数计算及统计分析
3 结果
3.1 方法学考察
3.1.1 专属性 6只不同大鼠混合空白血浆样品中内源性物质不干扰13个化合物测定,该方法具有良好的专属性。热毒宁注射液中13个主要成分GP、GPA、GPGS、SZS、CGA、NCGA、CCGA、ICGAa、ICGAb、ICGAc、SL、SLA、SWS及内标物氯霉素保留时间分别为4.41、2.13、3.93、2.07、3.59、2.62、4.02、6.07、5.79、6.82、4.65、4.23、4.49、7.80 min,见图2。
3.1.2 线性关系及LLOQ 大鼠血浆中13个化合物的线性方程、相关系数、浓度范围及LLOQ见表3。在浓度范围内,所有化合物均呈现良好的线性关系。
3.1.3 残留 该方法13个待测物成分经ULOQ进样后,在空白样本中残留均小于LLOQ的20%。CHL在空白样本的残留效应小于内标响应的5%。
3.1.4 准确度和精密度 13个化合物准确度偏差均在±15%,且批间、批内RSD<15%,符合生物样品分析的要求[31]。
3.1.5 回收率与基质效应 低、中、高浓度质控样品的ER良好,均大于83%,RSD<13%,未见内源性物质干扰检测,符合生物样本分析要求[31]。
3.1.6 稳定性考察 低、中、高浓度血浆质控样品在处理前样品室温放置24 h(处理1)、处理前样品−80 ℃反复冻融3次(处理2)、处理前样品–80 ℃保存60 d(处理3)、处理后样品室温放置24 h(处理4)、处理后样品进样盘放置24 h(处理5)、处理前样品稀释3倍(处理6)条件下稳定性良好,S/0值均大于92%,符合生物样品分析的要求。
3.2 热毒宁注射液在大鼠体内的药动学研究
健康SD大鼠尾iv热毒宁注射液后,在血浆中可检测到上述13个化合物,药-时曲线如图3所示,药动学参数见表4。给药后,13个化合物在血浆内即达到最高浓度,其中SLA在血浆中暴露量最大,其后药物浓度由高到低依次为GP、CGA、NCGA、CCGA、SL、GPGS、GPA、SWS、SZS、ICGAa、ICGAb、ICGAc,而后迅速下降,消除速率也各不相同。中药化合物在体内1/2较短,除GPA外,其他化合物在血浆中的1/2小于2 h,且各化合物在体内消除速率快。GPA在给药后15 min~2 h血药浓度变化平缓。咖啡酰奎宁酸类在体内消除最快,4 h已接近或低于其LLOQ(2 ng/mL)。CCGA在体内消除较NCGA快,6 h时间点采集的血浆样品中CCGA浓度接近LLOQ(10 ng/mL)。ICGAa的d最小为(777.04±285.38)mL/kg,SLAd高达(27 920.66±3 425.49)mL/kg,药物具有广泛组织分布。

左:空白血浆基质,中:血浆加对照品,右:血浆样品;图中出现多峰为同分异构体所致。GP、GPA、GPGS、SZS、CGA、NCGA、CCGA、ICGAa、ICGAb、ICGAc、SL、SLA、SWS及内标物氯霉素保留时间分别为4.41、2.13、3.93、2.07、3.59、2.62、4.02、6.07、5.79、6.82、4.65、4.23、4.49、7.80 min
Left: blank rat plasma; Middle: blank rat plasma add standard solutions; Right: rat plasma sample. Multiple peaks in the figure is due to isomers.Rof GP、GPA、GPGS、SZS、CGA、NCGA、CCGA、ICGAa、ICGAb、ICGAc、SL、SLA、SWS and CHL (IS) is 4.41、2.13、3.93、2.07、3.59、2.62、4.02、6.07、5.79、6.82、4.65、4.23、4.49、7.80 min, respectively
图2 13个化合物及内标UPLC-MS/MS色谱图
Fig. 2 UPLC-MS/MS chromatograms of 13 compounds and IS

表3 热毒宁注射液中13个化合物的线性关系及LLOQ

图3 13个化合物的平均血药浓度-时间曲线(n=6)

表4 13个化合物在健康SD大鼠体内的药动学参数()
4 讨论
热毒宁注射液中各化合物浓度差异较大,为保证同时且准确测定上述化合物含量,扩大各化合物的定量范围,无法采用统一浓度范围,故预先将混合对照品工作液中各化合物比例按照注射液中各化合物比例进行调整,设立了4种浓度范围以适应不同化合物在体内的浓度变化。
本实验对血浆样品中13个成分的提取方法进行了考察,结果发现甲醇沉淀蛋白效果优,内源性物质干扰小,重现性好,样品处理方法简单,适合大批量样品测定,测定结果符合实验要求。待测物中酚酸类化合物多,易被氧化及水解,由于其在酸性环境下稳定,分别考察在样品采集及处理过程中加入不同浓度的盐酸、甲酸、抗坏血酸对样品稳定性的影响,发现样品处理过程体系中维持0.5% FA及0.2%-(+)-抗坏血酸浓度样品稳定性最好。流动相选择方面,选择了纯水-乙腈、0.1%甲酸水-乙腈、0.1%甲酸水-0.1%甲酸乙腈、0.1%甲酸水-甲醇进行色谱条件考察,发现0.1%甲酸水-乙腈梯度洗脱方式条件下可以兼顾各化合物响应强度,峰形较优。由于待测物中绿原酸类(CGA、CCGA、NCGA)及咖啡酰奎宁酸类(ICGAa、ICGAb、ICGAc)存在同分异构体结构,加入0.1%甲酸有助于分离目标峰,改善了同分异构体的峰形。化合物GP、GPGS、SZS、SWS在测定高浓度样品后出现残留,未对精密度及准确度产生影响。13个化合物稀释稳定性良好,对超定量上限样品采用空白大鼠血浆1∶3稀释后复测方法可行。给药后大鼠血浆中均可检测到13个化合物,且浓度较高,药-时曲线完整,给药后血浆内各化合物AUC比例与注射液制剂中浓度比例接近(图4),说明其具有体外-体内传递过程的可测性。结合表观分布容积认为上述化合物主要分布在组织中(d>600 mL/kg)且有血浆-组织传递性,其靶部位传递过程及分布浓度有待进一步探索。
本研究采用UPLC-MS/MS法对热毒宁注射液13个潜在Q-Marker同时测定,灵敏性高、操作方便简单、检测迅速;化合物线性范围良好,方法学验证符合要求,为后续研究建立了高质量检测方法。13个化合物可在中药材、热毒宁注射液和大鼠血浆内检测到,适用于体内药动学研究,符合Q-Marker可测性要求,且具有药材-制剂-血浆-组织/靶组织传递性,为热毒宁注射液Q-Marker深入探索奠定了研究基础。

图4 注射液中13个化合物浓度(A) 与大鼠血浆内各化合物质量浓度(B)
利益冲突 所有作者均声明不存在利益冲突
[1] 杨秀伟. 基于体内过程的中药有效成分和有效效应物质的发现策略 [J]. 中国中药杂志, 2007, 32(5): 365- 370.
[2] 杨秀伟. 中药物质基础研究是中药继承、发展、创新的关键科学问题 [J]. 中国中药杂志, 2015, 40(17): 3429- 3434.
[3] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[4] 刘昌孝. 中药质量标志物(Q-marker):提高中药质量标准及质量控制理论和促进中药产业科学发展 [J]. 中草药, 2019, 50(19): 4517-4518.
[5] 李小宾. 热毒宁与头孢呋辛钠联用对急性上呼吸道感染患者的疗效及其对症状改善的影响 [J]. 抗感染药学, 2019, 16(1): 163-164.
[6] 仲晓菲. 分析热毒宁注射液治疗小儿急性上呼吸道感染的效果 [J]. 临床医药文献电子杂志, 2020, 7(1): 167.
[7] 邓耀先. 热毒宁注射液治疗小儿病毒性上呼吸道感染合并高热的疗效分析 [J]. 内蒙古中医药, 2020, 39(4): 58-59.
[8] 黎峦, 陈丽娜. 热毒宁注射液联合左氧氟沙星治疗老年糖尿病并上呼吸道感染的临床疗效 [J]. 临床合理用药杂志, 2019, 12(9): 68-69.
[9] 沈韬. 热毒宁治疗小儿急性上呼吸道感染伴发热的临床疗效 [J]. 临床医药文献电子杂志, 2019, 6(9): 153.
[10] 钟昊路. 热毒宁注射液治疗小儿病毒性上呼吸道感染的临床疗效分析 [J]. 中国医药指南, 2019, 17(21): 172-173.
[11] 魏晓婷. 干扰素联合热毒宁治疗手足口病的效果观察 [J]. 现代诊断与治疗, 2020, 31(16): 2541-2542.
[12] 殷铭东. 热毒宁联合干扰素治疗小儿手足口病的临床效果 [J]. 临床医学研究与实践, 2020, 5(34): 147-149.
[13] 黄胜贤, 罗杰平, 陈丽珍, 等. 热毒宁联合甘草酸苷对第2期手足口病患儿免疫相关指标的影响 [J]. 中华妇幼临床医学杂志: 电子版, 2020, 16(5): 567-573.
[14] 李燕京, 刘齐元, 马新红, 等. 热毒宁注射液联合消旋卡多曲治疗小儿病毒性肠炎的效果观察 [J]. 药物评价研究, 2020, 43(7): 1343-1346.
[15] 李迎吉. 热毒宁联合氨基酸注射液治疗轮状病毒性肠炎的效果 [J]. 系统医学, 2020, 5(10): 20-22.
[16] 秦娅蓝, 宋玉燕, 周璐, 等. 热毒宁联合甲泼尼龙治疗重症新型冠状病毒肺炎临床疗效评价 [J]. 中国药业, 2020, 29(9): 19-22.
[17] 付艳芳. 热毒宁注射液配合左氧氟沙星对老年社区获得性肺炎患者的临床疗效评价 [J]. 抗感染药学, 2020, 17(8): 1229-1231.
[18] 周巍. 热毒宁联合阿奇霉素治疗小儿支原体肺炎的效果 [J]. 中国民康医学, 2020, 32(22): 92-94.
[19] 卫慧, 赵蓓. 热毒宁辅助治疗AECOPD患者对血气、炎性指标的影响 [J]. 系统医学, 2020, 5(10): 141-144.
[20] Cheng C, Du F F, Yu K, et al. Pharmacokinetics and disposition of circulating iridoids and organic acids in rats intravenously receiving ReDuNing injection [J]., 2016, 44(11): 1853-1858.
[21] 吴莎, 王雪, 吴亚男, 等. UPLC用于热毒宁注射液中11种成分测定及其指纹图谱研究 [J]. 中国中药杂志, 2014, 39(24): 4804-4810.
[22] Wang Y J, Wen J, Zheng W H,. Simultaneous determination of neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid and geniposide in rat plasma by UPLC-MS/MS and its application to a pharmacokinetic study after administration of Reduning injection [J]., 2015, 29(1): 68-74.
[23] Wang Y, Wang Y, Wu X,Simultaneous determination of three di-caffeoylquinic acids by UHPLC-MS/MS in rat plasma and its application to a comparative pharmacokinetic study in normal and acute lung injury rat [J]., 2017, 1061/1062: 275-281.
[24] 崔小弟, 李执栋, 徐芳芳, 等. 热毒宁注射液多指标成分的一测多评法同时测定 [J]. 时珍国医国药, 2019, 30(5): 1116-1119.
[25] 彭任, 陆兔林, 胡立宏, 等. 中药饮片质量标志物(Q-marker)研究进展 [J]. 中草药, 2020, 51(10): 2603- 2610.
[26] Liu J L, Sun K, Zheng C L,. Pathway as a pharmacological target for herbal medicines: An investigation from reduning injection [J]., 2015, 10(4): e0123109.
[27] 杜叶青, 段治康, 董舒卉, 等. 基于网络药理学的金银花活性成分抗炎作用机制的研究 [J]. 中国药物化学杂志, 2019, 29(2): 96-102.
[28] Ma Y M, Zhang X Z, Su Z Z,Insight into the molecular mechanism of a herbal injection by integrating network pharmacology and[J]., 2015, 173: 91-99.
[29] 刘天亮, 董诚明, 齐大明. 基于中药质量标志物(Q-marker)的金银花指纹图谱体系的构建思路 [J]. 中草药, 2020, 51(1): 229-235.
[30] 史永平, 孔浩天, 李昊楠, 等. 栀子的化学成分、药理作用研究进展及质量标志物预测分析 [J]. 中草药, 2019, 50(2): 281-289.
[31] 中国药典 [S]. 一部. 2020: 466-472.
Simultaneous determination of 13 potential Q-Markers in Reduning Injection by UPLC-MS / MS in rats plasma and its application to a pharmacokinetic study in health rats
WANG Can1, WANG Bao-he2, HUANG Yu-hong2, LI Zi-qiang2, ZHANG Han1
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
Based on the concept of traditional Chinese medicine quality marker (Q-Marker), a method for simultaneous determination of 13 potential Q-Markers in plasma was established by ultra high performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The method was also used to determine the plasma concentration of 13 potential Q-Markers and their pharmacokinetics in health rats given Reduning Injection (热毒宁注射液) via tail vein in order to prove the detectability of transfer processand.Waters AQUITY UPLC C18column (100 mm×2.1 mm, 1.7μm) was used. The mobile phase was 0.1% formic acid water-acetonitrile gradient elution, the flow rate was 0.3 mL/min, the column temperature was 35℃, the temperature was 4℃, and the injection volume was 2 μL. Using chloramphenicol as an internal standard, 13 Q-Markers in plasma (geniposide, geniposidic acid, genipin-1-β--gentiobioside, shanzhiside, chlorogenic acid, neochlorogenic acid, cryptochlorogenic acid, isochlorogenic acid A, isochlorogenic acid B, 4, 5-dicaffeoylquinic acid, secoxyloganin, secologanic acid, and sweroside) were quantified simultaneously by using electrospray ion source (ESI), negative ion source, and multiple reaction monitoring (MRM).The non-compartment model was used to calculate the pharmacokinetic parameters in Phoenix WinNonlin8.1 software.The 13 compounds showed good linear relationship in the detection range. The recovery rate, matrix effect, precision, accuracy and stability of the method all match the requirements of biological samples detection. The results showed that the above 13 compounds could be detected in the plasma of rats injected with Reduning Injection via tail vein. The exposure concentration of secologanic acid was the highest, followed by concentration of geniposide and chlorogenic acid. All compounds owned short half-life and quick elimination rate, and large apparent distribution volume which indicated that they were widely distributed in tissues.The method can simultaneously quantify 13 compounds of Reduning Injection in plasma, which proves the detectability of the above components’ transfer process fromto. The pharmacokinetic study showed that the 13 compounds also had plasma tissue/target organ transfer property, which can be used as potential Q-Marker for safety and efficacy evaluation of Reduning Injection.
Q-Marker; Reduning Injection; UPLC-MS/MS; pharmacokinetics; geniposide, geniposidic acid, genipin-1-β--gentiobioside;shanzhiside; chlorogenic acid; neochlorogenic acid; cryptochlorogenicacid; isochlorogenic acid A; isochlorogenic acid B;4, 5- dicaffeoylquinic acid; secoxyloganin;secologanic acid; sweroside
R285.5
A
0253 - 2670(2021)09 - 2653 - 12
10.7501/j.issn.0253-2670.2021.09.016
2021-04-09
国家“重大新药创制”科技重大专项资助项目(2018ZX09734-002);天津市自然科学基金项目(18JCQNJC83800);天津市科技计划项目(17ZXXYSY00060)
王 璨,女,在读博士研究生,主要从事心脑血管疾病中医药防治、中药临床药理研究及中药临床评价工作。
王保和,男,主任医师,博士研究生导师。研究方向为心脑血管疾病中医药防治、中药临床药理研究及中药临床评价工作。
李自强,男,副研究员。研究方向为中药药动学研究。E-mail: lzqpharm@126.com
[责任编辑 王文倩]

