细胞焦亡相关因子在下咽鳞状细胞癌中的表达及意义
苟浩铖,范丽,李丽,李金泽,冯俊
(1.川北医学院 川北医学院第二临床医学院 南充市中心医院 耳鼻咽喉科,四川 南充 637000;2.川北医学院 川北医学院附属医院 病理科,四川 南充 637000;3.川北医学院第二临床医学院 南充市中心医院 泌尿外科,四川 南充 637000)
头颈部鳞状细胞癌5年生存率约为40%~60%,全球每年发病约为 60 万人[1-2]。下咽鳞状细胞癌(简称下咽鳞癌)是常见的头颈部癌症,晚期预后较差[3]。目前的治疗采用以手术、放/化疗为主,辅以分子靶向治疗及免疫治疗的综合治疗[4],晚期下咽癌手术治疗及保喉治疗的5年生存率无明显差异,均为38%~58%,有待提高[5]。细胞焦亡是一种由炎性小体通过gasdermins诱导的不同于细胞凋亡的程序性细胞死亡。细胞焦亡与动脉粥样硬化等心血管疾病及肝炎后的肝癌有明显的相关性[6-7]。细胞焦亡在不同肿瘤中扮演着不同的角色。在不同类型的肿瘤中,细胞焦亡被激活的机制不同,且其在肿瘤发生发展过程中的作用也不同,在与结肠炎相关的结肠癌中对肿瘤有抑制作用,但也能促进皮肤癌、乳腺癌的进展[8-9]。但是细胞焦亡是否参与下咽癌的发生发展尚未可知,本文应用免疫组化技术检测细胞焦亡相关因子半胱氨酸天冬氨酸蛋白酶1(Capase1)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-18(interleukin-18,IL-18)在下咽鳞癌中的表达,并对上述问题进行探讨。
1 材料与方法
1.1 患者资料及标本
收集川北医学院第二临床医学院及川北医学院附属医院2015年1月—2019年12月病理确诊为下咽鳞癌,并于本院进行手术治疗、且在病理科有完整的可用的石蜡标本患者共11例(其中2例无切缘)。11例患者均为男性,年龄43~70岁,平均年龄61岁,临床根据第八版美国癌症联合委员会(AJCC)下咽癌分期标准进行分期,T分期:T1期1例,T2期3例,T3期6例,T4期1例;无淋巴结转移4例,有淋巴结转移7例;临床分期:III期6例,IV期5例;高分化4例,中分化5例,低分化2例。将所有标本水平连续切成4 mm厚的石蜡切片,用于免疫组化染色。本研究通过我院伦理委员会批准通过。
1.2 试剂来源
Caspase1兔单克隆抗体购自Invitrogen公司。IL-1β兔多克隆抗体、IL-18兔多克隆抗体及山羊抗兔二抗均购自abcom公司。二甲苯、乙醇等均为国产。
1.3 方法
采用免疫组织化学染色。石蜡切片烤片后脱蜡水化,用高压修复法进行抗原修复,过氧化物酶阻断剂灭活过氧化物酶活性,滴加正常羊血清封闭液,滴加一抗后于4℃过夜;滴加生物素标记的二抗37℃摇床孵育1 h,DAB法显色3~8 min,在显微镜下掌握染色程度,苏木素复染5 min。用已知阳性组织切片作阳性对照,用磷酸盐缓冲液(PBS)作阴性对照。请两位病理科副主任医师依据许良忠教授提出的免疫组化结果判读标准[10],结合3种抗体着色强度及着色细胞数量对3种抗体的表达进行评定,评定结果有分歧者请第3位病理科副主任医师进行评定,取三者中相近的结果作为最终结果。评定结果分为阴性(-)、弱阳性(+)、中阳性(++)、强阳性(+++)。
1.4 统计学分析
实验数据用 SPSS 22.0 进行处理,通过秩和检验比较3种抗体在肿瘤组织及癌旁组织的表达。采用Spearman秩相关分析下咽鳞癌癌组织中Capase1与IL-1β、IL-18表达的相关性,以P<0.05为差异具有统计学意义。
2 结果
2.1 下咽鳞癌组织与癌旁组织中3种抗体的表达
11例下咽鳞癌组织及9例癌旁组织中3种抗体的表达见表1、图1~3,肿瘤组织中3种抗体表达高于癌旁组织,通过秩和检验分析,3种抗体在肿瘤组织及癌旁组织的表达差异具有统计学意义(P均<0.05)。
2.2 下咽鳞癌组织中3种抗体表达的相关性分析
采用Spearman秩相关分析方法分析Capase1与IL-1β、IL-18表达的相关性,结果见表2。结果表明Capase1与IL-1β、IL-18表达的相关系数均大于0.6,呈显著正相关,差异具有统计学意义(P均<0.05)。
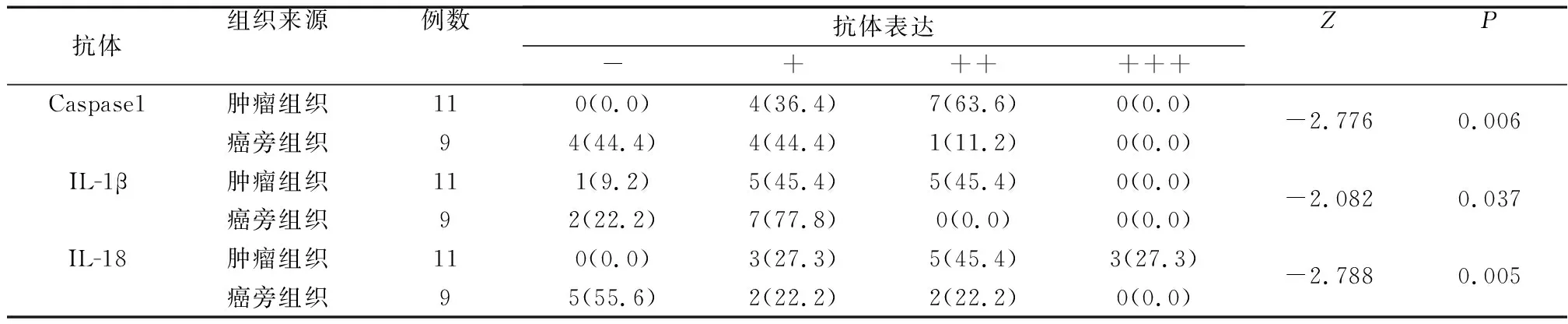
表1 下咽鳞癌组织与癌旁组织中3种抗体的表达 [例(%)]
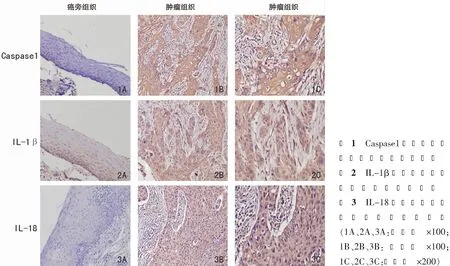
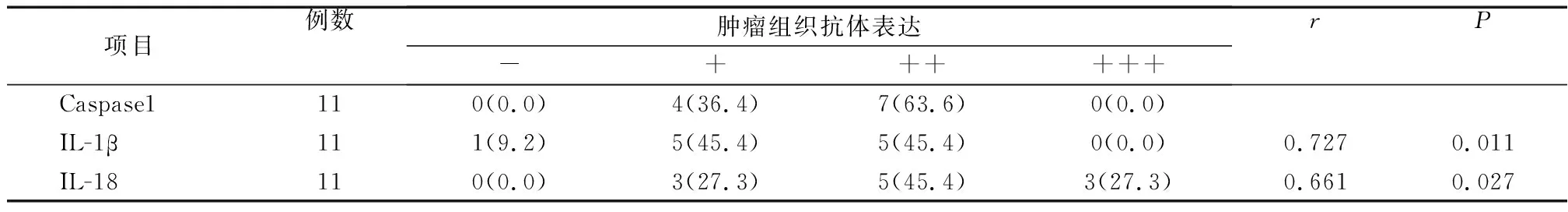
表2 肿瘤组织中3种抗体阳性率相关性分析 [例(%)]
3 讨论
细胞焦亡是由多种病原体或非感染因素刺激而导致的一种固有免疫反应,是细胞发生的一种依赖半胱天冬氨酸蛋白酶Caspase、炎症小体介导的一种程序性死亡[11],它通过清除细胞内复制龛和增强宿主的防御反应在清除各种细菌和病毒感染中发挥关键作用,细胞焦亡失调可能导致病原体清除效率降低,刺激适应性免疫防御功能紊乱,导致组织损伤[8]。故细胞焦亡可作为机体炎症坏死及免疫反应的发生机制之一参与炎性疾病及炎症相关肿瘤的发生发展。
焦亡细胞的特征是细胞膜孔隙形成、胞质膨胀、膜破裂,并将IL-1β等胞质内容物释放到细胞外环境中,放大局部或全身炎症效应[12-13]。研究者为证实细胞焦亡是否参与下咽鳞癌的发生发展,对下咽鳞癌及癌旁组织的细胞焦亡相关因子Capase1、IL-1β、IL-18进行免疫组化染色,并对其表达的相关性进行分析,结果表明Capase1、IL-1β、IL-18在肿瘤组织的表达高于癌旁组织,且在肿瘤组织中Capase1的表达与IL-1β、IL-18的表达呈显著正相关。实验结果符合细胞焦亡激活机制,在细胞膜上形成孔洞,细胞膜的完整性遭到破坏,引起细胞膜渗透性紊乱以及炎症因子IL-1β和IL-18 的释放,最终造成细胞裂解死亡[14-15]。这表明,细胞焦亡参与了下咽鳞癌的生物学进程。
IL-1β和IL-18与IL-1结构相似,是IL-1细胞因子家族中的一员,IL-1通过调节一些与肿瘤转移和血管生成的相关基因参与肿瘤进展[16-17]。IL-1β在肿瘤微环境中主要由肿瘤浸润的巨噬细胞产生,并通过多种机制促进肿瘤的生长和转移;包括通过增加IL-1靶点的表达促进血管生成,以及增加可在肿瘤相关成纤维细胞中引发抗凋亡信号传导的可溶性介质的表达等[18]。有研究表明,IL-1β刺激可增加肌成束蛋白表达,进而导致口腔鳞状细胞癌侵袭性增加[17]。就像炎症对于肿瘤细胞的作用具有两面性一样,IL-18对肿瘤细胞而言也是一把双刃剑。IL-18在免疫应答中的作用,主要是由干扰素-γ(interferon-γ,IFN-γ)的产生介导的,提示IL-18具有抗肿瘤作用,在动物癌症模型中,给予IL-18后肿瘤消退表明该细胞因子具有抗肿瘤特性;另一方面,IL-18在某些癌症患者的血清中高表达似乎是其癌前效应的线索,这种细胞因子通过抑制CD70来促进癌细胞逃离免疫系统,此外,IL-18可通过上调血管内皮生长因子(vascular endothelial growth factor,VEGF)和CD44促进癌症转移[19]。本实验研究表明,细胞焦亡释放的IL-1β和IL-18参与了下咽鳞癌的生物学进程,其在癌组织的高表达,至少可以说明在下咽鳞癌的某一进程中,炎症因子对下咽鳞癌的进展有促进作用。
细胞焦亡参与多种肿瘤的发生发展,但在不同的肿瘤及同一肿瘤的不同进程中,细胞焦亡都可能扮演着不同的角色。Wei等[20]研究表明,E2诱导的NLRP3炎症小体活化触发细胞焦亡,抑制肝癌细胞自噬;Yue等[21]研究表明花青素通过活化焦亡作用促进口腔鳞癌细胞的死亡,抑制肿瘤的进展,在另一方面,Guo等[22]的研究表明炎症因子IL-1β在促进乳腺癌的生长和转移中发挥着重要作用。但目前为止,细胞焦亡及细胞焦亡所释放的炎症因子在下咽鳞癌中的作用尚不清楚,其分子机制也有待进一步的实验研究。
当然,鉴于本研究样本量有限,可能增大实验结果误差,部分结果尚需进一步扩大样本量并反复验证以保证结果的有效参考意义。进一步深入的分子机制研究至关重要。探索是否可以通过某些药物作用于细胞焦亡相关分子靶标对细胞焦亡进行调控,以达到帮助治疗下咽鳞癌或判断其预后的临床目的。

