W3D通过调控TLR4/MD2-NF-κB p65信号通路改善LPS诱导的小鼠急性肺损伤
史新阳,高晓慧,赵 蓓,唐 莉,李青山,2
(1.山西医科大学药学院,山西 太原 030001;2.基于炎性反应的重大疾病创新药物山西省重点实验室,山西中医药大学,山西 太原 030024)
急性肺损伤(acute lung injury,ALI)是由创伤、感染等多种因素引起的疾病,临床表现主要有胸闷、气短、气促、咯血等,发展至严重阶段可导致急性呼吸窘迫综合征,病死率达30%-45%[1]。ALI的主要发病机制与过度失控的炎症反应,继而引起炎性细胞浸润及多种炎症因子过度表达密切相关[2]。作为革兰氏阴性细菌细胞壁主要成分的脂多糖(lipopolysaccharide,LPS),能够诱导TLR4/MD2-NF-κB信号通路活化,启动细胞内炎性信号的传导[3]而诱发炎症,其中TLR4/MD2复合体可特异性识别促炎信号LPS,激活NF-κB的入核,启动相关基因转录,合成促炎因子,诱发ALI。目前,ALI的治疗仍以舒血管药、抗氧化剂、糖皮质激素、抗炎药为主[4],其中抗炎药的应用在ALI治疗中占据重要地位,然而仅仅依靠使用一种或几种抗炎药物治疗尚难以有效遏制ALI的发生和发展[5]。因此,研发新型高效ALI治疗药物仍是目前亟待解决的重大课题。
苯并噁唑类化合物由于其所具有的多种生物学活性而成为新药设计合成中重要的医药中间体,其中以氯唑沙宗(5-氯-2-苯并噁唑酮)为代表的苯并噁唑酮类化合物则呈现出良好的镇痛作用,且大量文献已证明取代位置的差异会影响其生物活性,例如N-取代后,化合物往往呈现出抗结核分枝杆菌[6]、抗焦虑[7]、选择性激动毒蕈碱型m1受体[8]等活性,6位取代后化合物具有一定的细胞毒性,呈现出抗肿瘤潜力[9]。课题组以4位为衍生位点,设计合成了系列4-取代苯并噁唑酮衍生物[10-11],发现化合物4-(5’-二甲氨基)-萘磺酰氧基苯并噁唑酮(4-(5′-dimethylamino)-naphthalenesulfonyl-2(3H)-benzoxazolone,W3D)具有高效体外抗炎活性,其对LPS诱导的小鼠RAW264.7细胞NO的IC50值为17.67 μmol·L-1,对IL-6的IC50值为8.608 μmol·L-1,对IL-1β的IC50值为20.07 μmol·L-1,与临床用药塞来昔布活性(NO- IC50为17.89 μmol·L-1,IL-6- IC50为36.04 μmol·L-1,IL-1β- IC50为17.94 μmol·L-1)相当[12]。然而,化合物W3D能否改善LPS诱导的ALI,作用机制如何未知。本研究通过建立LPS诱导的ALI模型,测定小鼠肺部病理组织改变,血清中iNOS、TNF-α、IL-6、IL-1β的表达以及肺组织中TLR4、MD2、p-IRAK4、p65的表达来评价化合物W3D的抗ALI活性及其作用机制。
1 材料
1.1 试剂W3D(批号:20200520,山西医科大学药学院药物化学教研室提供,纯度≥98%);LPS(北京索莱宝科技有限公司);氯唑沙宗(批号:C10403818,麦克林试剂,纯度98%);TLR4抗体(Santa Cruz Biotechnology公司);MD2抗体(Abcame公司);MPO试剂盒(江苏晶美生物科技有限公司);HRP二抗、RIPA裂解液等其他试剂均购自武汉博士德生物工程有限公司。
1.2 动物健康ICR小鼠,雌雄各半,体质量(20±2)g,清洁级,购自山西医科大学实验动物中心,许可证号:SCXK(晋)2019-0004。饲养条件:25℃±2℃,自由进食饮水。
1.3 仪器全波长多功能酶标仪(美国Thermo公司);蛋白电泳仪、半干转膜仪、凝胶成像仪(美国BIO-RAD公司);TGL-16gP高速冷冻离心机(上海安亭科学仪器厂);漩涡混悬器(北京大龙仪器);702型超低温冰箱(美国Thermo公司);400S型超声波清洗机(深圳超洁科技实业有限公司);超纯水仪(力康集团);水浴锅(国华电器)。
2 方法
2.1 动物处理取48只ICR小鼠,随机分为对照组,模型组,氯唑沙宗组(12.5 mg·kg-1),W3D组(3.125、6.25、12.5 mg·kg-1),每组8只。4%水合氯醛麻醉小鼠后,除对照组气道滴入生理盐水外,其余各组按2.5 mg·kg-1剂量[13],于气道滴入LPS,4 h后给药,12 h后麻醉小鼠,放血处死取出肺脏。
2.2 小鼠肺湿干比计算取小鼠右肺组织,滤纸吸干表面水分称取湿重(wet wt,wwt),置50 ℃烘箱48 h至恒重,称取干重(dry wt,dw),计算肺湿干比(wet/dry ratio,wwt/dw)。
2.3 HE染色观察小鼠肺组织病理变化生理盐水洗净肺脏,去除血渍,并置于滤纸上吸干表面水分,剪下左上肺后固定,石蜡包埋,切片,HE染色,光镜下观察。
2.4 试剂盒法检测MPO活性取小鼠肺脏与生理盐水按体积比1 ∶9匀浆,并按照说明书操作,在450 nm处测定吸光度值,计算MPO活性。
2.5 ELISA法测定小鼠血清中iNOS、TNF-α、IL-6、IL-1β含量小鼠麻醉后,放血处死,血液室温放置1 h后,3 000 r·min-1离心15 min,取上清即得血清。按说明书操作测定小鼠血清中iNOS、TNF-α、IL-6、IL-1β的含量。
2.6 Western blot法检测TLR4、MD2、p-IRAK4、p65的蛋白表达取肺组织100 mg,RIPA提取总蛋白并定量,经SDS-PAGE电泳、转膜、封闭、一抗、二抗后成像,ImageJ软件分析灰度。

3 结果
3.1 化合物W3D对小鼠肺组织形态与肺湿干比的影响LPS造模后,与对照组相比,模型组小鼠肺组织明显水肿,并出现严重充血现象,W3D作用后肺组织水肿及充血现象较模型组明显减轻。肺组织湿干比结果如Fig 1所示,模型组较对照组相比湿干比显著提高,给药组湿干比明显降低,且呈一定的剂量依赖性,当给药剂量为6.25 mg·kg-1时即具有显著性差异。

Fig 1 Effects of compound W3D on lung wwt/dw ##P<0.01 vs control,*P<0.05 vs LPS group
3.2 化合物W3D对小鼠肺组织病理学的影响如Fig 2所示,对照组肺组织未见病理改变;模型组则出现局部肺泡腔结构不清,大量粒细胞浸润(红色箭头),局部出血(橙色箭头),血管损伤,平滑肌细胞胞核固缩深染等明显病理改变;氯唑沙宗组肺泡壁可见粒细胞浸润(红色箭头),肺组织局部肺泡壁增厚,部分平滑肌细胞胞核固缩深染,局部可见出血;W3D作用后,低剂量(3.125 mg·kg-1)组肺组织大面积肺泡壁增厚,肺泡腔结构不清,肺泡壁及肺泡腔内可见大量粒细胞浸润(黑色箭头),局部支气管周围轻度出血(黄色箭头),大量支气管上皮细胞肿胀,胞质呈空泡状,较模型组未见明显改善;中剂量(6.25 mg·kg-1)组肺泡腔大小不一,肺泡壁上可见大量粒细胞浸润(红色箭头),支气管损伤,少量上皮细胞坏死,胞核固缩,胞质呈空泡状(黄色箭头),肺组织局部肺泡壁增厚,较模型组有轻度改善;高剂量(12.5 mg·kg-1)组,肺组织支气管、肺泡壁等结构逐渐恢复清晰,较少粒细胞浸润(黄色箭头),无血管损伤及出血等现象,较模型组病理学切片有明显改善。
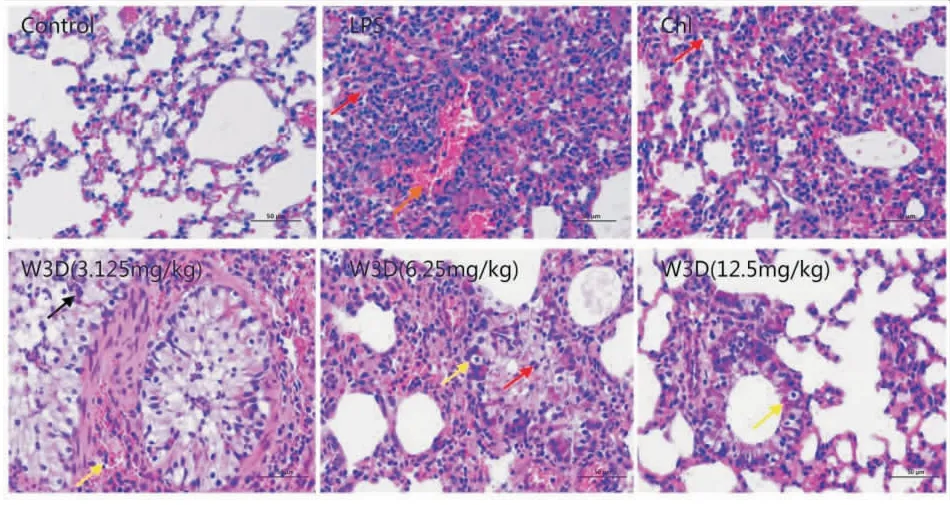
Fig 2 Effects of compound W3D on histopathological changes in LPS-induced lung tissues (×400)
3.3 化合物W3D对小鼠肺组织MPO活性的影响与对照组相比,LPS造模后MPO酶活性显著提高(Fig 3),W3D作用后MPO酶活性呈剂量依赖性降低,且当给药剂量为12.5 mg·kg-1时,较模型组具有显著性差异(P<0.01),且与氯唑沙宗组活性相当。

Fig 3 Effects of compound W3D on lung MPO n=3)##P<0.01 vs control,**P<0.01 vs LPS group
3.4 化合物W3D对小鼠血清中TNF-α、IL-6、IL-1β、iNOS含量的影响模型组TNF-α,IL-6,IL-1β,iNOS含量明显升高(Fig 4),化合物W3D作用后TNF-α,IL-6,IL-1β,iNOS呈剂量依赖性降低,尤其对TNF-α,IL-6和IL-1β的抑制活性明显优于氯唑沙宗组,差异具有显著性(P<0.05)。

Fig 4 Effect of compound W3D on TNF-α, IL-6,IL-1β,iNOS in mouse n=6)##P<0.01 vs control,*P<0.05 ,**P<0.01 vs LPS group
3.5 化合物W3D对TLR4、MD2、p-IRAK4、p65蛋白表达的影响模型组小鼠肺组织TLR4、MD2、p-IRAK4、p65蛋白水平与对照组相比明显增高;W3D作用后,TLR4、MD2和p65的蛋白表达明显降低,且IRAK4的磷酸化水平明显减弱,并呈现剂量依赖性(Fig 5)。

Fig 5 Effects of W3D on expression levels of relative proteins in LPS-induced ALIA:The Western blot results of protein TLR4,MD2,p-IRAK4,and p65;B:The relative quantity of TLR4,MD2,p-IRAK4,and p65 to that of β-actin (compared with the control group) n=3)##P<0.01 vs control,**P<0.01 vs LPS group
4 讨论
氯唑沙宗是一种经典的用于软组织损伤、筋膜炎等疾病的解热镇痛药物[14],其活性与有效抑制iNOS的表达密切相关。化合物W3D是以氯唑沙宗为骨架,经结构修饰后获得的新型苯并噁唑酮衍生物,且已证明其体外抗炎镇痛活性优于氯唑沙宗[15-16],但该类骨架结构化合物对于肺炎的治疗是否有效未见文献报道。因此,我们建立了LPS诱导的小鼠ALI模型,通过测定小鼠肺部病理组织改变以及血清中iNOS、TNF-α、IL-6、IL-1β的表达来评价化合物对ALI的治疗作用。结果显示氯唑沙宗与化合物W3D均可抑制血清中iNOS、TNF-α、IL-6、IL-1β的表达,改善ALI。同时实验结果也进一步验证了氯唑沙宗与iNOS的作用,较炎症因子TNF-α、IL-6、IL-1β,氯唑沙宗对iNOS的抑制作用更加明显,化合物W3D与氯唑沙宗相比,在具有同样高效iNOS抑制作用的同时,对炎症因子TNF-α、IL-6、IL-1β表现出了更为明显的抑制活性,尤其是对炎症因子IL-6的抑制活性(78.85%)与同等剂量的塞来昔布(34.06%)相比,表现出一定的治疗优势。
与此同时,我们发现该类结构化合物对MPO表现出显著的抑制作用,而MPO的表达与巨噬细胞释放炎症因子,如TNF-α、IL-6、IL-1β等,引起中性粒细胞的趋化和活化有关[17]。课题组前期已证实,化合物W3D可显著抑制LPS诱导的小鼠腹腔巨噬细胞RAW264.7炎症因子的释放,且其作用与调控TLR4-NF-κB信号通路相关[12]。本研究中再次测定了TLR4、MD2、p-IRAK4蛋白的表达,且结果显示化合物W3D可显著抑制肺组织中TLR4、MD2蛋白的表达,抑制IRAK4的磷酸化。作为NF-κB通路中重要的转录子,p65蛋白可与基因启动子或增强子特异性结合而启动转录,也是NF-κB信号通路激活的关键蛋白[18]。本研究也进一步证实了化合物W3D可剂量依赖性抑制p65蛋白的表达,结果与体外实验结果一致。我们的实验结果不仅证明了该类化合物可通过抑制iNOS发挥抗炎作用,也揭示了其对TLR4-NF-κB信号通路的调控是发挥活性的又一重要作用机制,为该类结构化合物的进一步结构优化提供一定的理论基础。
综上,本实验结果表明,化合物W3D可通过调控TLR4/MD2-NF-κB p65信号通路改善LPS诱导的小鼠急性肺损伤,而苯并噁唑酮结构具有成为ALI治疗药物研究重要骨架的潜力,为进一步抗ALI药物的研发提供了重要依据。

