新疆地区酒精依赖患者HTR3A 和HTR3B 基因多态性与 酒依赖的相关性分析*
赵志强,肖萌,苏莹,林凯,徐向东
(1.乌鲁木齐市第四人民医院成瘾医学科,新疆 乌鲁木齐 830002; 2.新疆大学软件学院,新疆 乌鲁木齐 830046)
根据世界卫生组织(WHO)2010 年的不完全统计,在世界大多数国家(53.9%)酒精是社会中最容易获得和滥用的物质,这一事实可能与酒精容易获得和合法使用的特点有关。酒精依赖症(AD)通常是由长期大量饮酒引起的中枢神经系统疾病,其临床表现主要为对酒精的过度渴求和需要饮酒的强迫性体验,并以身体对长期饮酒的自我调节为特征。它的发生与生物学、心理和社会环境密切相关,其中生物学因素可能是其产生的基础[1-4]。大量研究表明[5-6],酒精依赖患者在运动功能和记忆、注意、执行、社会认知等方面存在缺陷,从而给个体和社会造成严重负担[7-8]。因此,作为一个重要的公共卫生问题,我们必须进一步研究该病的病因和发病机制,以便进行有效的预防和控制。
大量研究证实[9-10],酒精依赖具有明显的遗传易感性。这些数据是通过双胞胎研究、寄养儿童研究以及神经生化研究获得的,这表明酒精依赖是一种复杂的多基因遗传病。研究发现,40%~60%的酒精依赖是由遗传因素造成的,男性的遗传能力远远高于女性[11]。研究还表明,酒精使用障碍的表型变异中有50%~60%与基因相关[12]。由此可见,遗传因素对酒精依赖的发生有着非常重要的影响。
随着分子遗传学的发展,对酒精依赖的易感基因或致病基因的相关遗传学研究迅速展开。目前,人们认为与酒精相互作用的主要神经递质包括血清素、多巴胺(DA)[13]、γ -氨基丁酸(GABA)和内源性阿片受体。这些参与酒精强化作用的各种神经递质相互作用影响大脑,其中5-HT 在酒精的奖励、偏好、依赖和渴求中起主要作用。
5-HT 在人脑中广泛分布,参与各种生理功能和病理状态的调节,包括睡眠、饮食、情感和精神。研究发现,血清素受体5-HT3 与酒精渴求、中毒、上瘾和其他酒精相关疾病有关。其中,我们发现酒精可以直接与5-HT3受体离子通道受体结合,在可引起中毒的浓度范围内增强离子电流[14]。Le 等人在对白色封闭群大鼠(Wistar)的研究中发现[15],在大鼠进行了12%的酒精自我训练28~31 天后,停药9~10 天后,在5-HT 拮抗剂预给药后,大鼠电击后的酒精自我给药明显减少。因此,酒精和5-HT3 受体的作用部位可能是治疗酒精依赖和其他物质成瘾的主要靶点。
SNP 在人类基因组学中广泛存在[16],由于其信息量大、易于自动检测和分析,已成为第三代遗传标记。SNP 是导致个体之间在疾病易感性和药物反应方面存在显著差异的主要原因之一。不同地区或种族的SNP在频率和类型上存在着实质性的差异,这意味着在一个特定群体的正常个体基因组中,任何SNP 的特定核苷酸位置具有不同的碱基,并且其最低等位基因频率不应少于1%[17-18]。大量的基因关联研究已经证实HTR3A 和HTR3B 与酒精依赖有关。Chamindi 和Bankole 等人研究发现rs10160548 和rs1176719 与物质成瘾及依赖有关,rs1176713 在欧美人群中与酒精依赖有关,HTR3A 基因上的rs176713、rs10160548、rs1176719 和HTR3B 基因上的rs4938056、rs3782025 对酒精依赖也存在影响[19-21]。
新疆地区人群长期生活在中国的西北地区,他们生活在古丝绸之路上,在欧亚大陆的人类迁徙和进化中发挥了重要作用[22]。基于现有理论,本研究旨在确定新疆地区酒精依赖患者HTR3A 和HTR3B 的基因多态性,以进一步探讨5-HT 相关基因在酒精依赖中的作用。基因在酒精依赖中的作用,为进一步的基因研究和酒精依赖的精确治疗提供了理论基础。
1 材料和方法
1.1 研究人群
我们选取了2018 年1 月—12 月在新疆精神卫生中心(乌鲁木齐市第四人民医院)成瘾医学科住院的199例患者。参与本次调查的患者均为男性,符合《国际疾病及相关健康问题统计分类(第10 版)》“酒精使用 障碍引起的心理和行为”诊断标准。所有被试年龄在18 岁以上,文化程度在初中以上,能够充分理解问卷的相关内容并能够在没有帮助的情况下完成评估。我们排除了患有器质性精神障碍的患者和无法合作完成此评估的患者。正常对照组为18~60 岁的健康男性志愿者。他们同意参与研究,签署书面知情同意书,并使用随机抽取的审计量表评估(AUDIT)酒精滥用或依赖的严重程度(少于8 分除外)。排除标准如下:患有严重的 心、肝、肾、内分泌和其他身体疾病的患者;患有严重精神障碍和其他脑器质性精神障碍的患者;具有导致退缩或无法完成调查的所有其他因素的患者。
调查和随访的结果基于患者参与的原则,获得患者或患者监护人的知情同意,并签署知情同意书。本研究经新疆精神卫生中心医学伦理委员会批准。
1.2 数据收集
本研究血样及一般人口社会学调查均由新疆精神卫生中心(乌鲁木齐市第四人民医院)成瘾科医务人员独立完成。每个研究对象均提供3~5 ml 外周血样本,并且均同意研究目的和实验程序。研究方案是根据赫尔辛基宣言进行的,并得到了医院人类研究委员会的批准。
1.3 SNP 选择和基因分型
在查阅了之前的文献报道和NCBI 搜索后,我们从研究中总共选取了20 个SNP 进行遗传分析。 它们位于HTR3A 和HTR3B 基因中,并且具有最小的等位基因频率(MAF>5%)。使用GoldMag®反粒子法(中国西安金磁有限公司),根据说明书从血液中提取基因组DNA 样本,使用Nano drop 2000C 测定DNA 浓度(Thermo Scientific, Waltham, USA, Massachusetts)。 使用Sequenom MassARRAY Assay Design 3.0 软件(美国加州圣地亚哥)设计多SNP MassEXTEND 分析。使用Sequenom MassARRAY RS1000 对SNP 基因型进行分型(美国加州圣地亚哥),使用Sequenom Typer 4.0 软件(美国加州圣地亚哥)进行数据管理和分析。
1.4 数据分析
我们使用Microsoft Excel(Redmond,华盛顿,美国)和SPSS 19.0 统计软件包(SPSS 在芝加哥,伊利诺伊州,美国)进行所有的统计分析。所有统计检验均为双相检验,并且P ≤0.05 被认为具有统计学意义。使用对照之间的精确测试来评估每个tSNP 频率是否偏离哈迪-温伯格平衡(HWE)(P>0.05),我们利用χ2检验比较病例和对照组之间的基因型频率和等位基因频率。为了估计遗传多态性和酒精依赖风险之间的关系,我们使用了无条件逻辑回归,并根据年龄和性别进行了调整,估计了比值比(OR)和95%置信区间(CI)。在对照中,调用最常见的基因型作为参考等位基因。我们使用多元逻辑回归模型(共显性、显性、隐性、过显性和加性)来评估某些SNP 与酒精依赖之间的关联。
2 结果
2.1 一般人口统计特征和哈迪-温伯格平衡
共有396 名受试者参与了调查和研究,均符合条件并参与到研究结束。病例组平均年龄为(42.51±10.36)岁,对照组平均年龄为(42.15±9.08)岁。在对所有位点进行哈迪-温伯格平衡定律分析后,P 值均大于0.05(表1)。研究对象的基本特征均记录。两组之间在年龄分布或受教育程度方面无显著差异,但是婚姻状况存在显著差异。
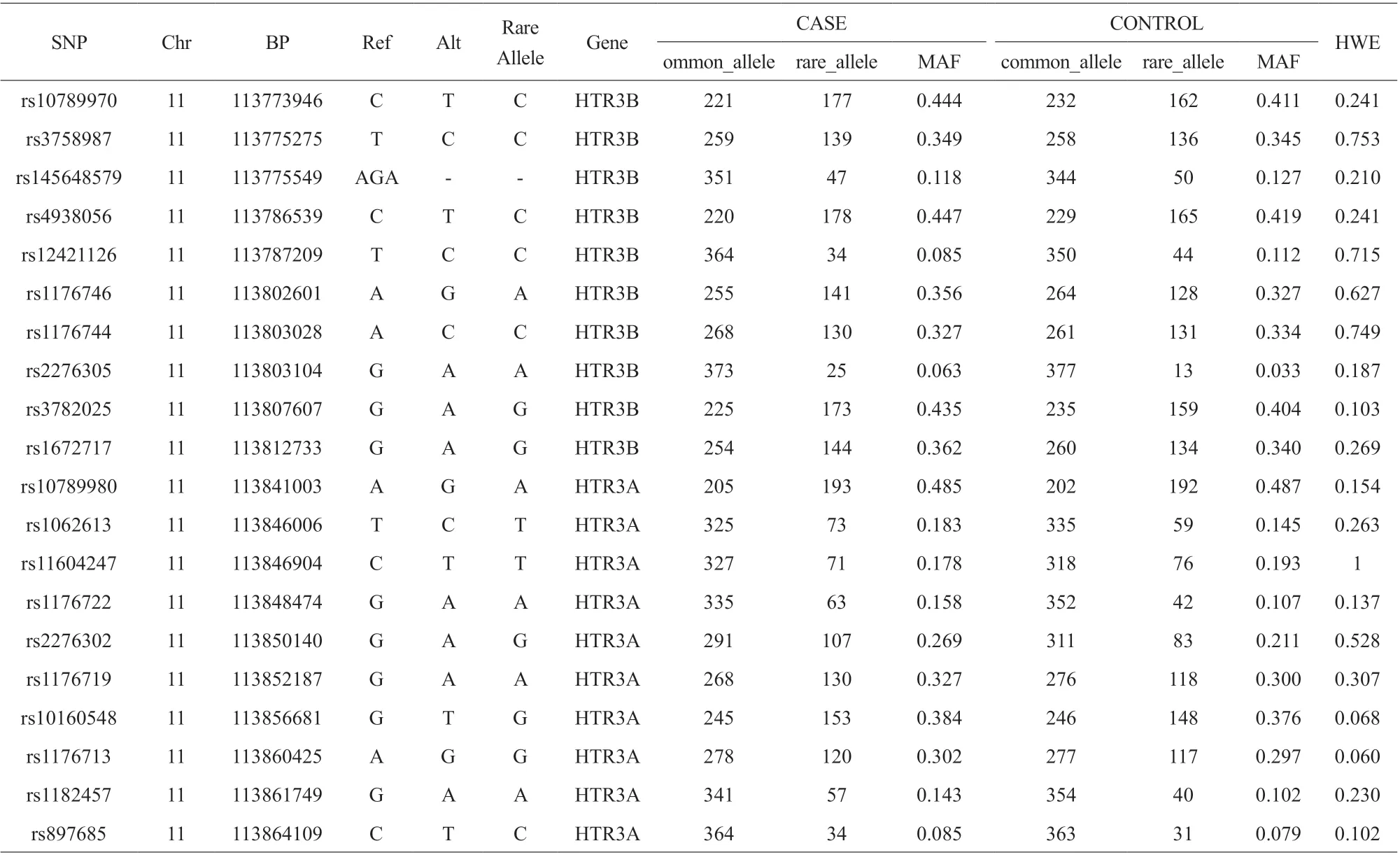
表1 关于SNP 的HWE 结果和基本信息
2.2 SNP 与酒精依赖风险之间的联系
野生型等位基因相对于每个SNP 的次要等位基因是危险因素。使用χ2检验,有三个SNP 被认为与酒精依赖的发生率显著相关。在基因型模型中,rs10160548与酒精依赖风险显著相关(P=0.014);在显性模型中,当个体的rs2276305 携带“A”等位基因时,酒精依赖的风险增加(OR=2.09, 95%CI=1.02-1.31, P=0.042)。Rs1176722 可能是酒精依赖风险增加的位点(等位基因模型:OR=1.58, 95%CI=1.04-2.40, P=0.032)(表2)。经过Fisher 检验,rs10160548 和rs1176722 与酒精依赖风险之间的相关性仍然显著(表3)。其他与酒精依赖风险无显著相关性的SNP 结果另表记录。
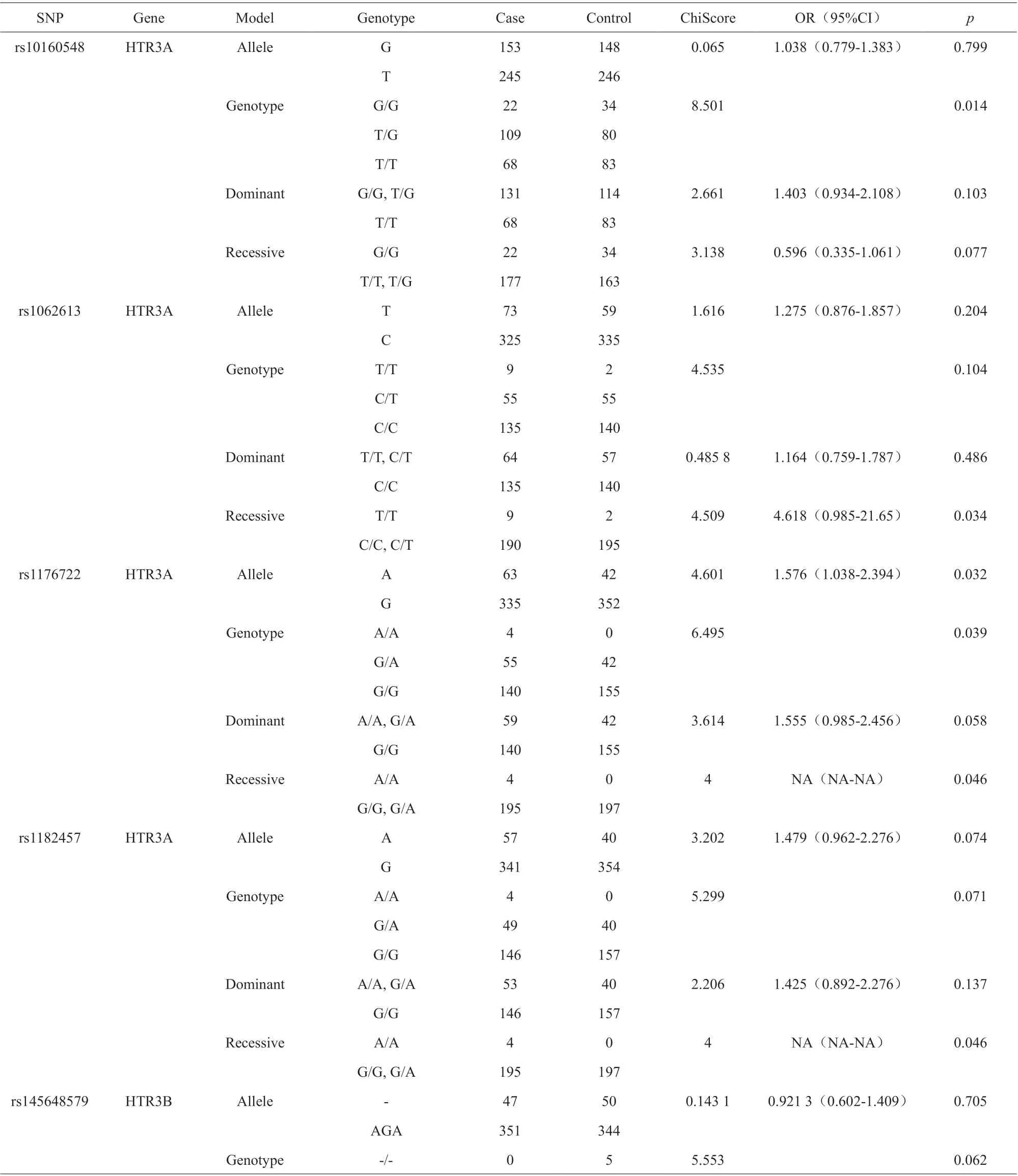
表2 SNP 等位基因和基因型模型的卡方检验结果
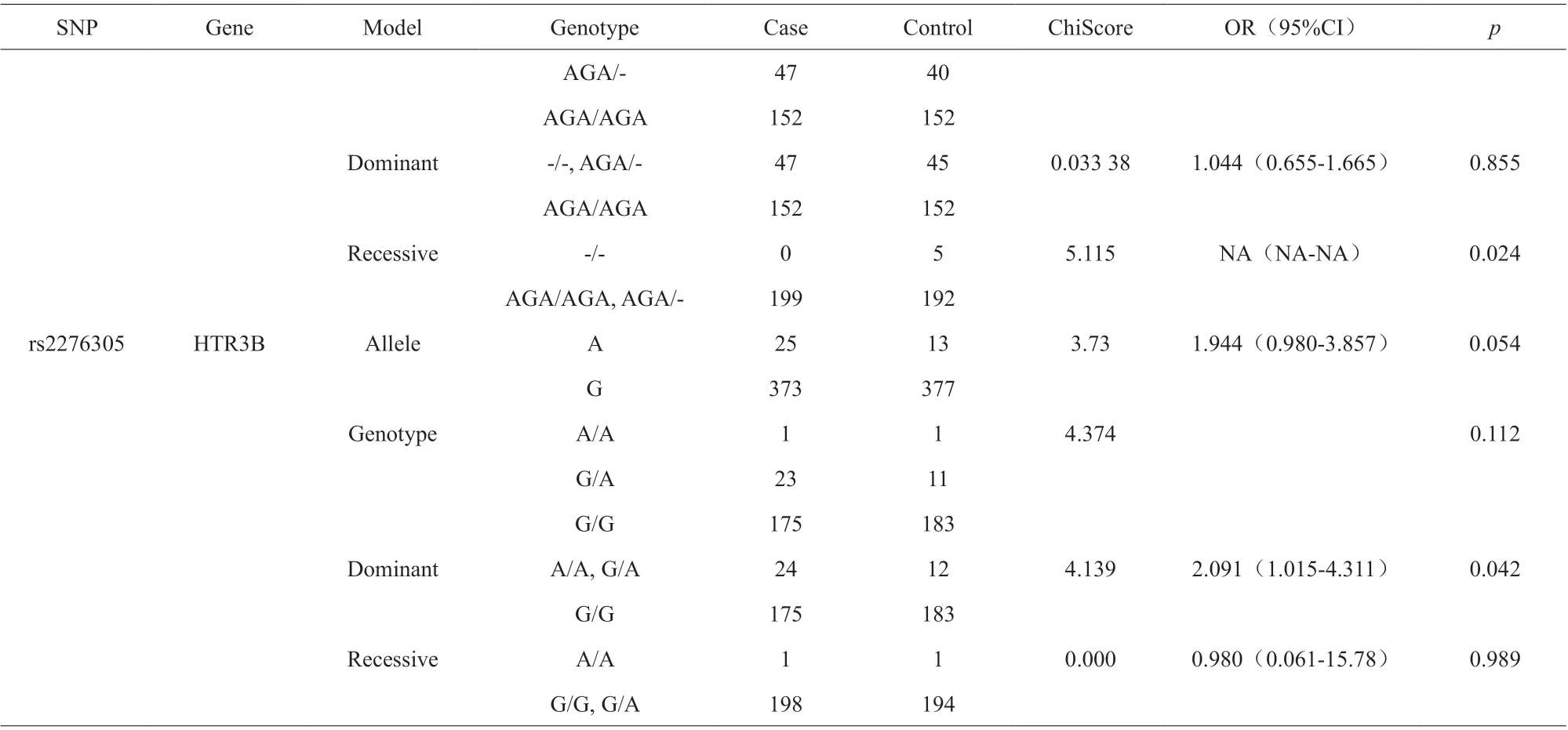
续表

表3 Fisher 检验后SNP 等位基因和基因型模型的卡方检验结果
2.3 SNP 与酒精依赖风险之间的逻辑模型分析
我们进一步评估了20 个SNP 在5 个逻辑模型(等位基因、显性、隐性、基因型和加性)中酒精依赖的风险(表4)。基因型为GT 的Rs10160548 增加了基因型模型中酒精依赖的可能性(OR=1.66, 95%CI=1.08-2.56, P=0.021)。对于A 等位基因,rs1176722 在等位基因模型中(OR(95%CI)=1.576(1.038-2.394), P=0.033),在加性模型中(OR(95%CI)=1.63(1.055-2.517), P=0.028)增加了酒精依赖的风险。Rs2276305 在基因型模型(GA 基因型:OR(95%CI)=2.186(1.035-4.619), P=0.040)和显性模型(AA/AG, OR(95%CI)=2.091(1.015-4.311), P=0.046)中与酒精依赖有显著相关性。经过逻辑模型校正分析,这三个SNP 的相对疾病风险仍然存在(表5)。
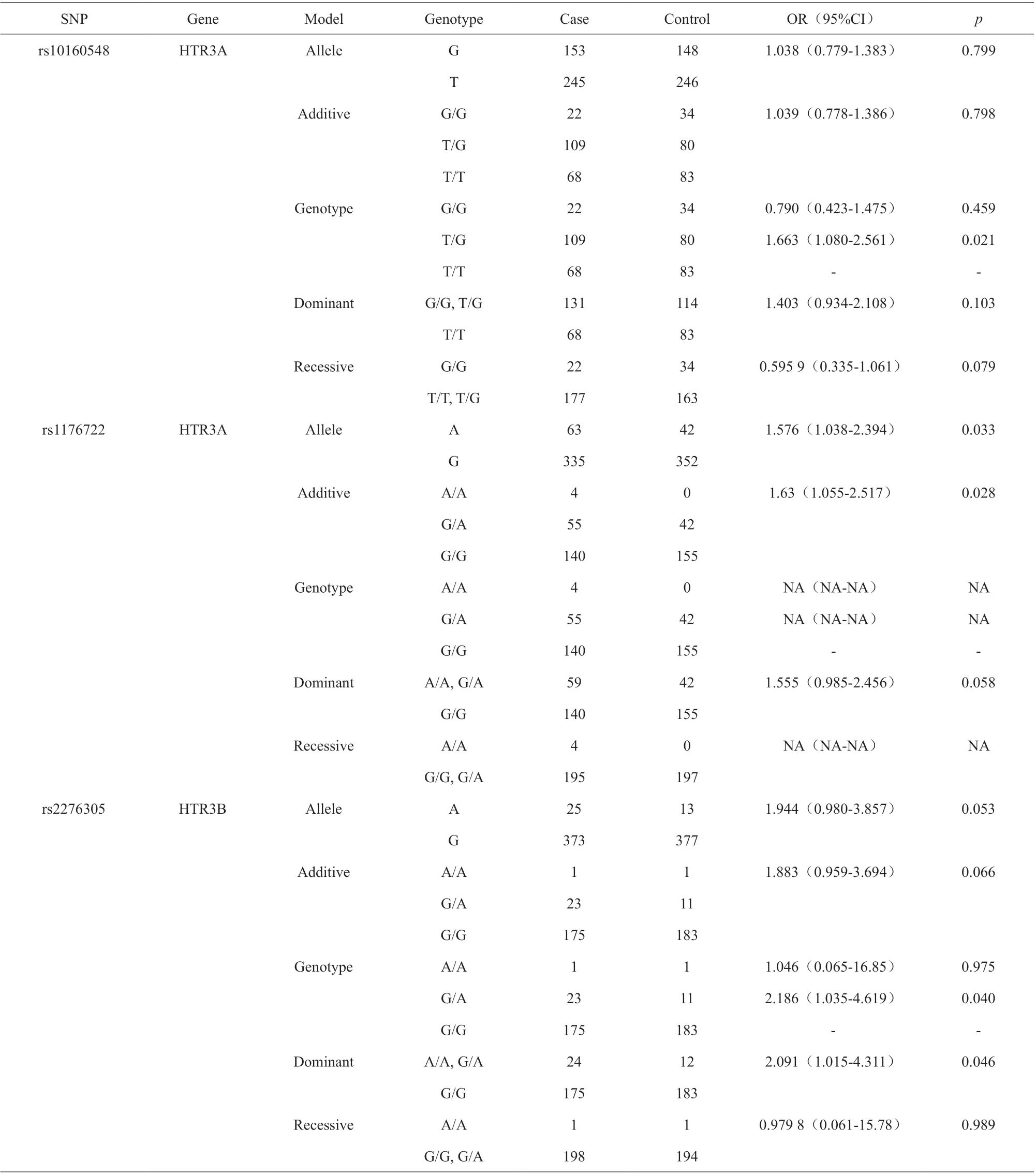
表4 Logistic 回归模型中与AD 相关的SNP 的Logistic 分析
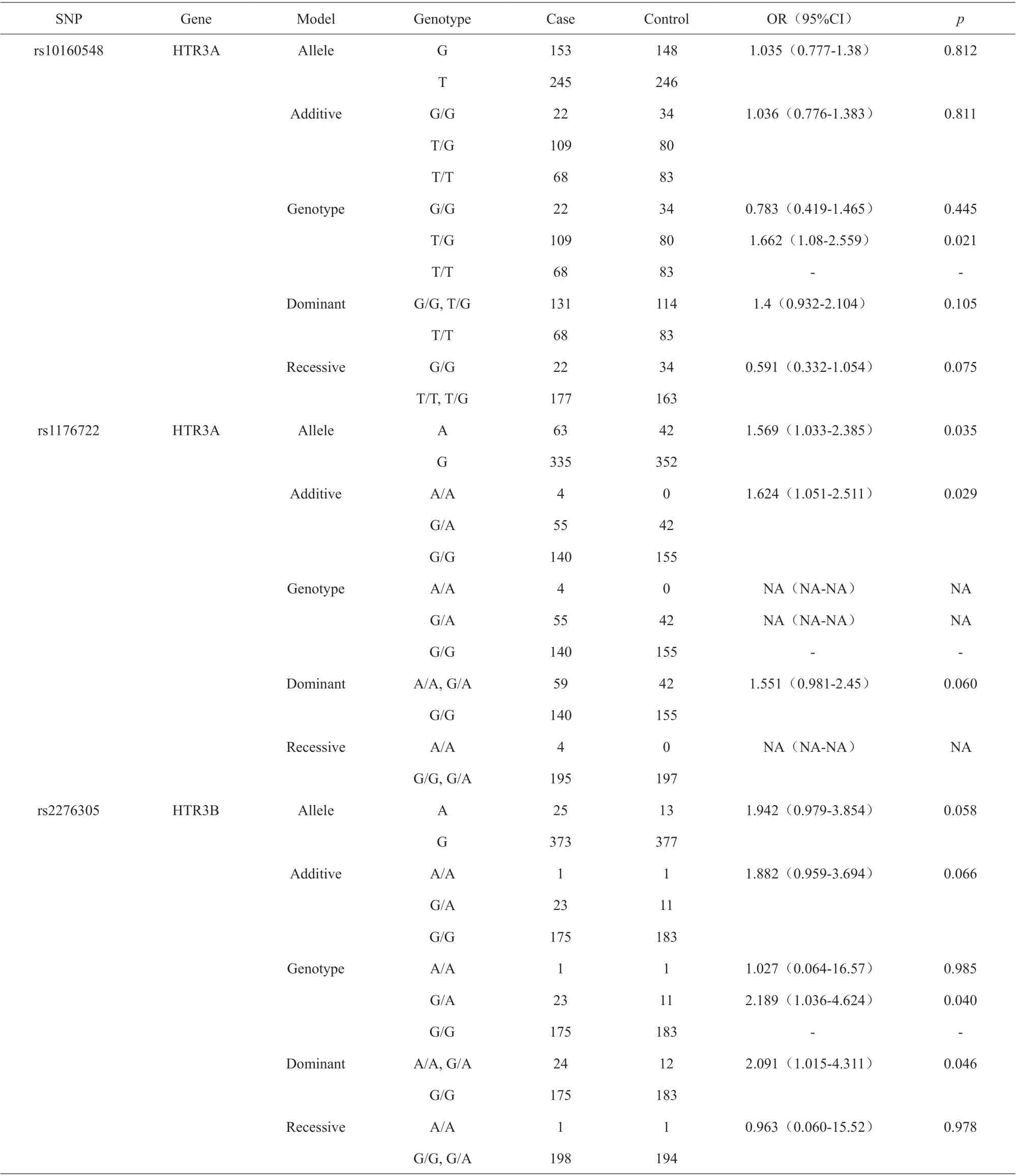
表5 校正后Logistic 回归模型中与AD 相关的SNP 的Logistic 分析
3 讨论
我们探索了新疆地区人群中HTR3A 和HTR3B 基因的SNP 与酒精依赖风险的相关性。我们的研究支持了5-HT 在酒精依赖的发病机制中起重要作用的观点。我们发现HTR3A(rs1176722 和rs10160548)和HTR3B(rs2276305)与新疆地区患者的酒精依赖显著相关,这表明HTR3A 和HTR3B 可能参与了这些个体的遗传易感性。
Rs1176722(IVS1-19G>A)位于HTR3A 基因序列的内含子区域[22]。我们的研究显示,病例组与对照组之间存在显著差异,HTR3A 是发现的第一个5-HT3 受体亚基。它最早由Maricq 等人于1991 年从仓鼠胚胎脑细胞和成神经细胞瘤小鼠的杂交细胞系NCB-20 中克隆出来[23]。HTR3A 基因跨度约为15 kb,包含9 个外显子,大小在45~845 bp 之间,通过编码标准的5-HT3A亚基,我们观察到该亚基由478 个氨基酸组成[24]。另有研究报道HTR3A 基因序列位于染色体11q23 上[25]。在本研究中,该部位显著增加了酒精依赖的风险。为了进一步研究其功能,有必要在大样本中进一步验证这一发现。由于rs1176722 不参与内含子区域蛋白的直接表达,因此有必要对其可能的调控机制进行研究。我们发现Rs10160548 的G 等位基因与新疆地区个体对酒精依赖的易感性有关,该位点位于HTR3A 基因的第6 个内含子与外显子连接的位置,可以通过改变基因的剪接位置来研究其对疾病的影响。在以前涉及该方面的研究 中[26],通过相同的机制导致非洲裔美国人对烟草的依赖程度增加,该结果得到了本研究的支持。
我们研究的第三个主要发现是HTR3B 基因5 外显子的低频同义变体rs2276305 与酒精依赖显著相关。在全球范围内,很少有关于rs2276305 与酒精依赖之间关系的分析。在一些关于尼古丁和酒精依赖的研究中,HTR3B 基因rs2276305(A/G)多态性与成瘾、依赖的严重程度和某些症状有关[27]。
我们首次发现HTR3A 和HTR3B 与新疆地区人群酒精依赖的发生密切相关,它们位于染色体11q23 上。关于HTR3A、HTR3B 与酒精依赖之间关系的研究并不多,在一些研究中,已经发现酒精通过增加组蛋白脱羧酶活性而增加5-HT3 受体的基因表达。其他研究发现,长期饮酒会影响HTR3A 等基因的甲基化水平。一些研究还发现[28-29],在酒精依赖患者中,HTR3A 和HTR3B基因突变与酒精使用障碍和反社会人格障碍有关。结合我们对酒精依赖的发病机理的研究,我们推断HTR3A和HTR3B 在酒精依赖的发病机理中起关键作用。
4 结论
我们对新疆地区人群中HTR3A 和HTR3B 基因SNP 与酒精依赖关系的初步研究表明,rs10160548、rs1176722 和rs2276305 与酒精依赖的风险有关。虽然本研究取得了一些预期的结果,但仍存在一些局限性。首先,作为基因SNP 的病例对照关联分析,本研究的样本量相对较小。其次,酒精依赖者和健康对照者在年龄和受教育程度方面无统计学差异,但是婚姻状况的差异具有统计学意义。最后,我们选择了20 个SNP 位点进行关联分析。虽然它们经过筛选并结合先前文献报道被选择为SNP 位点,但不足以反映全部基因信息。
本次研究样本量较小,所入组的患者也均为男性,故存在样本量偏移的问题,加之观察时间尚短,还需要进一步扩大样本量、多中心、长病程的完善相关实验。
利益竞争声明
作者声明,他们没有已知的可能影响这篇论文所报道的工作的相互竞争的经济利益或个人关系。
致谢
本研究工作得到了新疆维吾尔自治区乌鲁木齐市科技计划(Y16130026)支持

