自然四倍体泥鳅雄核发育二倍体染色体组构成研究
陈琦,孙雨晴,郑欣宜,山谷,李雅娟,曹小娟,朱新平,周贺*
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023; 2.华中农业大学 水产学院,农业农村部淡水生物繁育重点实验室,农业动物遗传育种与繁育教育部重点实验室,池塘健康养殖湖北省工程实验室,湖北 武汉 430070; 3.中国水产科学研究院珠江水产研究所,广东 广州 510380)
雄核发育是指通过用放射线照射或其他方法完全使卵核的遗传物质失活,仅把卵子作为营养源,依靠精子由来的精核发育成胚胎的现象[1]。由于雄核发育仅含有来源于父本的一套染色体组即单倍体,鱼类单倍体虽能较好地通过胚胎发育,但到孵化期或孵化后数天,就会因“单倍体综合征”而陆续死亡,因此,需要染色体加倍。现有染色体加倍的主要方法是利用温度、压力刺激或化学诱变剂阻止第一次卵裂,但所获得二倍体存活率极低。若用四倍体个体的精子(2n)使遗传失活的卵子“受精”,染色体不用加倍可以直接获得能正常发育的雄核发育二倍体后代。但人工诱导鱼类四倍体难度大,如果某种鱼类存在自然四倍体,则是解决染色体加倍难的最好方法。据报道,中国长江流域存在大量的自然四倍体泥鳅Misgurnusanguillicaudatus,研究发现,其是含有4套染色体组的遗传四倍体(4n=100),是同源四倍体,能产生正常的2n配子(雌或雄)[2-4]。本研究室林忠乔等[5]利用冷休克方法诱导自然四倍体泥鳅雄核发育二倍体,有效解决了诱导鱼类雄核发育二倍体的瓶颈,具有良好的应用前景。
无论是采用物理方法还是化学方法人工诱导雄核发育,由于遗传失活卵子的处理并非百分之百成功,因此,雄核发育的倍性检测和鉴定是判断诱导成功与否的重要环节。鱼类上常用的倍性鉴定方法有形态学鉴别、染色体核型分析、受精细胞学检测、同工酶鉴定及分子标记等,其中,染色体核型、Ag-NORs及荧光原位杂交(FISH)是雄核发育后代倍性鉴定最直接和最准确的方法,但目前鱼类雄核发育染色体鉴定方面还未见报道。因此,本研究中以自然四倍体泥鳅为父本,二倍体泥鳅为母本进行杂交,通过冷休克处理受精卵诱导雄核发育二倍体,并对其后代的染色体核型、Ag-NORs带型及荧光原位杂交(FISH)信号等进行研究,旨在探索鱼类雄核发育新途径及自然四倍体泥鳅所产生的配子染色体组构成,并为四倍体雄性泥鳅是具有4套染色体组的遗传四倍体提供遗传学证据。
1 材料与方法
1.1 材料
试验用二倍体泥鳅(雌)取自大连市农贸市场,自然四倍体泥鳅(雄)取自湖北省赤壁市,暂养于大连海洋大学细胞遗传功能实验室水族箱中。挑选发育良好的二倍体雌鱼、四倍体雄鱼各1尾作为亲本,二倍体雌鱼体长为14.1 cm,体质量为17.3 g,四倍体雄鱼体长为16.5 cm,体质量为29.6 g。亲本的倍性经流式细胞仪检测确定。
1.2 方法
1.2.1 人工催产及授精 杂交前一天晚间注射催产素绒毛膜促性腺激素(HCG),二倍体雌鱼注射剂量为 20~25 UI/尾,四倍体雄鱼剂量减半,12 h后用稀释1 000倍的苯甲醇将泥鳅麻醉,待雌鱼麻醉后,挤卵并收集到铺有保鲜膜的9 cm培养皿中,用毛细管收集精液于1.5 mL塑料离心管中(用精子稀释液稀释100倍),干法授精(2n×4n)。
1.2.2 冷休克诱导雄核发育 具体方法参照本实验室筛选出的诱导自然四倍体泥鳅雄核发育二倍体各因素的最优水平组合进行[5],即受精后5 min,将一部分受精卵放入3 ℃冰水中,处理60 min。冷休克解除后将受精卵放回到(20±1)℃的曝气水中进行孵化。未进行冷休克的一部分受精卵作为对照组(2n×4n)。
1.2.3 血红细胞核体积测量 用苯甲醇稀释液(1 mL/L)麻醉鱼,抽血少许,迅速滴在载玻片上。风干后滴一滴甲醇于载玻片上,之后用体积分数10%的吉姆萨染色 5 min,自然风干后显微拍照。随机测量 50 个血红细胞核的长径(a)和短径(b),结果以平均值±标准差 (mean±S.D.) 表示,细胞核体积(V)按下式计算:
V=4/3×π (a/2)×(b/2)2。
1.2.4 单个胚胎染色体标本制备 取发育至肌肉效应期的胚胎处理组和对照组各30个,剥去卵膜和卵黄,用质量分数0.002 5%的秋水仙素处理45 min,质量分数0.8%的柠檬酸低渗20 min,再用预冷的卡诺固定液(甲醇与冰醋酸的体积比为3∶1)固定3次,每次15 min,最后于-20 ℃冷冻过夜。单个胚胎冷滴片,过火,风干。一部分用质量分数10%的吉姆萨染色45 min,在普通光学显微镜下镜检,油镜下拍照。一部分白片用于Ag-NORs和FISH。
1.2.5 染色体核型分析 分别选取对照组杂交三倍体和处理组雄核发育二倍体中分散均匀、染色清晰、无重复的中期分裂相各5张,测量其长臂和短臂的长度,计算相对长度和臂比,参照Levan等[6]的方法进行核型分析。
1.2.6 Ag-NORs分析 参考Howell等[7]的快速银染法,取100 μL质量分数50%的硝酸银与50 μL质量分数2%的明胶混匀后滴在染色体标本上,加上盖玻片,70 ℃下处理 2 min,用同样温度的水进行冲洗,自然干燥后镜检、拍照。
1.2.7 FISH分析 以人的5.8S+28S rDNA为探针,采用生物素(Biotin-16-dUTP)进行标记。标记后的探针用混合纯化液进行纯化。将纯化后的探针在75 ℃恒温水浴10 min进行变性;染色体玻片在65 ℃干燥箱烘干2~3 h,干燥后的染色体玻片浸在70 ℃体积分数70%的甲酰胺/2×SSC变性液中变性2 min。已变性并脱水的染色体玻片标本上加50 μL变性探针-杂交溶液混合液。盖上封口膜置于2×SSC湿盒中,37 ℃下杂交18 h以上。杂交结束后置于洗脱液中洗脱,杂交信号检测和放大,复染和封片,用Leica DM2000荧光显微镜观察杂交信号,用Leica DF 450C CCD装置捕获图像,用Leica和Photoshop软件进行图像处理。
2 结果与分析
2.1 血红细胞核体积
泥鳅血红细胞呈椭圆形,核位于细胞中央,近椭圆形。对照组杂交三倍体泥鳅血红细胞核体积为(38.29 ±3.14)μm3,处理组雄核发育二倍体泥鳅血红细胞核体积为(27.92±3.58)μm3(表1,图1),杂交三倍体与雄核发育二倍体泥鳅血红细胞核体积之比为1.37∶1,符合三倍体与二倍体血红细胞核体积比1.5∶1。这表明,处理组雄核发育的染色体组构成为二倍体。

表1 对照组和处理组血红细胞核测量结果
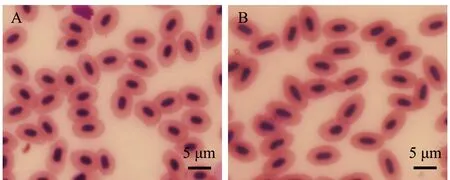
A—对照组杂交三倍体泥鳅;B—处理组雄核发育二倍体泥鳅。A—hybrid triploid in control group; B—androgenic diploid in treatment group.图1 杂交三倍体泥鳅和雄核发育二倍体泥鳅的红细胞Fig.1 Erythrocytes of hybrid triploid loach and androgenic diploid loach
2.2 染色体核型分析
对照组杂交三倍体泥鳅胚胎染色体数目为3n=75,核型公式为15m+6sm+54t,NF=96(表2,图2A、B);处理组雄核发育二倍体泥鳅胚胎染色体数目为2n=50,核型公式为10m+4sm+36t,NF=64(表2,图2C、D)。
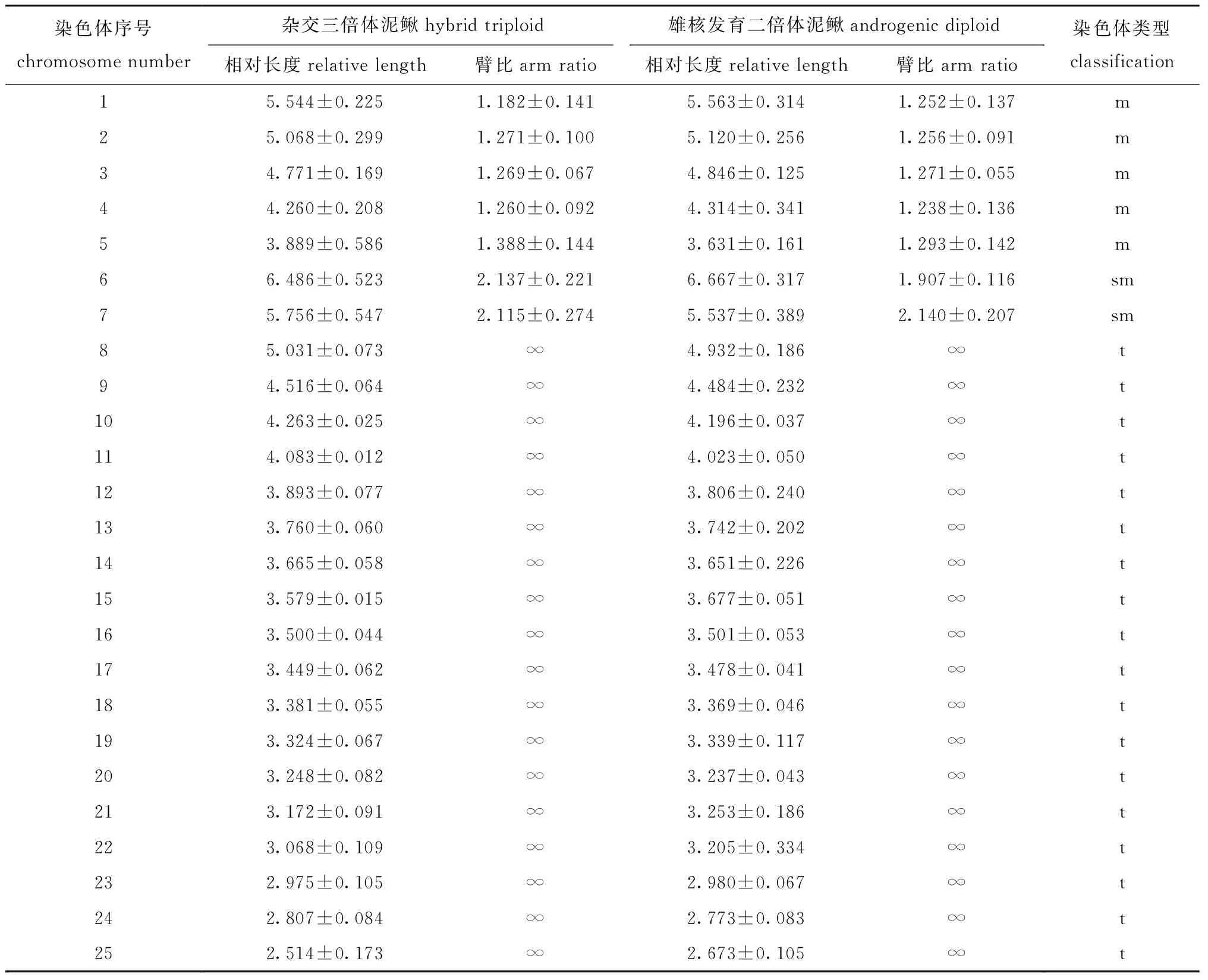
表2 杂交三倍体泥鳅和雄核发育二倍体泥鳅的染色体核型数据Tab.2 Indices of karyotype analyses in hybrid triploid loach and androgenic diploid loach
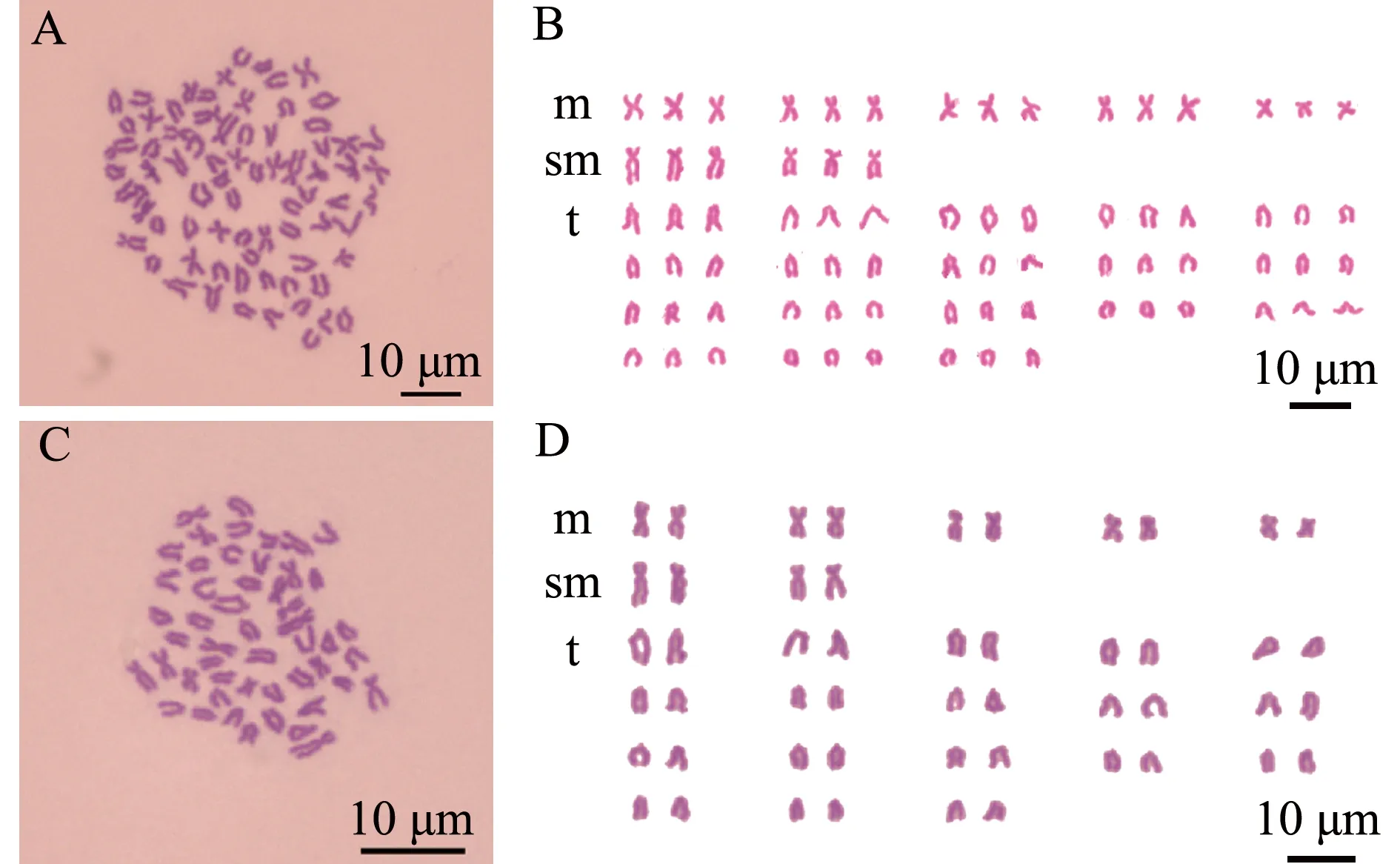
A、B—杂交三倍体泥鳅(3n=75); C、D—雄核发育二倍体泥鳅(2n=50)。A and B—hybrid triploid (3n=75) loach; C and D—androgenic diploid (2n=50) loach.图2 杂交三倍体泥鳅和雄核发育二倍体泥鳅胚胎染色体分裂相及核型Fig.2 Chromosome division and karyotype of embryos in hybrid triploid loach and androgenic diploid loach
2.3 FISH和Ag-NORs分析
以人的5.8S+28S rDNA为探针,对杂交三倍体泥鳅和冷休克雄核发育二倍体泥鳅的中期染色体进行FISH定位。在杂交三倍体泥鳅的3个染色体短臂的端部检测到3个FISH杂交信号(图3A、B);雄核发育二倍体泥鳅的2个染色体短臂的端部检测到2个FISH杂交信号(图3C、D)。
在间期核中,Ag-NORs的数目均表现出不同的多态性,杂交三倍体泥鳅间期核中呈现出Ag-NORs的数目为1~3个,含有3个Ag-NORs的频率最高,为75%(表3,图3E);雄核发育二倍体泥鳅间期核中呈现出Ag-NORs的数目为1~2个,含有2个Ag-NORs的频率最高,为 87%(表3,图3F)。杂交三倍体泥鳅胚胎染色体中,在3个染色体短臂的端部检测到3个银染点(图3G、H);雄核发育二倍体泥鳅胚胎染色体中,在2个染色体短臂的端部检测到2个银染点(Ag-NORs)(图3I、J)。Ag-NORs结果与上述FISH定位结果一致,均表明处理组雄核发育二倍体泥鳅染色组构成为2套染色体组。
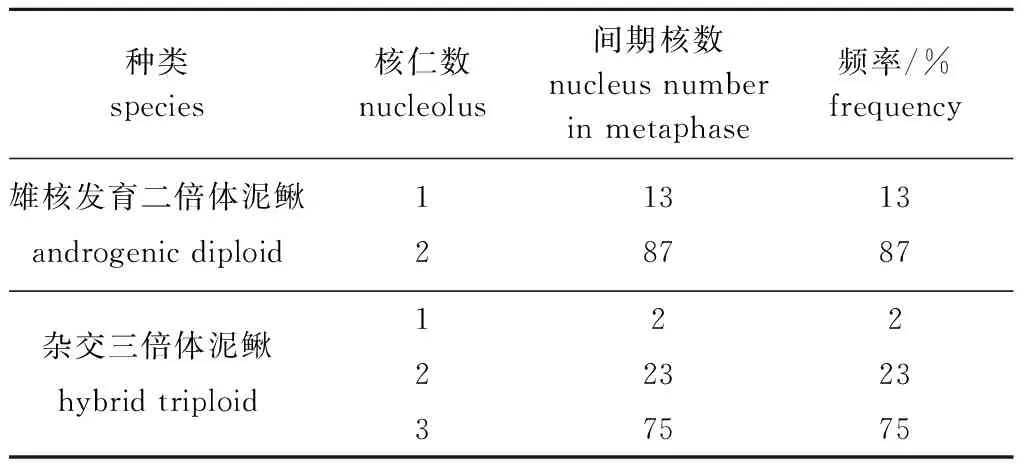
表3 间期核中核仁的频率Tab.3 Number of nucleolus per interphase nucleus
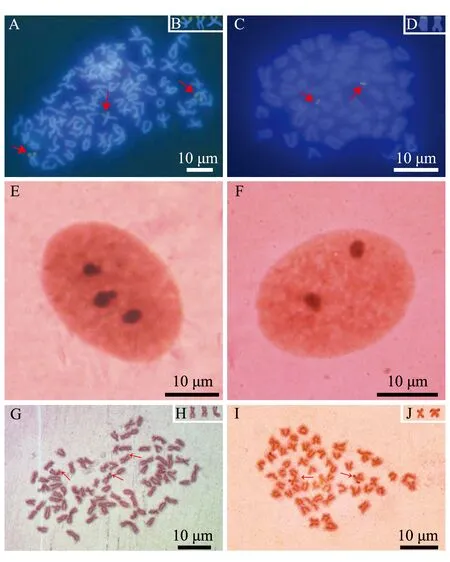
A、G—杂交三倍体泥鳅; C、I—雄核发育二倍体泥鳅; E—杂交三倍体泥鳅间期核; F—雄核发育二倍体泥鳅间期核; B、D—FISH杂交信号; H、J—银染点(Ag-NORs)。A and G—hybrid triploid; C and I—androgenic diploid;E—interphase nucleus of hybrid triploid;F—metachase nucleus in androgenic diploid; B and D—arrows indicate NORs shown by FISH signals; H and J—Ag staining.图3 杂交三倍体泥鳅和雄核发育二倍体泥鳅胚胎染色体分裂相的FISH及Ag-NORs分析Fig.3 Chromosome division phases in embryos of hybrid triploid loach and androgenic diploid loach by FISH and Ag-NORs staining
3 讨论
3.1 鱼类雄核发育途径
在水产养殖上,由于很多重要经济鱼类不同性别往往表现出不同的生产性能,如生长速度的快慢及性产物用途不同等。所以控制鱼类的性别,选择具有最佳生长性能的性别进行单性养殖,具有极为重要的应用价值。雄核发育是生产鱼类全雄苗种的重要途径,人工诱导鱼类雄核发育的常规途径(图4(a))主要包括两个步骤,即卵细胞染色体遗传失活及精子染色体加倍。在鱼类雄核发育中常用的卵细胞染色体遗传失活手段是射线照射(γ射线、Х射线及紫外线),此种灭活方法虽然简单易行,但是用射线破坏卵子细胞核的同时,细胞质和其他细胞器也会遭受到不同程度的破坏,导致其受精后不能正常发育,成活率极低。Purdom[8]使用60C0-γ射线照射川鲽Platichthysflesus卵子,随后与川鲽精子受精,获得雄核发育单倍体胚胎。Thorgaard等[9]使用四倍体虹鳟Oncorhynchusmykiss精子与γ射线照射后的虹鳟卵子受精,成功获得虹鳟二倍体雄核发育后代。Arai等[10]使用γ射线照射雌性马苏大马哈鱼Oncorhynchusmasou卵子,与雄性马苏大马哈鱼精子结合,成功得到35%的单倍体。Grunina等[11]与Corley-Smith等[12]分别用25~30 kR、15 kR的X射线强度照射鲤Cyprinuscarpio和斑马鱼Daniorerio卵子,与对应雄鱼精子受精,得到了12%和14%的雄核发育单倍体后代。
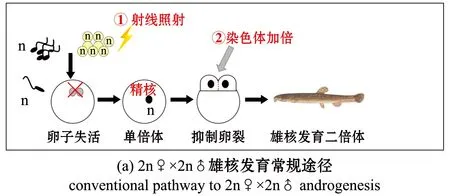
因此,无须卵子失活,快速、高效生产雄核发育个体成为亟待解决的关键问题。
本研究中,不用射线照射仅让受精卵在低温环境刺激下产生雄核发育的新途径(图4(b)),目前国内外鲜有报道。最早Gervai等[13]利用冷休克方法除获得三倍体外,也获得雄核发育单倍体胚胎。Ueda[14]发现,在虹鳟受精后30 s或3.5 h后用热休克(30 ℃,7 min)可获得少量的雄核发育二倍体个体。近年来,日本学者Morishima等[15]报道了泥鳅受精后利用3 ℃低温水处理受精卵60 min能诱导产生雄核发育后代,并报道了冷休克诱导雄核发育的细胞学机制是卵核与第二极体一同释放。Hou等[16]报道了斑马鱼受精卵在7 ℃水中处理30 min单倍率最高,并得到克隆二倍体个体。本研究室王玉生等[17]报道了大鳞副泥鳅受精卵在3 ℃冰水处理60 min,可产生雄核发育单倍体,其细胞学机制与Morishima等[15]报道的相一致,即卵核与第二极体一同释放;本研究室Zhou等[18]利用二倍体泥鳅♀与自然四倍体泥鳅♂杂交产生的受精卵进行了冷休克诱导雄核发育(受精后5 min,放入3 ℃冰水处理60 min),并通过对后代的染色体数目、亲子鉴定、初期胚胎观察,阐明了该方法可成功诱导雄核发育二倍体泥鳅,诱导率为73.33%,此人工诱导雄核发育新途径效果明显高于其他途径,其细胞学机制也是卵核与第二极体一同释放。关于卵核与第二极体一同释放的分子机制尚不清楚,有待于今后进一步探究。利用自然四倍体泥鳅诱导雄核发育二倍体可以省去精子染色体的加倍,提高成活率。本研究中参照Zhou等[18]报道的冷休克诱导雄核发育的最优参数进行了自然四倍体泥鳅雄核发育二倍体的诱导,从分子遗传学角度探讨了冷休克诱导自然四倍体泥鳅雄核发育的染色体组构成。
3.2 染色体核型分析
一个物种的染色体数目及形态特征称为该物种的核型(karyotype),包括染色体数目(即基数)及每一条染色体所特有的形态特征(染色体大小、着丝点的位置及次缢痕、随体的有无等)。对这些特征进行定量和定性的描述,即核型分析(karyotype analysis)[19],染色体核型是染色体研究中的一个基本方法,它对物种的亲缘关系、系统演化、起源、染色体鉴别等研究具有重要意义。本研究中,以大连当地二倍体泥鳅(2n=50)为母本,湖北省的自然四倍体泥鳅(4n=100)为父本进行杂交,其中一部分受精卵在受精后5 min,放入3 ℃冰水中处理60 min,经冷休克处理后获得了染色体数目为50条的二倍体泥鳅(2n=50),未经冷休克处理的对照组染色体数目为75条(3n=75)。显而易见,冷休克处理后没有使第二极体受到抑制,因为如果抑制第二极体释放的话将形成四倍体后代。本研究中经染色体核型分析,对照组核型公式为15m+6sm+54t,NF=96,冷休克处理组核型公式为10m+4sm+36t,NF=64。这与以往李雅娟等[20]报道的二倍体泥鳅染色体核型一致。由此可见,冷休克成功诱导了自然四倍体泥鳅雄核发育二倍体。表明中国自然四倍体雄性泥鳅能产生二倍体(2n)配子。该研究结果不仅为鱼类雄核发育增加了新途径,也为四倍体雄性泥鳅是具有4套染色体组的遗传四倍体提供了重要的遗传学证据。
3.3 银染法在鱼类倍性鉴定中的应用
Ag-NORs法在鱼类染色体研究中被广泛应用,该方法是研究染色体进化和物种亲缘关系的一个重要指标。研究表明,细胞中的核仁数目与染色体组数目有关,大多数物种具有一套染色体组的单倍体细胞中仅含1个核仁,具有2、3、4套染色体组的二、三和四倍体细胞分别含2、3、4个核仁。在多倍体鱼类的倍性鉴定中,Ag-NORs 法与其他倍性检测方法相比具有快捷、准确且省时省力的优点,尤其在条件比较简陋的情况下无须特殊的仪器就可以进行,是值得推广的方法。李雅娟等[21-22]对40余种鲤科鱼类与德国镜鲤的银染核型进行了比较,发现多数中国鲤科鱼类的Ag-NORs数目为 4,而德国镜鲤具有2个Ag-NORs,说明其染色体倍性是原始类型,是二倍化的四倍体,即染色体数目为2n=100,这种二倍化的四倍体只能产生单倍体配子(n=50),但无论是雌核还是雄核发育子代因单倍体均不能存活,需要进行染色体加倍才能存活。Li等[3-4]对自然二倍体和四倍体泥鳅、雌核发育后代进行了Ag-NORs分析,阐明了中国自然四倍体泥鳅是含有4套染色体组的遗传四倍体,即染色体数目为4n=100,这种遗传四倍体能产生二倍体配子(2n=50),无论是雌核还是雄核发育子代均为二倍体(2n=50),因此,不需要进行染色体加倍也能存活。本研究中,对杂交三倍体泥鳅及雄核发育二倍体泥鳅进行了Ag-NORs分析,结果显示,对照组杂交三倍体泥鳅染色体具有3个银染点,而处理组雄核发育二倍体泥鳅染色体具有2个银染点,这表明自然四倍体泥鳅雄核发育后代是含有2套染色体组的二倍体。
3.4 染色体荧光原位杂交在鱼类倍性鉴定中的应用
FISH是指通过分子杂交和荧光显微镜进行特定DNA序列检测的技术,FISH不仅是研究基因组组成的有效手段,也是分析不同基因组染色体交叉互换现象和染色体减数分裂过程中行为的重要工具。FISH技术在鱼类基因定位中的应用主要集中在rDNA定位上,这方面的研究对于鱼类染色体的进化具有重要意义。rDNA在染色体上的定位可以对传统核型的分析进行校正,尤其对于染色体较小且形态特征不明显的材料,可以提高同源染色体配对的准确性。利用FISH技术,定位rDNA研究核仁组织区(NORs),从而为鱼类染色体结构和功能分析提供理论基础。与其他方法不同的是,FISH技术不依赖物种的核仁组织区是否有转录活性,而是直接针对rDNA。Li等[3-4,23]对自然二倍体和四倍体泥鳅、雌核发育后代及其杂交三倍体泥鳅的染色体进行了FISH研究,从分子细胞遗传学角度阐明了不同倍性泥鳅的染色体组成。本研究中对杂交三倍体泥鳅及雄核发育二倍体泥鳅进行了FISH分析,结果显示,对照组杂交三倍体泥鳅染色体具有3个杂交信号,雄核发育二倍体泥鳅染色体具有2个杂交信号,再次证明自然四倍体泥鳅雄核发育后代是含有2套染色体组的二倍体。
4 结论
1)通过染色体核型、Ag-NORs、FISH等方法对雄核发育二倍体泥鳅染色体组构成进行分析,均鉴定出自然四倍体泥鳅雄核发育后代的染色体组构成是含有2套染色体组的二倍体,并证明自然四倍体雄性泥鳅是具有4套染色体组的遗传四倍体。
2)无须卵子失活或卵子染色体加倍,仅用冷休克可以成功诱导自然四倍体泥鳅雄核发育二倍体,表明中国自然四倍体雄性泥鳅能产生二倍体(2n)配子。

