绿豆根腐病病原菌分离和致病力鉴定
闫强 丁佩 张勤雪

摘要:从采集自我国6个省(市)具有根腐症状的绿豆植株中分离得到73株分离菌株,进一步通过离体叶片接种检测获得54株致病菌株。通过形态学和保守序列分析共鉴定出14种致病病原菌,其中尖孢镰刀菌检出率最高,首次检测出群结腐霉可以侵染绿豆并引起根腐症状。对来自国内外12个绿豆品种进行群结腐霉接种试验,结果表明,群结腐霉对不同绿豆品种均表现出强致病力,病情指数在45~96之间;进一步分析表明,皖绿2号对群结腐霉表现出相对较强的抗性水平。
关键词:绿豆;根腐病;病原菌分离;群结腐霉;抗病性;致病力
绿豆由于其生育期短、耐贫瘠、适应性强的特点,在用地养地及农业可持续发展等方面具有重要作用。同时绿豆是我国传统的杂粮作物,因其经济利用价值高,属高蛋白、低脂肪、中淀粉、医食同源作物,是人们理想的营养保健食品。2016年,农业部发布的《全国种植业结构调整规划(2016—2020)》为我国杂粮小品种发展成为大产业、带动农民增收指明了方向。2017年的“中央一号”文件也明确提出,增加我国杂粮等优质农产品供给。在政策导向、种植业结构调整以及人们饮食观念改变的影响下,绿豆种植面积也在逐年增加,目前,我国绿豆常年种植面积超过66.67万hm2(http://www.moa.gov.cn/)。隨着我国绿豆种植面积的扩大、重茬和迎茬,绿豆病虫害也随之逐渐加剧,进而严重影响了绿豆产量和品质。
绿豆生育期主要病害有苗期的根腐病,花荚期的枯萎病、叶斑病、病毒病、白粉病等。其中绿豆根腐病是一种由多种病原菌混合感染引起的土传病害,病害发生在种子萌发后整个生育阶段[1-2]。2014—2015年调查发现,在黑龙江西部地区绿豆种植区根腐病发病普遍[3],给绿豆生产带来严重危害。
本研究利用形态学和分子生物学手段对绿豆根腐病致病菌进行分离、鉴定,以期为后续研究该病害的发生规律、制定综合防治措施提供科学依据。
1 材料与方法
1.1 病样采集和病原菌分离纯化
2019年7—9月,在国家食用豆产业技术体系研究人员帮助下,分别从位于河北省石家庄市、黑龙江省齐齐哈尔市、重庆市潼南县、辽宁省沈阳市、河南省南阳市和内蒙古呼和浩特市的绿豆种植田块采集植株矮小,茎基部表现细缩,出现水渍、腐烂症状、褐色病斑的发病植株。
田间采集到的新鲜病株用自来水冲洗干净,并用手术刀在茎基部的病健交界处切取大小约 0.5 cm×0.5 cm的组织小块。组织样本放入70%乙醇中处理30 s进行表面消毒,然后移入2%次氯酸钠溶液中处理10 min,最后以灭菌水冲洗5~7遍并用灭菌滤纸吸干组织表面水分。处理好的组织放置于马铃薯葡萄糖琼脂(PDA)培养基上,然后在温度为25 ℃的培养箱中培养,待有菌落长出取边缘菌丝纯化2次后接种于PDA培养基斜面上保存。
1.2 致病性测定
从生长3周的绿豆苏绿1号植株上选取生长状态一致的三出复叶,切下后正面朝上置于保湿托盘中,叶柄处用湿润脱脂棉球包裹用于保湿。叶片中心位置区域用0.05%吐温溶液处理,消除叶片表面张力,用灭菌水冲洗后再用1mL注射器在处理区域中心位置针刺创伤。从培养4 d的菌落边缘切取大小约4 mm×4 mm的菌丝块,贴在上述叶片创伤处。每个分离菌株接种10张叶片。接种完毕后用保鲜膜密封保湿,置于温度为25 ℃的培养箱中暗培养,每隔24 h观察1次叶片发病状况。待接种叶片发病后,根据柯赫氏法则(Koch postulates)对病原菌进行再分离。
1.3 病原菌形态学观察
将分离得到的致病病原菌接种到PDA培养基中培养7 d,记录菌落颜色和形态特征并拍照。挑取边缘菌丝制作临时切片,在光学显微镜(Olympus CX41)下观察病原菌形态特征,结合菌落在PDA培养基上的形态和颜色特征,参照《真菌鉴定手册》判定病原菌种类。
1.4 病原菌分子生物学鉴定
从培养7 d的PDA平板表面刮取病原菌菌丝,采用改良的十六烷基三甲基溴化铵(CTAB)法提取病原菌总DNA[4]。分别采用rDNA-ITS通用引物ITS1/ITS4,β-tubulin(TUBUF2_F/TUBUF1_R),Histone 3(H3-1a/H3-1b),EF1α(EF1-728F/EF1-986R)(表1)对病原菌DNA进行PCR扩增。PCR产物经琼脂糖凝胶电泳验证条带大小正确后送南京擎科生物科技有限公司测序。将测序结果在Genbank数据库中进行blast同源比对,与已报道病原菌的核酸序列进行比较,结合形态观察结果确定病原菌种类。
1.5 群结腐霉菌接种物制备
分离得到的群结腐霉菌(Pythium myriotylum)菌株CQ19-1(PmCQ19-1)首先在PDA培养基上活化培养4 d。接种体制备参照Kirkpatrick等的方法略加改动:从边缘切取约1 cm×1 cm大小的菌丝块,放置10个菌丝块到含有灭菌细沙-玉米粉培养基(200 mL细沙,11.2 mL玉米粉,80 mL灭菌水)的500 mL三角瓶中,然后置于温度为25 ℃培养箱中培养10 d,期间每天摇匀培养基以保证菌丝在培养基中分布均匀。收集培养物与蛭石按1 ∶ 4体积比混匀作为接种物备用[5]。
1.6 群结腐霉菌接种
绿豆接种参照Kirkpatrick等的方法:取250 mL一次性塑料杯底部打孔排水,装入约150 mL蛭石,然后平铺厚度为1 cm(约40 mL)的群结腐霉菌培养物[5-6]。挑选籽粒饱满的绿豆种子每盆放置10粒于菌丝培养物表面,然后覆盖50 mL蛭石。未培养菌丝的细沙-玉米粉培养基按同样比例混合后作为空白对照,每个品种接种3盆。浇水至蛭石饱和后,放置于25 ℃、16 h—8 h光照—黑暗条件下培养,培养期间及时浇水保证蛭石处于水分饱和状态。
1.7 不同绿豆品种对群结腐霉菌的抗性评价
抗病表型数据记录采用以下方案:分别于播种后7、14 d统计植株存活率;并于14 d小心拔出植株,用自来水冲洗干净根部蛭石,记录不同绿豆品种的发病等级。发病分级按以下标准进行统计:(1)整个根系生长健康,无发病症状;(2)侧根可见轻微腐烂症状,1%~20%的根系组织表现出症状;(3)侧根腐烂症状明显,同时主根开始表现出发病症状,21%~75%的根系组织表现出症状;(4)主根及侧根均出现明显腐烂症状,76%~100%的根系组织腐烂;(5)种子腐烂不萌发[6]。病情指数按以下公式计算:
病情指数=∑(各级发病株数×发病等级数值)/(植株总数×最高发病等级数值)×100。
不同品种间抗病水平差异显著性分析采用Fisher氏最小显著差数检验(LSD)法进行多重比较,显著水平以P<0.05为基准。
2 结果与分析
2.1 病样采集和病原菌分离
从来自6个省(市)具有根腐症状的绿豆植株中分离得到73株分离菌株(表2、图1)。其中河北省石家庄市5株、黑龙江省齐齐哈尔市22株、重庆市潼南县18株、辽宁省沈阳市14株、河南河南阳市6株、内蒙古自治区呼和浩特市8株。
2.2 病原菌致病性检测和形态学特征
将分离得到的菌株分别接种绿豆离体叶片后,有54株分离物接种的叶片表现出发病症状。不同致病菌侵染绿豆叶片后病斑表型和侵染时间表现出明显差异,发病症状出现在接种后1~6 d,其中分离物CQ19-01C和HNS19-02在侵染24 h后即出现明显发病症状,侵染菌丝块附近叶片出现明显的水渍状腐烂;而LN19-04a和LN19-04d在接种6 d后出现明显的发病症状(图2)。收集发病组织样本对病原菌进行再分离,均获得与接种分离物菌落形态一致的培养物,即完成柯赫氏法则(KochsPostulates)致病性检测。
将分离得到的致病病原菌接种到PDA培养基上培养7 d后菌落形态也表现出差异(图3)。其中检出率最高的1种病原菌生长状态如下:气生菌丝浓密,绒状,初期菌丝白色,后期菌落背面残生浅紫色至深紫色色素(HLJ19-03b和NMGS19-02)。培养7 d后的菌落多产生小型分生孢子,卵圆或肾形,大小为(7~26)μm(平均值为12.0 μm)×(2~6)μm(平均值为4.2 μm),可初步判定为尖孢镰刀菌(Fusarium oxysporum)。
2.3 病原菌分子生物学鉴定
内转录间隔区(ITS)和另外3个基因保守区段序列在Genbank数据库中比对结果表明,54株致病菌共包含14种病原微生物。其中有16株是尖孢镰刀菌,主要检出地为齐齐哈尔市(7株)、呼和浩特市(5株)、南阳市(4株);10株是立枯丝核菌(Rhizoctonia solani),主要检出地为齐齐哈尔市(4株)、石家庄市(3株)和南阳市(3株);其次是群结腐霉(Pythium myriotylum)(4株),检出地为潼南县(2株)、南阳市(2株);此外还从齐齐哈尔市检出4株木贼镰刀菌(F. equiseti)(表3)。
从地域分布来看,在沈阳市的发病样本分离到树栖交链孢菌(Alternaria arborescens)、细极链格孢菌(A. tenuissima)、茄病镰刀菌(F. solani)、螺旋木霉(Trichoderma spirale)和玉蜀黍丝核菌(Waitea circinata)等5种病原菌。在齐齐哈尔市的样本中分离到厚孢镰孢菌(F. chlamydosporum)、木贼镰刀菌、尖孢镰刀菌、层生镰刀菌(F. proliferatum)等4种镰刀菌和1种立枯丝核菌共5种病原菌。从来自南阳市的样本中分离到立枯丝核菌、群结腐霉、尖孢镰刀菌和Fusarium neocosmosporiellum共4种病原菌。从来自潼南县的样本中分离出菜豆间座壳菌(Diaporthe phaseolorum)、菜豆壳球孢菌(Macrophomina phaseolina)、群结腐霉菌等3种致病菌。从来自呼和浩特市和石家庄市的样本中分别检出尖孢镰刀菌、立枯丝核菌(表3)。
2.4 群结腐霉形态学特征观察
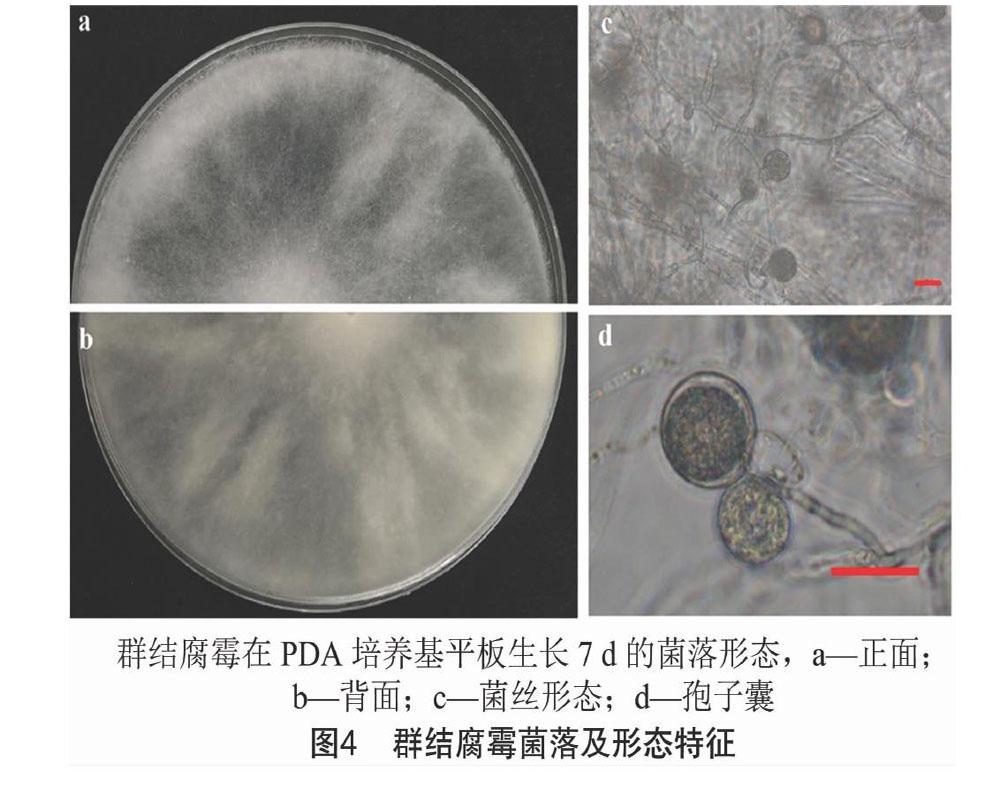
分析鉴定结果和侵染试验结果表明,群结腐霉为首次报道能够侵染绿豆;同时对绿豆具有强致病性,接种离体叶片24 h后即出现明显坏死斑,因此对该病原菌进行进一步研究。在PDA培养基上生长7 d后,群结腐霉菌丝发达,呈棉絮状,分枝,菌丝直径为3~11 μm(平均值为7.2 μm);孢子囊顶生或间生宽度为9~18 μm(平均值为13 μm);藏卵器球形或近球形,直径为23~35 μm(平均值为29.4 μm);游动孢子肾形,双鞭毛(图4)。
2.5 不同绿豆品种对群结腐霉抗病性评价
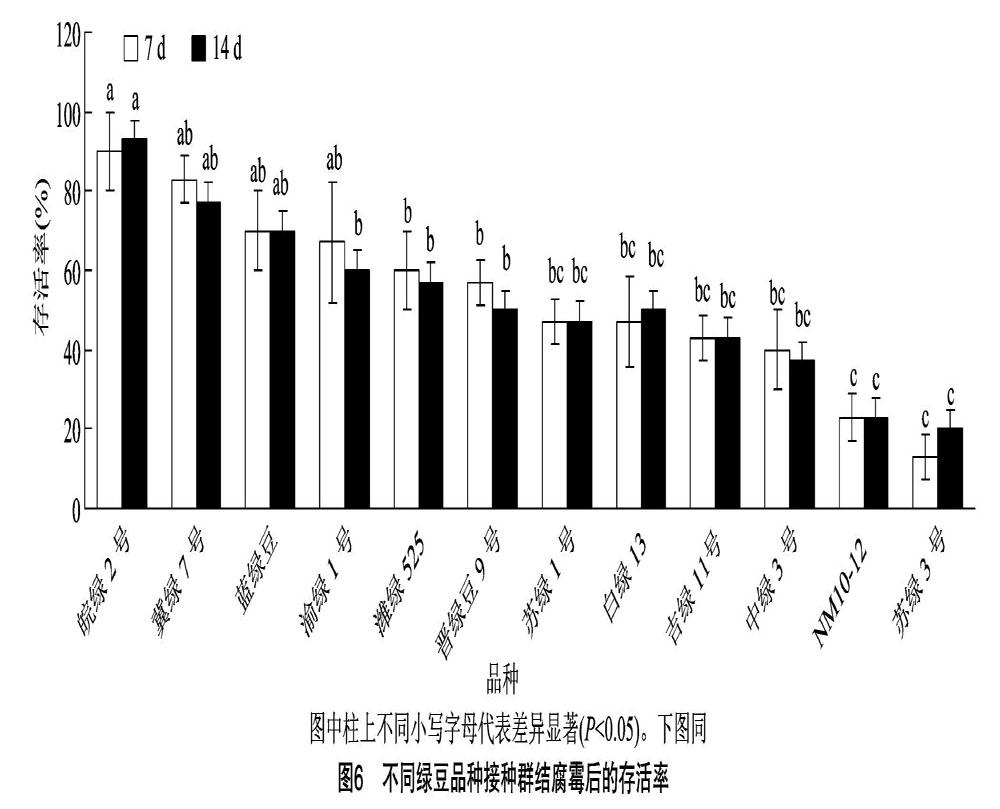
为了进一步评价群结腐霉对不同绿豆品种的致病性并为后期抗源筛选提供参考,选择了来自11个不同省份和1个巴基斯坦的共12个绿豆品种进行抗性评价。播种后7、14 d存活率的统计结果表明,不同品种间存在明显的抗性差异。苏绿3号在2个调查时间点的存活率仅有13%、20%,而皖绿2号存活率分别为90%、93%,同时冀绿7号也表现出较高的存活率。病情指数的统计结果与存活率
趋势基本一致,12个品种的病情指数在45~96之间。皖绿2号在所检测品种中表现出最强抗性,病情指数为45,显著低于其他品种。需要注意的是,在所选择的12个品种中,仅有皖綠2号的病情指数在50以下,其中有5个品种的病情指数都在90以上(图5至图7)。
3 讨论与结论
本研究通过对采集自我国6个省(市)的根腐症状绿豆病株进行病原菌分离,结合进一步致病性检测获得了54株致病菌株,形态学和保守序列分析结果表明,其属于14种病原微生物。目前,关于绿豆根部病害的研究相对于其他大宗作物还较落后,而抗病资源和基因的挖掘则研究更少。孙菲菲对多个省份绿豆3种主要土传病害的病原菌进行了分离鉴定,其中也分离鉴定到大量尖孢镰刀菌菌株[7]。本研究的结果与此类似,54株中有16株是尖孢镰刀菌,此外还有另外13株分离物属于镰刀菌属。本研究对每个地区采集样本的分离病原菌进行了分析,发现沈阳市和齐齐哈尔市检出病原菌种类最多,而呼和浩特市和石家庄市均只检出1种病原菌,这些信息为绿豆种植者有针对性地进行病害防治提供了相关参考。
此外,本研究还首次发现群结腐霉可以侵染绿豆并具有强致病性。群结腐霉隶属于卵菌纲腐霉属,在世界范围内分布广泛,其中许多种类是重要的土传植物病原菌,常造成果实腐烂、根腐、茎基腐和幼苗猝倒病等多种作物病害[8]。群结腐霉作为一种土传植物病原菌,可造成菜豆出苗前烂种和幼苗根腐[9];其引起的花生腐霉菌果腐病在一般发病田可造成产量损失达15%左右,重病田可致绝收[10];在黄姜上引起的茎基腐病造成的减产在 5%~30%之间[11];其引发的芋头根腐病可造成 80%~100%的产量损失[12]。相关研究表明,在淹水和高湿的大豆田块中,腐霉菌是最主要的土传病原菌[5]。本研究对12份国内外绿豆品种抗性评价的结果也显示,群结腐霉对绿豆具有很强的致病性,仅有皖绿2号的病情指数在50以下,其中有5个品种的病情指数在90以上。因此在我国南方或雨水较多的年份应该注意田间排水并采取积极措施,防止群结腐霉的危害。
目前,对作物根腐病主要通过应用化学药剂进行防治,然而对群结腐霉等卵菌来讲,它们不同于真菌,常见的真菌杀菌剂对其作用有限,作为土传病原菌,在湿润条件下使用化学药剂较为困难,成本昂贵,而且长期使用杀菌剂会造成土壤污染、病原菌产生抗药性、以及危害其他土壤有益生物[13]。因此,利用植物遗传抗性仍然是控制根腐病的一种有效方式。本研究对绿豆的群结腐霉抗性评价方法和指标进行了积极探索,为后续的抗病资源筛选积累了理论基础。
参考文献:
[1]李 薇,台莲梅,郭永霞,等. 防治绿豆根腐病药剂筛选[J]. 黑龙江八一农垦大学学报,2016,28(4):9-11,40.
[2]曲田丽,辛惠普,李健强. 7 种杀菌剂对绿豆根腐病菌的毒力测定及增效混剂配比筛选[J]. 中国植保导刊,2011,31(7):43-46.
[3]李季李. 黑龙江省西部地区杂粮生产情况及市场竞争力调查分析[D]. 大庆:黑龙江八一农垦大学,2015.
[4]Guo L D,Hyde K D,Liew E Y. Identification of endophytic fungi from Livistona chinensis based on morphology and rDNA sequences[J]. New Phytologist,2010,147(3):617-630.
[5]Kirkpatrick M T,Rothrock C S,Rupe J C,et al. The effect of Pythium ultimum and soil flooding on two soybean cultivars[J]. Plant Disease,2006,90(5):597-602.
[6]Klepadlo M,Balk C S,Vuong T D,et al. Molecular characterization of genomic regions for resistance to Pythium ultimum var. ultimum in the soybean cultivar Magellan[J]. Theoretical and Applied Genetics,2019,132(2):405-417.
[7]孙菲菲. 三种绿豆土传病害病原菌鉴定[D]. 北京:中国农业科学院,2017.
[8]Kamoun S,Furzer O,Jones J D,et al. The top 10 oomycete pathogens in molecular plant pathology[J]. Molecular Plant Pathology,2015,16(4):413-434.
[9]Rossman D R,Rojas A,Jacobs J L,et al. Pathogenicity and virulence of soilborne oomycetes on Phaseolus vulgaris[J]. Plant Disease,2017,101(11):1851-1859.
[10]于 静,吴菊香,许曼琳,等. 防治花生腐霉果腐病的化学药剂筛选[J]. 中国油料作物学报,2020,42(1):121-126.
[11]龙艳艳,刘增亮,汪 茜,等. 广西东南沿海生姜茎腐病病原菌鉴定[J]. 西南农业学报,2017,30(3):584-589.
[12]Tchameni S N,Cotarle M,Ghinea I O,et al. Involvement of lytic enzymes and secondary metabolites produced by Trichoderma spp. in the biological control of Pythium myriotylum[J]. International Microbiology,2020,23(2):179-188.
[13]Tambong J T,Hfte M. Phenazines are involved in biocontrol of Pythium myriotylum on cocoyam by Pseudomonas aeruginosa PNA1[J]. European Journal of Plant Pathology,2001,107(5):511-521. 劉加红,盘文政,吕亚琼,等. 具有烟草根结线虫防效的万寿菊秸秆生物有机肥配方及田间防控研究[J]. 江苏农业科学,2021,49(6):92-98.

