尿石素A改善线粒体氧化应激抗血管内皮细胞衰老
康秉文,陈蓉,殷草草,石莹,王玥,刘启玲,秦绪军*(.陕西中医药大学 公共卫生学院,陕西咸阳 7046;.西北大学 生命科学学院,西安 70069)
血管自身的衰老是导致心血管疾病高死亡率的重要危险因素之一,它影响了心血管疾病的发病过程以及严重程度[1-2]。血管内皮细胞是血管壁的重要组成部分,与血液的成分直接接触。随着年龄的增长,血管内皮细胞易受血流中异常成分等因素的影响,诱发氧化应激,进一步导致血管内皮细胞衰老。表现为细胞增殖减少,G0/G1期停滞,细胞迁移受阻以及内皮功能障碍等。越来越多的研究结果表明内皮细胞衰老是血管衰老发展过程的关键步骤[3-4]。因此揭示内皮细胞衰老机制可以为预防和治疗心血管疾病提供依据。
环境因素能够影响内皮细胞的衰老,但具体机制仍然不清楚[5-6]。氧化应激通过产生大量活性氧(ROS)在诱导内皮细胞衰老以及血管衰老的过程中具有重要作用[7]。ROS 能够诱导DNA 损伤、导致炎症反应、细胞衰老以及凋亡[8]。虽然低剂量ROS 对于维持细胞内环境稳态以及适应应激反应是有益的,但是,过度的ROS 产生会导致细胞损伤甚至死亡[9]。线粒体是细胞ROS 产生的主要来源,细胞内90%以上的ROS 来源于线粒体的氧化磷酸化。线粒体通过产生三磷酸腺苷(ATP)以及其他代谢产物在细胞增殖、迁移、凋亡、免疫反应以及基因表达中都发挥了重要作用[10-11]。因此,线粒体功能对于维持细胞正常功能以及内环境稳态都至关重要。有研究发现,线粒体功能损伤引起的线粒体ROS(mtROS)产生增加或抗氧化防御体系的降低可以促进细胞衰老,比如敲除线粒体抗氧化酶SOD2 会使mtROS 增加并伴有血管功能的损伤,而mtROS 的增加也会使氧化应激增强,进而导致细胞衰老[12-13]。
尿石素A(UA)是于石榴、草莓以及其他的坚果中主要成分——鞣花单宁和鞣花酸的一种代谢产物。研究发现,UA 通过诱导线粒体自噬延长线虫寿命[14],通过缓解氧化应激抑制巨噬细胞中炎症因子的产生[14]。有研究发现,UA 能够缓解D-半乳糖诱导的小鼠大脑的衰老[15]。这些研究提示,UA 具有抗炎、抗氧化、调节自噬以及抗衰老等作用。为进一步明确UA 的抗衰老作用,并且探讨其中的内在机制,本研究观察了UA 对血管内皮细胞衰老的影响及其抗氧化机制。
1 材料
HUVEC 细胞(中科院上海细胞库);UA(上海陶素生化科技有限公司,纯度≥98%);胎牛血清(Fetal Bovine Serum,FBS)、DMEM高糖培养基(Gibco);蛋白定量分析试剂盒(Thermo);DCFH-DA 荧光探针(Sigma);过氧化氢酶(CAT)活性试剂盒、总SOD 活性试剂盒、SA-β-gal 染色试剂盒(碧云天生物技术研究所);CCK-8 试剂盒(汉恒生物);丙二醛(MDA)试剂盒(江苏凯基生物技术股份有限公司);Actin、SOD2 鼠抗单克隆抗体(Santa Cruz);总RNA 提取试剂盒(天根生化科技有限公司);β-gal活性试剂盒、MitoSOX 荧光染料、二氧化碳孵育箱(Thermo);细胞凋亡线粒体膜电位(JC-1)检测试剂盒(江苏凯基);CKX41 倒置显微镜(日本Olympus);Infinite200 PRO 全波长多功能酶标仪(Tecan);流式细胞仪(BD);Trans Blot Turbo 蛋白转印系统、蛋白电泳仪、凝胶成像系统(Bio-Rad);BX43 荧光显微镜(Olympus)。
2 方法
2.1 细胞培养与处理
HUVEC 细胞在37 ℃,5% CO2条件下,采用DMEM 高糖培养基于培养瓶中培养。将细胞分为4 组:对照(Control)组,模型(Model)组,低剂量UA 处理组(10 µmol·L-1),高剂量UA处理组(20 µmol·L-1)。其中模型组、UA 低、高剂量组加入D-半乳糖质量浓度为10 g·L-1,共处理3 d。每组设立3 个平行样。
2.2 β-gal 染色及活性检测
吸除细胞培养液,PBS 洗一次后加入1 mL固定液,室温固定15 min。用1×PBS 洗3 次,3 min/次。滴加染色工作液,37℃过夜。光学显微镜下观察拍照。消化、离心收集细胞于离心管内。加入100 μL 裂解缓冲液裂解,剧烈震荡15 s,间隔10 min,共40 min。12 000 g、4℃离心20 min,取10 μL 使用BCA 法,测定蛋白浓度;取80 μL上清液中加入等量的β-半乳糖苷酶试剂于405 nm波长测定吸光度。
2.3 细胞MDA、SOD 以及CAT 活性检测
采用对应试剂盒分别测定MDA、总SOD 及CAT 活性。在样品充分裂解后,分别按照说明进行操作,并使用BCA 法检测样品蛋白浓度。
2.4 细胞总ROS 和线粒体ROS 检测
采用荧光探针(DCFH-DA)标记,流式细胞仪检测细胞总ROS。在细胞中加入浓度为10 μmol·L-1的DCFH-DA,37℃避光孵育30 min,孵育完成后用1×PBS 重悬清洗3 次,重悬后用流式细胞仪检测,FL-1 通道测定平均荧光强度,激发波长为488 nm,发射波长为525 nm。
采用MitoSOX 标记,荧光显微镜观察线粒体ROS。在细胞中加入浓度为5 μmol·L-1的MitoSOX,37℃避光孵育10 min,孵育完成后,用1×PBS 清洗3 次,Hoechst 复染,荧光显微镜观察。
2.5 JC-1 染色和JC-1 膜电位检测
采用JC-1 染色和JC-1 膜电位检测线粒体膜电位。将12 孔板中的细胞用1×PBS 清洗一次,加入事先配制好的JC-1 工作液(8 μL JC-1 加入3600 μL 灭菌去离子水,充分溶解后加入400 μL 10×Incubation Buffer),充分覆盖。37℃,5% CO2的培养箱中孵育17 min。用1×Incubation Buffer洗2 次,加入 1 mL 细胞培养液,荧光显微镜观察。对6 孔板细胞用1×PBS 清洗一遍,然后消化、离心收取细胞于1.5 mL EP 管中。用PBS 洗2 遍(2000 g,5 min),加入1 mL JC-1 工作液均匀悬浮细胞,37℃,5% CO2的培养箱中孵育20 min。用1×Incubation Buffer 洗2 次,离心收集细胞。最后加入200 μL 1×Incubation Buffer 重悬后用流式细胞仪检测。
2.6 RT-PCR 技术检测
将RNA 提取试剂盒提取的总RNA 用Iscript cDNA 合成试剂盒反转录cRNA。定量RT-PCR分析根据Power SYBR 试剂盒说明进行操作,以β-actin 为内参,用2-△△CT法计算p21 mRNA 的相对表达水平,采用Bio-Rad 公司的CFX Connect实时系统进行检测。
2.7 Western Blot 检测
用裂解缓冲液裂解各组细胞。使用BCA 法测定蛋白浓度。将等量的蛋白(20 µg)加到配制好的凝胶中,恒压150 V 电泳60 min。电泳结束后转膜,迅速将转好的膜放入1×TBST 漂洗一遍。一抗在4 ℃孵育过夜,用TBST 清洗PVDF膜3 次。二抗在25℃孵育2 h,用TBST 清洗PVDF 膜4 次。发光液A 与发光液B 按1∶1 混匀,覆于PVDF 膜表面,在凝胶成像系统中进行成像。最后采用Bio-Rad Quantity One 软件对条带进行定量分析。
2.8 线粒体耗氧率分析
采用Serhorse XF24 分析仪(Seahorse Bioscience,USA)细胞线粒体压力检测试剂盒检测细胞呼吸率。按照10 000 个细胞每孔将D-半乳糖和不同浓度UA 处理后的细胞接种在24 孔的XF 分析仪细胞培养板中,处理3 d 后,采用含5 mmol·L-1葡萄糖和1 mmol·L-1丙酮酸钠的XF 实验缓冲液洗涤细胞,37℃无CO2条件下孵育1 h。在给予复合物V 抑制剂oligomycin(1 µmol·L-1)、FCCP、复合物Ⅰ抑制剂鱼藤酮(1 µmol·L-1)和复合物Ⅲ抑制剂antimycin A(1µmol·L-1)混合物条件下检测细胞耗氧量(oxygen consumption rate,OCR),采用Serhorse XF24 分析仪检测后,Seahorse Wave 软件分析数据,细胞数标准化所有数据。
2.9 统计学分析
采用Graphpad Prism 6.0统计软件进行数据分析,以±s形式表示。多组间数据采用单因素方差分析(One-way ANOVA),运用Dunnett’st检验比较实验组与对照组之间的差异,以P<0.05为差异有统计学意义。
3 结果
3.1 UA 改善D-半乳糖诱导的血管内皮细胞衰老
采用不同剂量的UA 处理细胞2 d,采用CCK-8 试剂盒检测细胞增殖活力。结果发现,0.5、1、5、10、20 µmol·L-1的UA处理均不影响HUVEC 细胞增殖,而50 µmol·L-1的UA处理显著抑制了细胞增殖(P<0.05),见图1A。因此,笔者选择10 µmol·L-1和20 µmol·L-1的UA 用于后面的细胞实验。10 g·L-1D-半乳糖处理能够诱导β-gal 染色增加、活性显著增强(P<0.05),见图1B;诱导细胞增殖抑制因子p21 水平显著增加(P<0.05),见图1D。而UA处理能够显著拮抗这些衰老指标的改变。表明D-半乳糖诱导了HUVEC 细胞衰老,而UA 处理能够有效逆转这些改变,缓解细胞衰老。
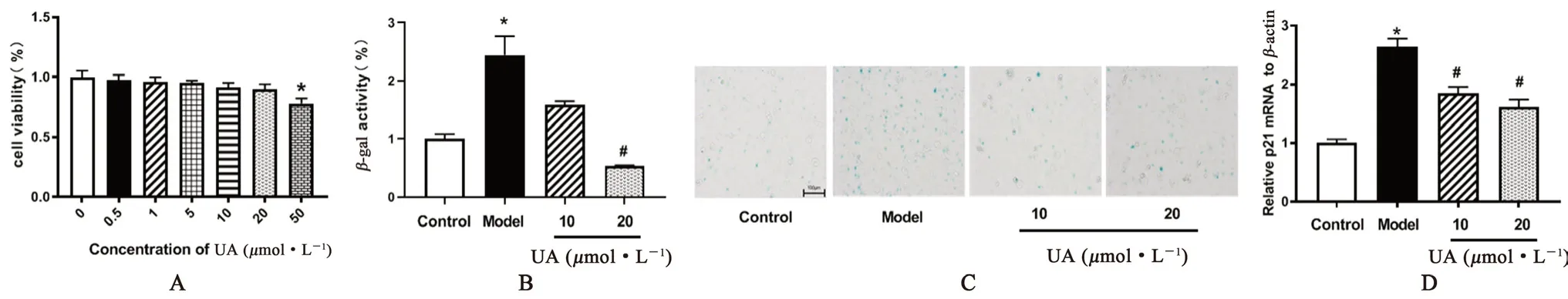
图1 不同剂量UA 对HUVEC 细胞衰老的影响Fig 1 Effect of different doses of UA on the HUVEC senescence
3.2 UA 改善D-半乳糖诱导的HUVEC 细胞氧化应激
细胞氧化应激是ROS 产生和抗氧化防御系统失衡引起的应激状态。MDA 是ROS 在体内产生脂质过氧化反应的产物,代表了氧化损伤水平。而SOD 以及CAT 是体内抗氧化防御系统的重要组成部分。本研究中,D-半乳糖处理显著增加了HUVEC 细胞中MDA 水平(P<0.05),降低了SOD 和CAT 活性(P<0.05),见 图2A ~2C。DCFH-DA 染色后流式细胞检测细胞内ROS 水平显著增加(P<0.05),见图2D。而UA 处理后显著抑制了细胞内ROS 水平,降低了MDA 含量,提高了SOD 和CAT 活性。结果表明,UA 能显著改善D-半乳糖导致的细胞氧化应激。
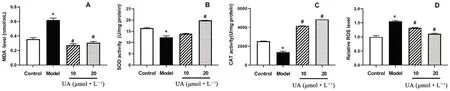
图2 不同剂量UA 对HUVEC 细胞氧化应激的影响Fig 2 Effect of different doses of UA on the HUVEC oxidative stress
3.3 UA 改善D-半乳糖诱导的HUVEC 细胞线粒体氧化应激水平
线粒体作为细胞ROS 产生的主要场所导致其成为ROS 损伤的重要靶点。线粒体氧化应激直接影响线粒体功能。SOD2 是存在于线粒体内的主要抗氧化酶。研究发现,D-半乳糖处理显著降低了SOD2 表达水平(P<0.05),见图3A、3B;线粒体MitoSOX 染色结果表明mtROS 水平显著增加(P<0.05),见图3C。UA 能够促进SOD2 的表达,有效抑制由于D-半乳糖导致的mtROS 增加;表明UA 能够有效改善线粒体氧化应激水平。
3.4 UA 改善D-半乳糖诱导的HUVEC 细胞线粒体氧化呼吸功能异常
线粒体氧化磷酸化是细胞内ATP 产生的主要途径,而其副产物是mtROS。在线粒体功能正常状态下,mtROS 的产生维持在低水平,仅仅作为细胞内信号分子。但是当其功能受损时,ATP 的产生显著下降,而mtROS 的产生显著增加,线粒体氧化应激水平增加,这些将会进一步加重线粒体功能受损,形成恶性循环。正常线粒体的膜电位较高,JC-1 聚集在线粒体基质中形成聚合物,产生红色荧光;线粒体受损时,膜电位下降,JC-1 以单体的形式存在于胞浆中,产生绿色荧光。研究发现D-半乳糖处理显著降低了线粒体膜电位,见图4A、4B;抑制了细胞的线粒体氧化呼吸功能,见图4C。而UA 处理能够提高线粒体膜电位,改善线粒体氧化呼吸功能(P<0.05)。这些结果表明,UA 处理可能通过改善线粒体膜电位和线粒体呼吸功能,从而改善线粒体氧化应激状态,这可能是其抗细胞衰老的重要机制。
4 讨论
细胞衰老的重要理论之一是线粒体自由基理论。衰老过程中,线粒体中ROS 水平增加会导致线粒体DNA 及分子的结构和功能的异常,这会引起线粒体氧化磷酸化水平的降低,从而进一步增加ROS 的产生。这种恶性循环导致了细胞ATP 产生能力下降、细胞增殖停滞、细胞凋亡以及细胞衰老等[16]。已经有研究发现衰老过程中mtROS 水平增加,线粒体DNA 突变增加,线粒体功能下降[17-18]。因此改善线粒体氧化应激成为抗衰老的重要策略之一。
炎症、肿瘤、缺血再灌损伤以及自噬病理生理过程与ROS 都有着密切关系,ROS 能够通过调控众多转录因子NF-κB 和STAT3 等及生长因子、细胞因子等调节多种细胞信号通路[19]。因此,ROS是调节氧化还原信号相关通路及病理生理过程的重要因子。因此,通过减少ROS,改善氧化应激成为UA 缓解或预防临床疾病的潜在共有机制。
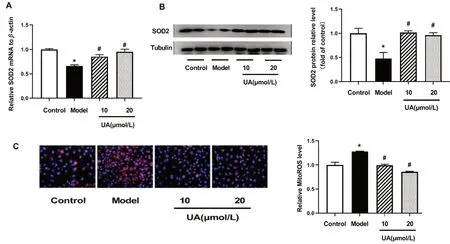
图3 不同剂量UA 对HUVEC 细胞抗氧化酶SOD2 表达和线粒体氧化应激的影响Fig 3 Effect of different doses of UA on the mitochondrial oxidative stress and the SOD2 expression of HUVEC
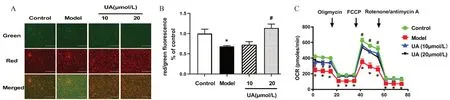
图4 不同剂量UA 对HUVEC 细胞线粒体功能的影响Fig 4 Effect of different doses of UA on the HUVEC mitochondrial function
D-半乳糖诱导衰老是被广泛采用的人工诱导衰老模型方法之一。对于D-半乳糖诱导衰老机制报道也很多,比如谷氨酰胺合成酶信号转导、干扰线粒体功能和诱发氧化损伤,其中诱导氧化应激一直被认为是重要的机制,这也符合自由基的衰老理论。本研究发现,在D-半乳糖诱导的HUVEC 细胞衰老过程中,细胞ROS 水平增加,细胞抗氧化防御系统降低,细胞氧化应激水平增加,细胞衰老程度加剧。而UA 处理则能减少ROS 与MDA 水平,提高抗氧化酶SOD2 和CAT 的表达及活性,从而改善细胞的氧化应激,缓解细胞衰老。这表明UA 可能通过改善氧化应激来缓解衰老。针对ROS 的主要来源,我们研究进一步发现UA 能够改善线粒体本身的氧化应激水平,这应该是其降低mtROS 产生以及促进线粒体抗氧化系统共同作用的结果。而mtROS 是线粒体氧化磷酸化的副产物,这进一步表明UA通过改善线粒体氧化磷酸化功能,减少了mtROS的产生,延缓了细胞衰老。Chen 等[20]发现UA可以通过miR-34a 调控SIRT1/mTOR 信号减轻D-半乳糖诱导小鼠脑衰老。Gong 等[21]发现UA 可以通过激活AMPK 信号通路改善AD 小鼠脑组织病变。Kujawska 等[22]在帕金森病大鼠模型中发现UA 可以通过提高线粒体醛脱氢酶活性和抗凋亡蛋白Bcl-xL 表达,进而增强神经元存活率。而本研究结果从线粒体代谢和氧化应激角度提供了一个UA 抗衰老的潜在机制。
综上所述,线粒体作为细胞内能量产生的主要细胞器,线粒体代谢和功能障碍会导致细胞整体功能异常,甚至凋亡。同时线粒体氧化应激也是衰老的重要机制和潜在干预靶点。在本研究中笔者发现在衰老过程中,线粒体功能下降,线粒体ROS 产生增加,而UA 能够改善线粒体功能,减少线粒体ROS 生成,提高抗氧化酶活性,改善氧化应激状态,从而延缓细胞衰老,为UA 的抗衰老研究和进一步开发利用提供了实验室依据。

