内镜下肠道息肉诊断方法进展
张 潇,王 谊(通讯作者),孔娅菲
(四川省肿瘤医院·研究所<四川省癌症防治中心,电子科技大学医学院附属肿瘤医院>肿瘤筛查中心 四川 成都 610041)
近年来结直肠癌(colorectal cancer,CRC)发病率呈急剧上升趋势,2018 年美国癌症协会发布结直肠癌在高发恶性肿瘤中排行第4 位[1]。目前多数的结直肠癌被认为来源于肠道息肉,通过腺瘤-癌症序列进行转变,因此早期诊断并及时处理肠道息肉可以有效降低CRC的发病率[2]。肠道息肉相关的病症比较复杂,特别是多种增生性息肉也包含在其中。而肠道息肉的发病因素及肠道息肉发生癌变的因素过程繁多,还待进一步研究[3]。故当前对于肠道息肉进行有效的筛查追踪,肠镜检查过程中对各种息肉进行准确的评估,及早采取内镜下高危息肉切除,可有效降低CRC 的发病率和病死率[4]。近年来,随着内镜设备及技术、病理学、分子病理学等多学科的快速发展,肠道息肉的诊断和治疗方法进展也不断更新和深入,本文仅对肠道息肉的分类分型诊断方法的发展过程和进展进行梳理和综述,为肠道息肉的临床诊治提供理论参考。
1.肠道息肉定义及组织病理分类
肠道息肉是肠道黏液慢性炎症引起局部黏液增生肥厚而形成的黏液向肠腔内隆起样病变,表面常较光滑,外形大小不尽相同,可从半透明的难以辨认的小突起至直径10 ~20 cm 的有蒂或者有蒂有冠的肿块不等,可单发也可多发。肠息肉有从组织学、病变性质、病理等角度衍生的多种分类分型方法,目前国内外应用最为广泛的是Morson 组织学分类,以它为基础将肠道息肉分为肿瘤性、化生性、炎症性、错构瘤性四类,据此世界卫生组织(WHO)发布了以下分类,见表1。
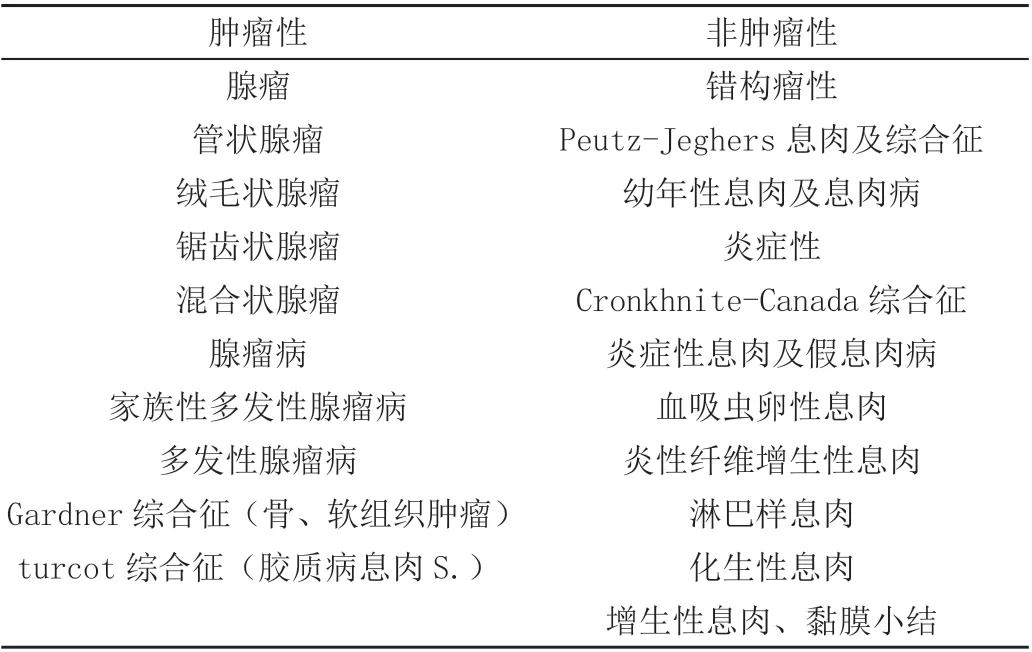
表1 肠道息肉分类
2.内镜下肠道息肉分类诊断方法
随着国内外医疗机构诊治技术和医疗设备的精密度不断提高,通过先进的检查设备可以直观的观察到肠道内息肉的特征,同时基于大量的检查样本研究,也衍生出对肠道内息肉病变进行诊断分类的一系列方法,以提高诊断治疗效率。在临床诊断过程中,与非肿瘤性息肉相比,肿瘤性息肉的潜在风险更高。因此,如何在内镜检查的过程中能准确的判断息肉性质,对后续治疗处理策略的制定有着至关重要的意义。
目前,临床上息肉的形态分型主要有山田型、WASP分型、巴黎分型、中树分型等[5],其中临床上应用最广泛最简便的是山田分型,它是在普通内镜下,根据息肉的形态、颜色、部位来鉴别结直肠息肉的性质,山田Ⅰ、Ⅱ型多为增生样息肉;Ⅲ、Ⅳ型多为腺瘤样息肉,而腺瘤样息肉恶变风险很高。但由于普通内镜易忽略结直肠黏液微小病变,对肿瘤样息肉表面微细结构观察不清,故这是山田分型局限性所在。
随着电子信息技术的发展,提供了可以观察息肉黏膜表面血管状态的方法,于是出现了各种基于息肉表面黏膜血管分型的诊断方法,其中比较典型的是Sano 分型诊断方法,该方法将息肉黏膜表面微血管分为I 型、Ⅱ型、Ⅲ型。I 型为正常黏膜及增生性息肉,Ⅱ型常见于腺瘤性息肉,Ⅲ型为结肠癌,其中Ⅲ型又分为ⅢA 型和ⅢB型,ⅢA 型为黏膜内癌或黏膜下层浅层浸润癌,ⅢB 型为黏膜下层深部浸润性癌。Sano 分型方法有着不错的诊断效果且获得临床多项研究证实[6-7],但由于该方法需依赖于放大内镜设备,受限于放大内镜的普及,因此很难在全世界范围内广泛应用。于是Hewett[8]和Hayashi等[9]经过研究提出了NICE(NBI International Colorectal Endoscopic)分类方法,该方法建立在窄带成像技术NBI(Narrow Band Imaging)的基础上,使用高清晰非放大内镜,提供了更多的诊断信息,再结合Sano 分型中黏膜血管特征一起形成,并以这些信息为根据将息肉分为三种类型,其中1 型为非肿瘤性病变,2 型和3 型为肿瘤性病变[10],具体分类方法见表2。

表2 肠道息肉肿瘤性及非肿瘤性的NICE 分类方法
对NICE 分类方法,临床应用的多项相关研究证实了该方法的科学性、有效性和普适性[11]。但同时发现越大的息肉使用该方法越容易判别息肉性质,主要的误判都来自于较小的息肉[12],而且NICE 分类分型诊断方法没有包含锯齿状息肉。
而近年来发现肿瘤性肠道息肉中除了占比最大的常见的传统腺瘤,另有约30%是锯齿状息肉[13]。锯齿状息肉在外观上具有体积小、形状扁平、息肉具有腺窝上皮呈锯齿状(“抓牙样”)的外观特点,在过去被认为是不具有恶性倾向的增生性息肉,但从上世纪八十年代开始,逐渐有学者发现部分结直肠增生性息肉可发展为结直肠癌,从而开始对这类息肉恶性变率进行研究,目前无蒂锯齿状息肉已被明确证实为结直肠癌的癌前病变[14]。Longacre和Fenoglio-Preiser[15]1990 年首次将同时具有增生性息肉的锯齿状结构和传统腺瘤异型性上皮特征的一种新的腺瘤类型命名为锯齿状腺瘤(serrated adenoma, SA)。锯齿状腺瘤是一种介于增生性息肉和腺瘤之间的息肉,组织学上呈锯齿状改变。其恶变途径可能与腺瘤恶变不同,有更高的恶变率。主要在亚洲受到关注,欧美持不同意见。当前诊断锯齿状息肉常用技术为自体荧光显像(Auto-fluorescence Imaging, AFI)、NBI 技术。Joep 等[15]成立的(Workgroup Serrated Polyps and Polyposis, WASP)工作组将现有的NICE 分类方法与无蒂锯齿状息肉的诊断相关的信息进行整合,设计出了WASP 方法。该方法适用于内镜下诊断微小型腺瘤、增生性息肉和无蒂锯齿状息肉/腺瘤,比以往的技术能够比较有效的鉴别锯齿状息肉和增生型息肉,弥补了NICE 方法的不足,研究实验结果表明WASP 分类比较显著提高了诊断的准确性,是一种有效的综合性分类方法。见图1。
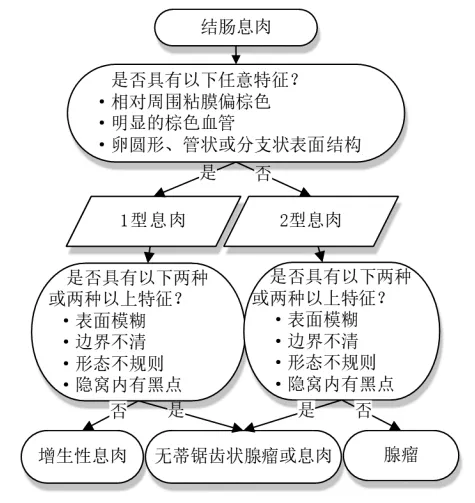
图1 WASP 分类方法
Boparai 等[16]对这一检测技术的可靠有效性进行评估认为:AFI 和NBI 鉴别出锯齿状息肉的准确率为55%,而鉴别出腺瘤的准确率分别是65%和94%,这证明了NBI在现有条件技术水平具有较好的鉴别能力,但锯齿状息肉的检测率有待加入分子技术诊断标准,这正是另一个重点研究领域[17-18]。
3.结论
本文对肠道息肉分类诊断方法相关的研究进行综述,随着电子成像技术的发展,从早期的Pit pattern 分类法发展到Sano 方法以及后续NICE 分类方法。这些方法在临床诊断中都取得较好的效果,但同时也有各自的局限性。WASP 方式提供了一种综合性的分类方法,可以较为有效的鉴别锯齿状息肉和增生性息肉。但由于锯齿状息肉和增生性息肉在外观上相似度较高且面临操作者经验不足等问题,使得准确鉴别锯齿状息肉和增生性息肉仍面临一些鉴别困难,对于锯齿状息肉的精准的鉴别方法还需进一步完善。另外对于微小息肉的诊断,一些研究中发现,当前的方法还存在一些问题,通过把NICE 方法在NBI 内镜下的光学诊断结果与标准组织病理学结果进行了比较,发现针对小息肉(<1 cm)当前NBI 光学诊断的检测灵敏度与病理学检查结果相比还有较大差距,该实验还表明专家的专业知识和结肠镜的清晰度都不能明显缩小该差距。故当前的光学诊断方法对于较小息肉的诊断还需进一步完善,以减少漏诊。同时随着内镜设备、分子诊断领域等多学科的进展[19],我们对肠道息肉的认识不断深入,细分息肉类型的精准诊断一定会有进一步的研究成果出现,值得大家期待。

