腹腔镜与传统脾切除术治疗创伤性脾破裂的疗效对比研究
刘 岳
(广州医科大学附属第六医院<清远市人民医院>普通外科 广东 清远 511500)
1 资料与方法
1.1 一般资料
本文回顾性报告我院2016 年1 月—2020 年6 月收治的外伤性脾破裂患者共30 例。所有患者在手术前均已完善CT、B 超等相关检查,明确为脾脏破裂患者。排除标准:(1)合并需同期手术治疗的颅脑、肠道、胸部或肢体复合性损伤;(2)血流动力学不稳定,失血性休克或创伤性休克患者;(3)受伤时间至患者住院时间》24 h 的患者。其中男21 例,女9 例,平均年龄41.5 岁。致伤原因为交通事故伤(n=16)、高处坠落致伤(n=8)、钝器伤(n=4)、挤压伤(n=2)。根据第六届全国脾外科学会分级标准,一级8 例,二级18 例,三级4 例,均诊断为急性脾破裂。依据病患的手术治疗方式,分为腹腔镜手术组(比较组)和剖腹手术组(对比组),各15 例。其中比较组男10 例,女5 例,年龄10 ~66 岁,平均年龄42.3 岁。对照组男11 例,女4 例,年龄19 ~63 岁,平均年龄38.1 岁。两组间的性别、年龄等比较无显著性差异(P>0.05)。
1.2 手术方法
腹腔镜组:病患行常规气管插管全麻,取仰卧人字形位,麻醉起效后改为头高30°脚低位。术者立于患者两腿中间,助手位于患者右侧,扶镜手立于患者左侧,肚脐下方行1 cm 横行小切口,插入一次性气腹针,充入CO2,建立气腹模型。压力为12 ~14 mmHg。脐下切口植入10 mm 穿刺器作为观察孔。手术中采用四孔法行操作。主手术孔为左腋窝前线左侧肋缘下2 cm 处置入10 mm 的穿刺器。第一辅助手术孔为左锁骨中线位置肋缘下2 cm置入10 mm 穿刺器,第二辅助手术孔经剑突下缘2 cm 置入5 mm 穿刺器。手术方法如下:(1)腹部探查:30°腹腔镜。进入腹腔镜后,首先对整个腹腔进行探查,并将腹腔内的血液吸出,检查腹腔内其余器官是否有受损。明确无其他腹腔内脏器损伤后将体位改为左侧摇高30°左右并右侧摇低。(2)脾胃韧带横断:主刀用肠钳将脾向外上方抬起,助手把胃向右侧牵拉,注意不要损伤脾脏和网膜组织,充分展开暴露出脾胃韧带。用超声刀快档慢档结合离断脾胃韧带。(3)离断脾脏血管:将脾脏放回原位,主刀左手保持脾脏周围韧带张力,自脾脏足侧用超声刀依次切断脾与结肠、肾、膈肌之间的韧带。靠近脾门处用腹腔镜下直线型切割闭合器离断包括脾动脉、脾静脉在内的脾门血管。注意保护胰腺组织。此步骤后脾脏可向上翻转,便于充分显露位置较深的胃短血管,用超声刀凝固、血管夹在近端夹闭头侧的胃短血管。3 ~0 Prolene 缝线连续缝合脾门及胃底。(4)取脾:将去除的脾脏放进无菌塑料袋标本带中,把脐下观察孔扩大至2 ~3 cm,拉出塑料袋口,用剪刀把脾脏切割成小块,用卵圆钳取出。(5)脾组织大网膜包埋:将脾组织剪成5×5 mm 大小的小薄片,约16 ~20 片,气腹重建,入内窥镜放置,用1 号丝线将薄片脾组织在网膜组织有血管的区域缝合包埋。(6)脾窝冲洗。仔细检查伤口表面有无出血。常规将引流管置于脾窝内,每个穿刺孔切口用丝线缝合。
开腹组∶常规方法行左侧肋缘下斜行切口进腹探查,行一般步骤脾切除术。切除脾脏后常规行自体脾大网膜包埋术。
1.3 统计学处理
计量结果以均数±标准差(±s)表示,取用SPSS 16.0 统计软件进行域χ²检验,P<0.05 为差异有统计学意义。
2 结果
2.1 比较组和的对照组的数据
两组患者的手术所需时间区别不大,但是比较组的术中失血量、术后治疗所需天数、术后排气时间及后期恢复饮食都优于对照组。此研究表明,腹腔镜手术具备微创,康复快的明显特点,见表1。
表1 比较组和开腹组围手术期相关资料对照(±s)

表1 比较组和开腹组围手术期相关资料对照(±s)
注:与对照组相比,(P <0.05)研究组术中出血量、术后肛门排气时间、术后饮食恢复及住院时间优于对照组(P <0.05)。
组別 手术时间(min)术中出血<(mL)术后排气时间(h)术后恢复饮食时间(h)术后治疗时间(d)比较组 119.1±32.1 (52.6±5.8)' (24.9±4.7)* (46.1±11.0)' (6.9±2.1)'对照组 113.0±28.9 271.0±13.2 48.1±5.4 81.3±19.9 9.2±3.3
腹腔镜切除术组较传统脾切除术组住院天数明显缩短、总住院费明显降低(P<0.05),但两组日均治疗费差异无统计学意义(P>0.05),见表2。
表2 腹腔镜切除术组与传统脾切除术组患者住院天数及住院费用比较(±s)
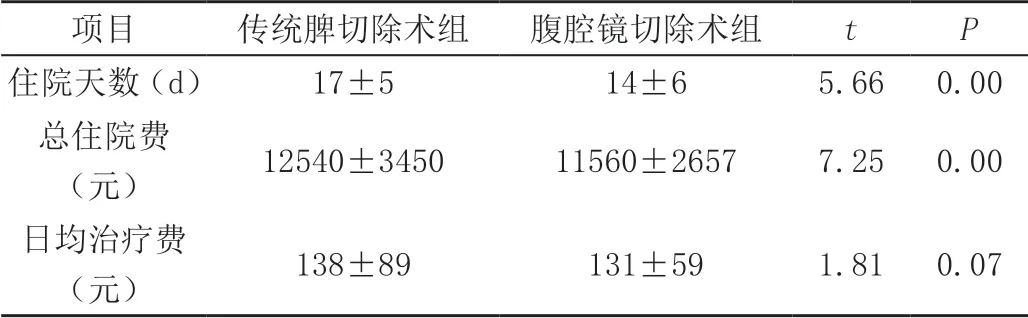
表2 腹腔镜切除术组与传统脾切除术组患者住院天数及住院费用比较(±s)
注:与对照组相比,P <0.05。
项目 传统脾切除术组 腹腔镜切除术组 t P住院天数(d) 17±5 14±6 5.66 0.00总住院费(元) 12540±3450 11560±2657 7.25 0.00日均治疗费(元) 138±89 131±59 1.81 0.07
2.2 组患者术后并发症出现率
脾术后并发症主要出现为门静脉系统血栓形成,腹腔出血和感染,其中比较组出现1 例并发症,对照组并发症发生率达3 例(20%),经χ2检验(P<0.05),表明比较组的并发症发生率低于对照组也就是说腹腔镜手术方式具有明显优势,见表3。

表3 比较组和开腹组术后并发症对照(例)
3 讨论
脾脏破裂在闭合性腹部损伤占比20%~50%,是较为常见的脏器损伤[1]。临床上1991 年Delaitre 第一个运用腹腔镜脾切除术,它的成功得到临床医师的多数重视,表明了较为复杂的腹腔内手术也可以在腹腔镜下完成。腹腔镜脾切除术被宽泛运用于脾脏外科各个领域,脾脏常见的疾病运用最多。2006 年首例急诊腹腔镜下脾切除术由Dissanaike 等人报道,从此之后腹腔镜下脾切除术被开始应用于外伤导致的脾脏破裂患者[2]。随着对脾脏功能和脾切除后相关疾病的研究进展,在保证病患生命安全的前提下,有多种手术方式被应用于外伤性脾破裂的患者,大致分为:
(1)保留脾脏的手术:包括脾脏缝扎止血、电凝止血,脾脏射频消融止血,脾脏部分血管栓塞止血术等[3-4];(2)脾部分切除手术;(3)脾切除手术,即本文中涉及的腹腔镜脾切除术和开放脾切除术。笔者所在的单位也在治疗外伤性脾破裂患者时也进行了一些保留脾脏手术,此回顾性研究仅探讨行脾切除术的患者。众多研究表明,腔镜和传统切除手术比较,腹腔镜具有微创、治疗时间短、并发症出现概率低等优势。研究显示,由于通过腹腔镜的放大作用,脾脏可以显露良好及周围的血管、脾门结构、脾周围韧带、胰腺组织更加清晰可见;同时给术中超声刀的使用带来了方便,准确性更高、减少不必要的损伤,使手术中的失血量显著减少[5-6]。腹腔镜下气腹的使用能够使腹腔内压力增高,减少手术过程中的出血。传统开放手术切除脾脏手术切口较大,需切断部分肌肉组织;脾脏位于上腹部腹腔深面,开放手术时需持续牵拉腹壁组织才能使脾脏充分暴露,术后患者手术区域疼痛明显较腔镜组严重,同时术后镇痛药物的使用也不利于患者早期下床活动及胃肠道功能恢复,比较组在手术后放气时间、手术后吃东西的复原时间、手术后整个治疗时间少于对照组,表明腹腔镜下的手术方式有利于加快患者的术后康复,对术后的胃肠道功能恢复是很不错的治愈方式[7]。本研究中开放手术组发生2例术后腹腔内出血,考虑为手术时止血不确切引起出血,行再次手术探查后发现为脾门处小动脉出血导致,予缝扎止血后痊愈,1 例腹腔内感染,考虑为术中损伤胰腺导致胰漏引起,予加强引流、抑制胰腺外分泌等治疗后痊愈[8]。腹腔镜组患者手术的并发症的发生率优于对照组,其原因考虑为腔镜下放大的手术视野能够使术者选择更加清晰正确的手术层面,有利于手术更加安全顺利地进行。比较组虽然会使用相对更多的手术器械,但住院总费用较对照组更低,考虑为开放手术患者术后观察、禁食时间较长,相应使用药物更多,因此导致手术后相关治疗费用升高[9]。
综上所述,在适合的病例选择下,腹腔镜下脾切除手术治疗闭合性脾脏破裂损伤是安全、可靠的,具有创伤小、患者恢复快、更符合卫生经济学等特点,适合进一步在临床推广。

