应用微滴数字PCR同时检测瓜类种子携带果斑病菌和角斑病菌
赵子婧 芦钰 田文 王玉玺 温常龙 李健强 徐秀兰 罗来鑫
关键词微滴数字PCR;real_time PCR;种子带菌检测;西瓜嗜酸菌;丁香假单胞菌黄瓜致病变种
我国是世界蔬菜种植大国,种植面积、总产量和出口量等均居世界第一。葫芦科植物共有118属825种,广泛分布于热带和亚热带地区,其中不乏多种重要的蔬菜作物。我国葫芦科植物共有32属154种35变种,常见的有西瓜、甜瓜、黄瓜、南瓜、西葫芦等。根据世界粮农组织(FAO)统计结果,近十年我国西瓜、甜瓜和黄瓜的种植面积和产量逐年增加,种植面积和产量均居世界第一。然而瓜类细菌性病害尤其是果斑病和角斑病的频频发生严重影响了我国葫芦科作物的生产。
西瓜嗜酸菌Acidovorax citrulli(Ac),是引起果斑病的病原细菌,为重要的世界检疫性有害生物。西瓜嗜酸菌为革兰氏阴性菌,主要分为两个组群,其中GroupⅡ群主要侵染西瓜,GroupⅠ群主要侵染除西瓜外的其他作物,如甜瓜、黄瓜、葫芦等。果斑病发病初期在子叶和果实上都表现为水浸状的斑点,在发病后期,真叶上有黄色晕圈的褐色小斑,在果实上会导致果皮龟裂,果肉腐烂。
丁香假单胞菌黄瓜致病变种Pseudomonas sy-ringae pv.1achrymans(Psl),是引起角斑病的病原细菌,革兰氏阴性,主要寄主为黄瓜,也可侵染甜瓜、西瓜等葫芦科作物,以及部分茄科作物和豆科作物。角斑病发病初期为水浸状病斑,随后会受到叶脉的限制呈多角形或者不规则形病斑,果实上为水浸状病斑,可导致果实溃烂,溢出白色菌脓。
两种病原菌侵染甜瓜初期,叶片症状较为相似,难以区分,而果斑病造成西瓜、甜瓜等果实水浸状腐烂的损失更大。由于两种病原细菌均可通过种子传播,对种子进行带菌检测,减少因带菌种子引起病害流行是种传病害防控的首要环节。
微滴数字PCR(droplet digital PCR,ddPCR)是可以实现准确定量的一种新的核酸扩增技术,被称为第三代PCR技術。该技术将含有DNA或RNA的PCR体系分成数万个油包水的纳米级微滴,每个微滴里可能不含或含1个甚至多个核酸分子,每个微滴都作为一个独立的PCR体系,经PCR扩增后,对每个微滴反应进行检测,有荧光信号的微滴判读为1,没有荧光信号的微滴判读为0,根据泊松分布原理及阳性微滴的个数与比例即可得出靶标分子的起始拷贝数。即利用有限稀释,PCR反应和泊松分布实现核酸浓度的绝对定量,也可高度灵敏和准确地对低浓度的核酸进行绝对定量。与荧光定量PCR相比,ddPCR技术具有更高的灵敏度和特异性,可实现无需外部标准的绝对定量,简化了计算。目前ddPCR技术广泛用于生物医学、基因表达分析、拷贝数变异分析、转基因食品检测等,在植物病害的检测方面应用很少。最早在2014年,Dreo等利用ddPCR首次检测了两种检疫性植物病原菌——梨火疫病菌Erwinia amylovora和马铃薯青枯病菌Ralstonia solanacearum,随后Zhao等利用ddPCR技术对柑橘溃疡病进行检测,发现与real-time PCR相比,ddPCR的灵敏性、重复性均高于reabtime PCR,并降低了铜离子对反应的干扰。此外,Wang等利用ddPCR通过收集双通路荧光信号实现了对转基因水稻的两个靶标基因的检测。
本研究建立了应用ddPCR技术同时检测瓜类细菌性果斑病和角斑病的技术方法,并与荧光定量PCR技术进行平行测试,比较分析了两种方法对种子带菌检测的灵敏性与稳定性。
1材料与方法
1.1供试菌株及培养条件
丁香假单胞菌黄瓜致病变种P.syringae pv.lachrymans菌株NCPPB543(后文简称丁香假单胞菌)分离自黄瓜,由中国农业大学种子病理学实验室提供;西瓜嗜酸菌A.citrulli由北京市农林科学院蔬菜研究中心提供,其中,菌株Xul7-15分离自西瓜种子,分型为Ⅱ型;菌株Xu201807,分离自甜瓜发病果实,分型为工型。两个菌株分别用于制备带菌的西瓜和甜瓜种子。菌株Xul7-15用于混合菌悬液和混合DNA的制备。菌株悬浮于15%甘油,保存在-80℃冰箱中。菌株活化采用PF培养基(蛋白胨20g/L,琼脂15g/L,甘油10mL/L,1 mol/L磷酸氢二钾14 mL/L,1mol/L硫酸镁14 mL/L)于28℃培养2d。
分别将浓度为10cfu/mL的西瓜嗜酸菌和丁香假单胞菌进行10倍梯度稀释,系列浓度菌悬液,将制备好的菌悬液冻存于-20℃。
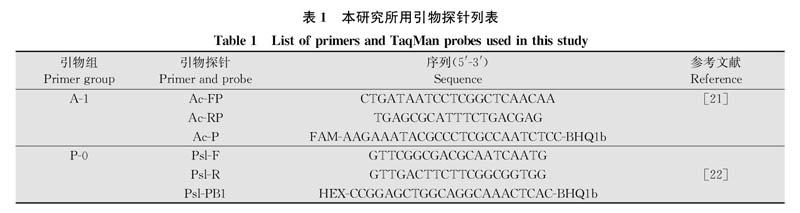
1.2 ddPCR引物探针组合
参考相关文献,前期测试了2组西瓜嗜酸菌引物探针与1组丁香假单胞菌引物探针不同组合,选择A-1为检测西瓜嗜酸菌的引物探针,P-0为检测丁香假单胞菌的引物探针(表1)。所有引物探针均由北京六合华大基因科技有限公司合成。
1.3 ddPCR检测体系与反应程序
ddPCR采用Qx200全自动微滴式数字PCR系统(北京汇力宏业生物科技有限公司),包含Qx200微滴自动生成仪、Qx200微滴读取仪以及QuantaSoft数据分析软件。反应总体系24止,保存。
1.4 real-time PCR检测体系与反应程序
1.5西瓜嗜酸菌和丁香假单胞菌菌悬液样品制备
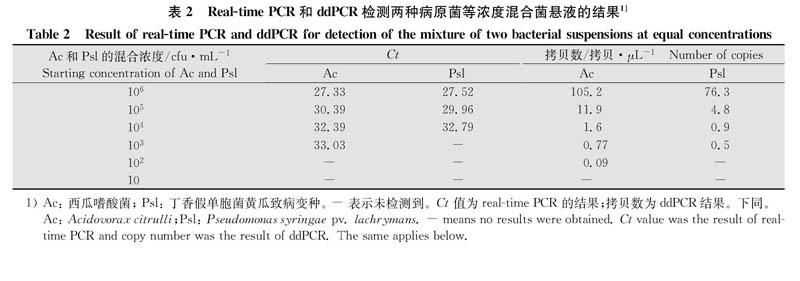
1.5.1等浓度混合菌悬液
将浓度分别为10cfu/mL的西瓜嗜酸菌和丁香假单胞菌菌悬液等体积混合,得到菌浓度为10cfu/mL的等浓度混合菌悬液,按同样的方法制备菌浓度为10~10cfu/mL的等浓度混合菌悬液。以混合菌悬液为模板,分别用real-time PCR和ddPCR进行检测。
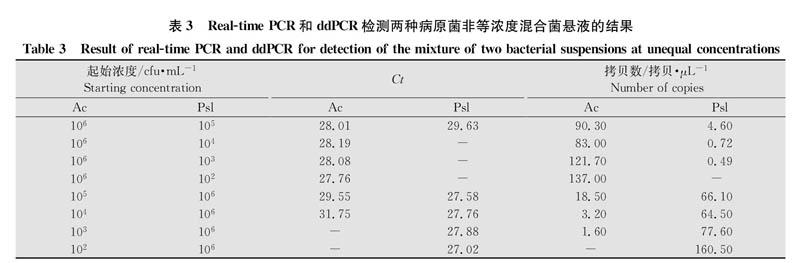
1.5.2非等浓度混合菌悬液
在106 cfu/mL西瓜嗜酸菌菌悬液中分别加入等体积的10~10cfu/mL的丁香假单胞菌菌悬液,得到高浓度西瓜嗜酸菌和低浓度丁香假单胞菌的非等浓度混合菌悬液;同样地,制备高浓度丁香假单胞菌和低浓度西瓜嗜酸菌的非等浓度混合菌悬液。以非等浓度混合的菌悬液为模板,分别用real-timePCR和ddPCR进行检测。
1.6西瓜嗜酸菌和丁香假单胞菌DNA样品制备
1.6.1 DNA提取
从PF培养基上分别刮取西瓜嗜酸菌和丁香假单胞菌,用无菌水制备成菌悬液。用DNA提取试剂盒(北京全式金EasyPure Bacteria Genomic DNAKit)分别提取西瓜嗜酸菌和丁香假单胞菌的DNA,测定DNA浓度并稀释至22.8 ng/μL。
1.6.2两种细菌等浓度DNA混合样品制备
将两个靶标的DNA分别梯度稀释,各得到22.8~2.28×10ng/μL的8个DNA样品,冻存于一20℃。取等体积等浓度两种菌的DNA样品混合均匀,得到混合DNA浓度为22.8~2.28×10ng/μL的混合样品。以混合DNA为模板,分别用real-timePCR和ddPCR进行检测。
1.6.3两种细菌非等浓度DNA混合样品制备
在22.8 ng/vL西瓜嗜酸菌DNA样品中分别加入等体积的2.28~2.28×10ng/μL的丁香假单胞菌DNA样品,得到高浓度西瓜嗜酸菌和低浓度丁香假单胞菌的非等浓度混合DNA样品;同样地,制备高浓度丁香假单胞菌和低浓度西瓜嗜酸菌的非等浓度混合DNA样品。以非等浓度混合的DNA为模板,分别用real-time PCR和ddPCR进行检测。
1.7带菌西瓜和甜瓜种子样品制备及检测
1.7.1西瓜带菌种子制备
以经检测确认未携带西瓜嗜酸菌和丁香假单胞菌的西瓜种子(‘国蜜101)作为样品制备的供试材料。取两份西瓜种子(各50 g)分别完全浸泡在10cfu/mL的西瓜嗜酸菌和丁香假单胞菌菌悬液中,28℃,120 r/min培养2 h,取出种子,自然晾干2~3 d,获得分别携带西瓜嗜酸菌和丁香假单胞菌的西瓜种子。将分别携带西瓜嗜酸菌和丁香假单胞菌的西瓜种子按照粒数比0:0、1:0、1:1、1:5、1:10、5:1、10:1、0:1(均为实际混入的粒数)混入健康种子中,得到样本总量为100粒/份与500粒/份的种子样品各8份。试验设置3次重复,共准备100粒/份与500粒/份的樣品各24份。
1.7.2西瓜种子样品带菌检测
以1:4的比例在检测样品中加入PBST洗涤缓冲液,用均质器激烈拍打1 min后,28℃120 r/min培养4 h,之后放置冰箱4℃培养过夜,第2天再次拍打1min,用双层纱布过滤,收集洗涤液于50 mL离心管中。以4000r/min低速离心10min,收集上清液,再以10000r/min高速离心10min,弃上清液,用1mL无菌水重悬底部沉淀,得到种子洗涤液原液,分别用real-time PCR和ddPCR进行检测。
1.7.3带菌甜瓜种子样品制备及检测
甜瓜种子(‘京玉6号)接菌方法、种子样品制备、检测方法与西瓜种子相同。
2结果与分析
2.1 ddPCR和real-time PCR检测两种病原菌混合菌悬液样品
用ddPCR和real-time PCR对西瓜嗜酸菌和丁香假单胞菌等浓度混合菌悬液进行检测,结果如表2所示。混合菌悬液浓度为10cfu/mL时,real-time PCR可以同时检测到两个靶标菌,浓度为10cfu/mL时可检测到混合菌悬液中的西瓜嗜酸菌,但未检测到等浓度的丁香假单胞菌;而ddPCR可以同时检测两个靶标菌的混合菌悬液浓度为10du/mL,可检测到10cfu/mL混合菌悬液中的西瓜嗜酸菌,但未检测到等浓度的丁香假单胞菌。对于等浓度混合菌悬液,ddPCR的检测灵敏度比real-time PCR高1个数量级。
非等浓度混合菌悬液的检测结果如表3所示。当西瓜嗜酸菌菌悬液浓度恒定为10cfu/mL时,real-time PCR能检测到的丁香假单胞菌的最低浓度为10du/mL,而ddPCR为10cfu/mL;当丁香假单胞菌悬液浓度恒定为10du/mL时,real-time PCR能检测到的西瓜嗜酸菌的最低浓度为10cfu/mL,而ddPCR为10cfu/mL。采用real-time PCR检测,当某种菌含量高时,另一种低浓度病原菌的检测灵敏度受到抑制,而ddPCR不受高浓度靶标的干扰,提高了对低浓度靶标的检测灵敏度。
2.2 ddPCR和real-time PCR检测两种病原菌混合DNA样品
以西瓜嗜酸菌和丁香假单胞菌等浓度混合DNA为模板的检测结果如表4所示。Real-timePCR可以同时检测到两种靶标菌的最低DNA浓度为;ddPCR可检测的最低DNA浓度为ddPCR的检测灵敏度比real-time PCR高1个数量级。
西瓜嗜酸菌和丁香假单胞菌非等浓度DNA混合样品的检测结果如表5所示。在22.8ng/μL西瓜嗜酸菌DNA中混入等体积不同浓度的丁香假单胞菌的DNA时,real-time PCR可在1 000:1比例下检测到低浓度的丁香假单胞菌DNA,而ddPCR检测限达到10 000:1;在22.8 μg丁香假单胞菌DNA中混入等体积不同浓度的西瓜嗜酸菌的DNA时,real-timePCR和ddPCR对低浓度的西瓜嗜酸菌DNA的检测限也分别为1000:1和10000:1。ddPCR对低浓度靶标的检测灵敏度是real-time PCR的10倍。
2.3 ddPCR和real-time PCR检测携带两种病原菌的种子样品
人工接菌的西瓜、甜瓜种子经浸提、平板培养检测,获得西瓜、甜瓜带菌种子,带菌量稳定在10~10cfu/粒。当检测样本容量为100粒或500粒未添加人工接菌种子的健康对照时,real-time PCR和ddPCR对西瓜、甜瓜种子的检测结果均为阴性(表6)。
在健康西瓜种子中混入接菌种子的样品检测结果如表6所示:在100粒西瓜种子样品中ddPCR可以稳定地检测到1%的带菌种子,且3次重复结果一致;而对于同一个样品real-time PCR未能得到3次重复一致的阳性结果。当保持西瓜嗜酸菌带菌率为1%,增加携带丁香假单胞菌的种子数到5粒或者10粒时,ddPCR均可检测到带菌率低的西瓜嗜酸菌及带菌率高的丁香假单胞菌(5%~10%),同样地,丁香假单胞菌带菌率为1%,而西瓜嗜酸菌带菌率为5%~10%,采用ddPCR仍可同时检测到两种菌。但是real-time PCR对带菌率差异大的样品检测结果并不稳定,未能每次都检测到带菌率为1%的西瓜种子,尤其是对丁香假单胞菌的检测重复性较差,当检测样品中携带西瓜嗜酸菌与丁香假单胞菌的种子粒数比大于5:1时,real-time PCR 3次重复都未能检出丁香假单胞菌。

