灰飞虱共生真菌P450过量表达介导的吡虫啉抗药性
张月亮 刘宝生 王利华
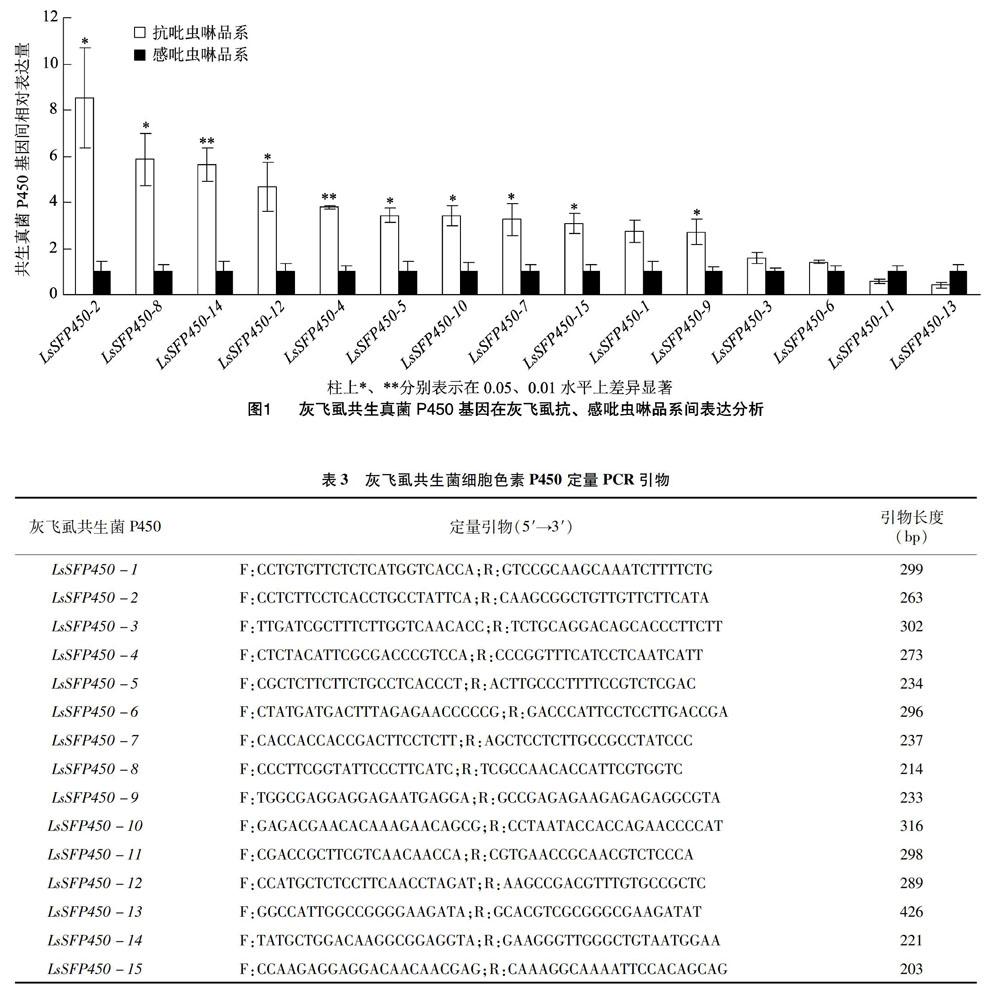
摘要:昆虫共生菌广泛参与寄主昆虫抗药性的形成,但对其抗性产生的分子机制的研究相对较少。本研究首先在室内敏感品系基础上建立了灰飞虱抗、感吡虫啉品系,利用现有灰飞虱转录组数据库,序列验证并定量分析了15条灰飞虱共生真菌P450基因,与敏感品系相比,发现其中10条P450基因在吡虫啉抗性品系中显著过量表达(LsSFP450-2、LsSFP450-8、LsSFP450-14、LsSFP450-12、LsSFP450-4、LsSFP450-5、LsSFP450-10、LsSFP450-7、LsSFP450-15、LsSFP450-9),由此推断灰飞虱共生真菌P450解毒代谢途径同样是介导吡虫啉抗药性的潜在因子,此结果为宿主共生菌介导杀虫剂抗性研究及田间害虫有效化学防控提供了新理论视角。
关键词:灰飞虱;共生真菌;P450;吡虫啉;过量表达;抗药性
杀虫剂抗药性是威胁粮食安全生产的重要难题,解析杀虫剂抗药性机制是化解抗性难题的重要理论依据。杀虫剂抗性机制主要包括解毒代谢抗性和靶标抗性,解毒基因过量表达或突变致使代谢杀虫剂能力增强是解毒代谢抗性的主要表现形式,已知的解毒代谢基因主要包括脂酶,谷胱甘肽-S-转移酶,细胞色素P450多功能氧化酶 [1-4];靶标抗性涉及靶标基因突变,杀虫剂结合靶标能力减弱是导致害虫产生高水平抗药性的主因。不同类型的杀虫剂具有不同的作用靶标,目前研究发现杀虫剂靶标主要包括有机磷和氨基甲酸酯类杀虫剂靶标乙酰胆碱脂酶,环戊二烯类杀虫剂靶标γ-氨基丁酸(GABA)受体,双酰胺类杀虫剂靶标鱼尼丁受体,苯甲酰脲类杀虫剂靶标几丁质合成酶,新烟碱类杀虫剂靶标乙酰胆碱受体,菊脂类杀虫剂靶标钠离子通道等[5-11]。
昆虫体内栖息多种共生菌,这些共生菌与宿主昆虫形成了和谐的相互依存关系,宿主共生菌不仅能为寄主昆虫提供必要营养,还能调控昆虫自身免疫。近年来研究表明,多种共生菌广泛参与宿主昆虫对杀虫剂的抗性,但目前为止,对于共生菌介导的昆虫抗性分子机制研究相对较少 [12-15]。
灰飞虱是一种重要的水稻害虫,其不仅能通过刺吸危害,还能传播多种病毒病,对灰飞虱进行有效防控尤其是减缓杀虫剂抗性产生已成为水稻安全生产的重要环节[16-19]。吡虫啉是一种重要的新烟碱类杀虫剂,其对稻飞虱具有优异的杀虫活性,但抗性监测表明稻飞虱已对其产生不同程度的抗药性[20-21]。本研究首先建立灰飞虱抗、感吡虫啉品系,然后检测灰飞虱体内几种共生真菌P450基因在灰飞虱抗、感吡虫啉品系间的表达情况,此结果将为昆虫共生菌介导的杀虫剂抗性研究提供重要依据。
1 材料与方法
试验时间: 2016年1月至2019年12月,地点:江苏省农业科学院植物保护研究所。
1.1 供试昆虫
灰飞虱云南敏感品系(YN)于2001年采自云南省楚雄市,室内不接触任何杀虫剂饲养至今,吡虫啉抗性品系(YN-IMR)以云南敏感品系为材料,经过63代的不连续筛选,选择2 500头3龄若虫,保持大约70%死亡率的杀虫剂筛选压力。所有试虫在人工气候室温度: 26 ℃,光周期:14 h光照、10 h黑暗中采用武运粳7号稻苗饲养。
1.2 生物测定
药剂配制:吡虫啉原药用N,N-二甲基甲酰胺配制成母液(含10%曲拉通X-100)。吡虫啉母液兑水稀释配成供试藥液。生物测定方法——浸苗法[19]:采用武运粳7号水稻依次浸种、催芽、播种至幼苗长至约15 mm高,每次重复用4根15 mm高稻苗浸泡吡虫啉药液30 s,然后晾干5 min,用镊子取出放入做好标记对应的塑料杯中,用湿润无菌纸包裹稻苗根部,并确保底部无积水,采用吸虫器吸取3龄若虫灰飞虱15头转移至药液处理过的稻苗中,每个处理共计4个重复,用纱布和橡皮筋把杯口封牢,所有试虫在温度为26 ℃,光周期为14 h光照、10 h黑暗中饲养,于 120 h 后统计死亡率(注意稻苗根部保湿,确保无积水)。
1.3 RNA提取和定量分析
总 RNA 的提取参照 Promega的SV Total RNA Isolation System试剂盒说明书进行,提取的总RNA用1%琼脂糖凝胶电泳和微量分光光度计 (Eppendorf BioPhotometer Plus) 检测其质量和浓度,RNA样品于-80 ℃保存, cDNA合成参照TaKaRa的PrimeScript RT Master Mix (Perfect Real Time) 试剂盒说明书进行。反应体系包括500 ng总RNA,2 μL 5×反转录缓冲液 (PrimeScript RT Master Mix),用无RNA酶水补充至总体积为10 μL,混样在PCR仪中37 ℃温育30 min,85 ℃灭活10 s,qPCR以 β-actin(AY192151.1)为内参[4],取1 μL稀释20倍的 cDNA为模板,分别加入10 μL Taq 酶预混液(SYBR Premix Ex TaqTM)、0.4 μL RoxTM参比染料(ROX Reference Dye)(50×)和0.4 μL 10 μmol/L 上游和下游引物,补充无菌水至总体积为20 μL。qPCR程序为95 ℃预变性30 s;95 ℃ 5 s、60 ℃ 31 s,40个循环;最后进行溶解曲线扩增。
1.4 数据分析
生物测定数据采用 PoloPlus 软件分析,根据致死中浓度(LC50,mg/L),共生真菌P450基因相对表达量的计算采用 2-ΔΔCT 法[22]。以敏感品系为对照,比较灰飞虱抗、感吡虫啉品系中不同真菌P450相对表达量,结果分析均采用SPSS 19.0,统计分析采用Students T-test,分别在0.05和0.01水平上进行差异显著性分析。
2 结果与分析
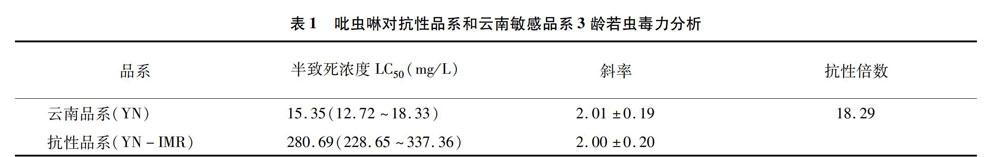
2.1 灰飛虱抗吡虫啉品系抗性倍数
毒力分析显示灰飞虱抗吡虫啉品系LC50为28069 mg/L, 灰飞虱云南敏感品系的LC50为 15.35 mg/L,根据抗性倍数计算公式: 抗性倍数=抗性品系LC50 /敏感品系LC50,即280.69 /15.35=18.29倍(表1)。
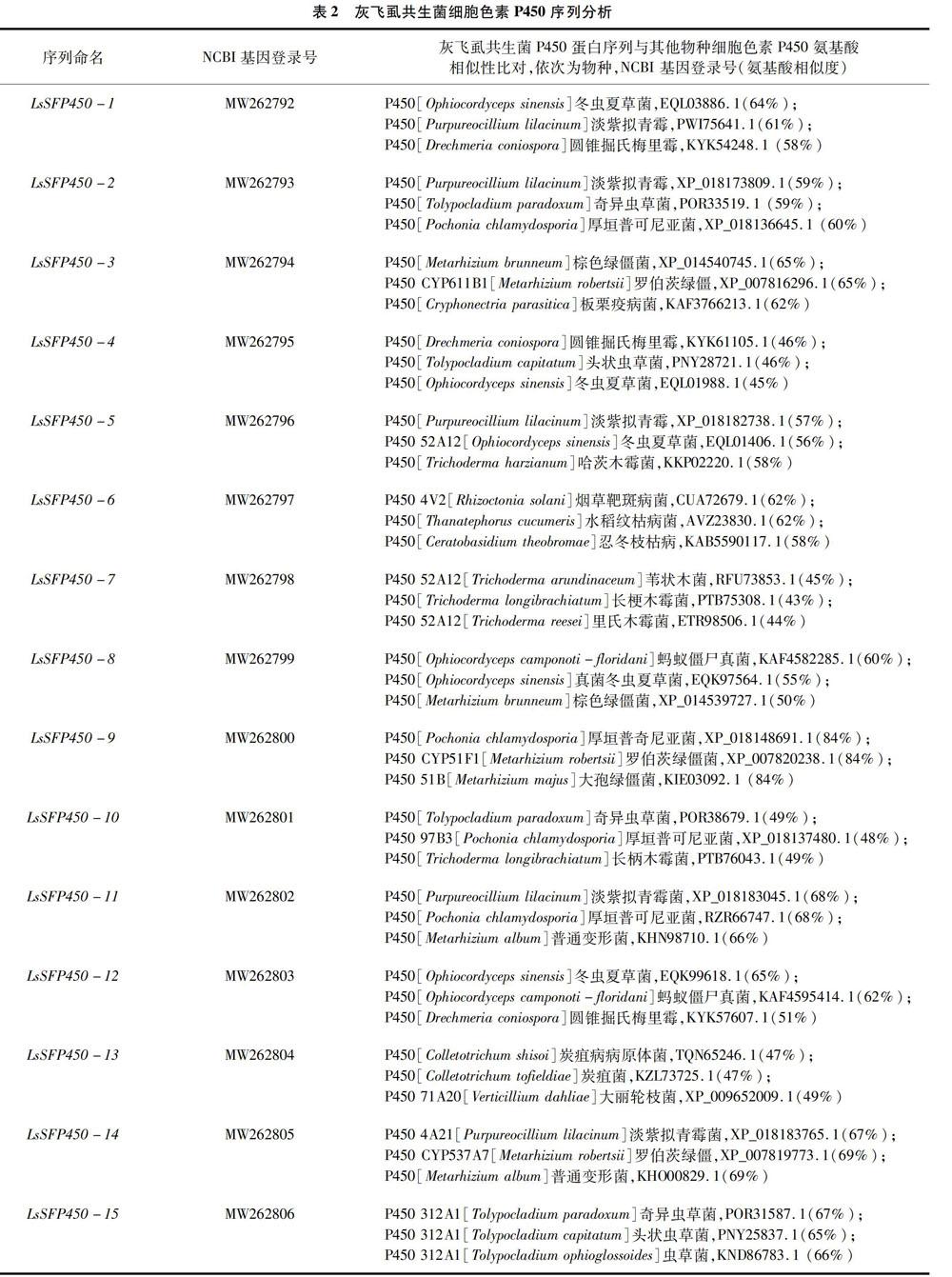
2.2 灰飞虱共生菌P450序列分析
根据灰飞虱转录组数据库,通过NCBI序列比对和分析,共计发现15条灰飞虱共生真菌P450基因,并将这些共生真菌P450序列提交NCBI数据库,氨基酸序列比对发现其和已发表的真菌P450序列具有较高的氨基酸相似性,序列信息详见表2。
2.3 灰飞虱抗、感吡虫啉品系间共生菌P450表达分析
与敏感品系相比,15条共生真菌P450基因中,发现10条灰飞虱共生真菌P450呈现显著性或极显著性过量表达(图1),由此说明,过量表达的共生真菌P450解毒代谢与灰飞虱抗吡虫啉的发生存在潜在联系,灰飞虱共生真菌P450定量引物见表3。
3 讨论与结论
昆虫共生菌介导的杀虫剂抗性一般涉及3种途径: 一是共生菌通过增加寄主免疫力来抵抗杀虫剂的毒力胁迫; 二是共生菌通过自身的解毒代谢酶分解杀虫剂为无毒代谢物从而减弱对宿主的危害;三是共生菌通过调控宿主解毒代谢因子来增强杀虫剂抗性[23-26]。
细胞色素P450多功能氧化酶是一种广谱的解毒代谢酶,其广泛参与昆虫抗药性,昆虫细胞色素P450活性增加导致其抗药性水平升高的研究相对较多[3, 27-31],尽管前期笔者所在课题组也发现多个灰飞虱P450过量表达与吡虫啉抗性相关[31],在灰飞虱转录组数据库中笔者所在课题组同样鉴定出15条共生菌真菌P450基因,定量分析发现其中10条真菌P450基因在灰飞虱对吡虫啉的抗性品系中同样呈现显著过量表达,由此说明共生真菌解毒代谢途径也是介导灰飞虱抗吡虫啉的潜在作用因子。此外,本研究所用的灰飞虱抗吡虫啉品系源于室内连续饲养多年的云南敏感品系,在此基础上建立的吡虫啉抗、感品系具有相似的遗传背景,在一定程度上消除了田间复杂的杀虫剂抗性背景,也使得利用此抗性、敏感品系进行抗性分子机制研究更具说服力。本研究首次揭示了宿主共生菌P450过量表达与灰飞虱抗吡虫啉直接相关,此结果丰富了共生菌参与宿主杀虫剂的抗性研究内容,为新药创制及田间害虫抗性治理提供依据。
参考文献:
[1]Giraudo M,Unnithan G C,le Goff G,et al. Regulation of cytochrome P450 expression in Drosophila:genomic insights[J]. Pesticide Biochemistry and Physiology,2010,97(2):115-122.
[2]Xu Z B,Zou X P,Zhang N,et al. Detoxification of insecticides,allechemicals and heavy metals by glutathione S-transferase SlGSTE1 in the gut of Spodoptera litura[J]. Insect Science,2015,22(4):503-511.
[3]Zhang Y L,Guo H F,Yang Q,et al. Overexpression of a P450 gene (CYP6CW1) in buprofezin-resistant Laodelphax striatellus (Fallén)[J]. Pesticide Biochemistry and Physiology,2012,104(3):277-282.
[4]Zhang Y L,Wang L H,Guo H F,et al. A transcriptome-based screen of carboxylesterase-like genes that are involved in chlorpyrifos resistance in Laodelphax striatellus (Fallén)[J]. Pesticide Biochemistry and Physiology,2012,104(3):224-228.
[5]Liu Z,Williamson M S,Lansdell S J,et al. A nicotinic acetylcholine receptor mutation conferring target-site resistance to imidacloprid in Nilaparvata lugens (brown planthopper)[J]. Proceedings of the National Academy of Sciences,2005,102(24):8420-8425.
[6]Nakao T,Kawase A,Kinoshita A,et al. The A2′ N mutation of the RDL γ-aminobutyric acid receptor conferring fipronil resistance in Laodelphax striatellus(Hemiptera:Delphacidae)[J]. Journal of Economic Entomology,2011,104(2):646-652.
[7]Ranson H,Jensen B,Vulule J M,et al. Identification of a point mutation in the voltage-gated sodium channel gene of Kenyan Anopheles gambiae associated with resistance to DDT and pyrethroids[J]. Insect Molecular Biology,2000,9(5):491-497.
[8]Suzuki Y,Shiotsuki T,Jouraku A,et al. Benzoylurea resistance in western flower thrips Frankliniella occidentalis (Thysanoptera:Thripidae):the presence of a point mutation in chitin synthase 1[J]. Journal of Pesticide Science,2017,42(3):93-96.
[9]Troczka B,Zimmer C T,Elias J,et al. Resistance to diamide insecticides in diamondback moth,Plutella xylostella (Lepidoptera:Plutellidae) is associated with a mutation in the membrane-spanning domain of the ryanodine receptor[J]. Insect Biochemistry and Molecular Biology,2012,42(11):873-880.
[10]Zhang Y L,Li S,Xu L,et al. Overexpression of carboxylesterase-1 and mutation (F439H) of acetylcholinesterase-1 are associated with chlorpyrifos resistance in Laodelphax striatellus[J]. Pesticide Biochemistry and Physiology,2013,106(1/2):8-13.
[11]Zhang Y L,Han Y C,Yang Q,et al. Resistance to cycloxaprid in Laodelphax striatellus is associated with altered expression of nicotinic acetylcholine receptor subunits[J]. Pest Management Science,2018,74(4):837-843.
[12]Douglas A E. The B vitamin nutrition of insects:the contributions of diet,microbiome and horizontally acquired genes[J]. Current Opinion in Insect Science,2017,23:65-69.
[13]Vilcinskas A. Evolutionary plasticity of insect immunity[J]. Journal of Insect Physiology,2013,59(2):123-129.
[14]Gressel J. Microbiome facilitated pest resistance:potential problems and uses[J]. Pest Management Science,2018,74(3):511-515.
[15]Pang R,Chen M,Yue L,et al. A distinct strain of Arsenophonus symbiont decreases insecticide resistance in its insect host[J]. PLoS Genetics,2018,14(10):e1007725.
[16]周益軍,刘海建,王贵珍,等. 灰飞虱携带的水稻条纹病毒免疫检测[J]. 江苏农业科学,2004,32(1):50-51.
[17]陈思宏,程兆榜,马学文,等. 江苏和云南地区水稻条纹叶枯病流行差异分析[J]. 江苏农业科学,2013,41(3):88-90.
[18]李 硕,王世娟,訾金燕,等. 灰飞虱从离体病叶快速获得水稻条纹病毒的方法[J]. 江苏农业学报,2014,30(2):449-451.
[19]王利华,方继朝,刘宝生. 几类杀虫剂对灰飞虱的相对毒力及田间种群的抗药性现状[J]. 昆虫学报,2008,51(9):930-937.
[20]潘以楼,陈啸寅,朱桂梅,等. 镇江地区褐飞虱种群对吡虫啉的抗药性及其治理[J]. 江苏农业科学,2008,36(4):122-123.
[21]Liu Z W,Han Z J,Wang Y C,et al. Selection for imidacloprid resistance in Nilaparvata lugens:cross-resistance patterns and possible mechanisms[J]. Pest Management Science,2003,59(12):1355-1359.
[22]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[23]Xia X M,Zheng D D,Zhong H Z,et al. DNA sequencing reveals the midgut microbiota of diamondback moth,Plutella xylostella (L.) and a possible relationship with insecticide resistance[J]. PLoS One,2013,8(7):e68852.
[24]Kikuchi Y,Hayatsu M,Hosokawa T,et al. Symbiont-mediated insecticide resistance[J]. Proceedings of the National Academy of Sciences,2012,109(22):8618-8622.
[25]李 娜,陈建明,张珏锋,等. 褐飞虱共生菌抗感吡虫啉菌株体内抗氧化酶活性的比较[J]. 植物保护学报,2011,38(3):258-264.
[26]Cai T W,Zhang Y H,Liu Y,et al. Wolbachia enhances expression of NlCYP4CE1 in Nilaparvata lugens in response to imidacloprid stress[J]. Insect Science,2020,28(2):12834.
[27]Balabanidou V,Kampouraki A,MacLean M,et al. Cytochrome P450 associated with insecticide resistance catalyzes cuticular hydrocarbon production in Anopheles gambiae[J]. Proceedings of the National Academy of Sciences,2016,113(33):9268-9273.
[28]Liu N N,Li M,Gong Y H,et al. Cytochrome P450s-their expression,regulation,and role in insecticide resistance[J]. Pesticide Biochemistry and Physiology,2015,120:77-81.
[29]Feyereisen R. Insect P450 inhibitors and insecticides:challenges and opportunities[J]. Pest Management Science,2015,71(6):793-800.
[30]王靈军,叶昌林,郑明辉,等. 细胞色素 P450 介导的果蝇抗药性研究进展[J]. 基因组学与应用生物学,2019(3):1304-1309.
[31]Zhang Y C,Liu B S,Zhang Z C,et al. Differential expression of P450 genes and nAChR subunits associated with imidacloprid resistance in Laodelphax striatellus (Hemiptera:Delphacidae)[J]. Journal of Economic Entomology,2018,111(3):1382-1387.常晨晨,王晓莉,朱红艳,等. 设施内不同施肥处理对辣椒生长及土壤养分的影响[J]. 江苏农业科学,2021,49(3):110-115.

